瀉肺逐飲湯對惡性胸水大鼠胸水及胸膜組織中TGF-β1的影響*
李竹英 王 玨 王晶波 劉建秋
(黑龍江中醫藥大學附屬第一醫院,黑龍江 哈爾濱 150040)
惡性胸水是泛指惡性腫瘤的胸膜轉移或胸膜自身惡性腫瘤所致的胸腔積液,是癌癥晚期的一種常見并發癥[1],嚴重影響患者生活質量。本研究通過觀察瀉肺逐飲湯聯合力爾凡對惡性胸水大鼠胸水及胸膜組織中轉化生長因子(TGF)-β1的影響,探討了瀉肺逐飲法防治惡性胸水的作用機理,為進一步的臨床應用提供理論和實驗依據。
1 材料與方法
1.1 動物 Wistar清潔級大鼠100只,雌雄各半,購自哈爾濱醫科大學第二附屬醫院實驗動物中心,體質量(220±20)g。大鼠雌雄分籠于室溫約23℃,黑夜和白晝各12 h的環境中,適應性喂養3 d后進行造模。
1.2 藥物 瀉肺逐飲湯:由葶藶子、黨參、生黃芪、薏苡仁、山慈菇、桂枝、白術、茯苓、椒目、甘草組成。上藥以常溫常壓煎藥機煎煮而成,黑龍江中醫藥大學附屬第一醫院制劑室提供。力爾凡:吉林省一心制藥有限公司生產,批號10970426,規格:10 mg/支,以生理鹽水按1∶1比例稀釋。
1.3 試劑及瘤株 艾氏腹水瘤(EAC)細胞株,購自南京康克諾德實驗動物有限責任公司。石蠟、4%多聚甲醛、乙醇、蘇木精、伊紅等,均由黑龍江中醫藥大學附屬第一醫院病理科提供。兔抗大鼠TGF-β1免疫組化試劑盒:購自北京中山生物技術有限公司。生物素化山羊抗兔IgG(H+L):購自北京中杉金橋生物技術有限公司。辣根酶標記鏈親和素:購自上海研域化學試劑有限公司。顯色劑DBA:購自福州邁新生物技術有限公司。烏拉坦,北京通州育才精細化工廠,批號980922。
1.4 儀器 光學顯微鏡:OLYMPUS光學工業株式會社,型號:OLYMPUSU-LBD-2;超凈工作臺:蘇州安泰空氣凈化有限公司,型號:SW-CJ-Fl;石蠟包埋機:沈陽龍首電子儀器有限公司,型號:L-100;石蠟切片機:德國SLEE公司;超低溫冰箱:日本三洋公司,型號:MDF-328;恒溫箱:Eppendorf德國;電子天平:JA1003,Pharmacia Bioteeh,Britain。
1.5 分組與造模 將100只大鼠隨機分為正常對照組、模型組、中藥組、力爾凡組、聯合用藥組共5組,每組20只。參照文獻[2]方法改進。艾氏腹水癌細胞株每周傳代1次,取荷瘤7 d的Wistar大鼠,抽取小量腹水,置于消毒的干試管內,鏡下進行細胞分類計數。以生理鹽水調整細胞濃度,用細胞計數板計數腫瘤細胞濃度至5×107/mL。用臺盼藍拒染法檢測細胞存活性,提示活細胞數>95%時,再抽取腹水放入無菌容器內,置冰塊上保存,以上法稀釋調整細胞濃度至1×108/mL。大鼠以25%烏拉坦麻醉后,將大鼠右側背部用刮刀脫毛,局部常規消毒,用穿刺針自大鼠右側腋后線與第11、12肋間交點處垂直刺入,當針頭刺入胸膜腔時感覺有落空感后注入0.3 mL上述腫瘤細胞懸液。共造模80只。正常對照組用同樣方法胸腔注射生理鹽水0.3 mL。
1.6 給藥方法 正常對照組及模型組:予3 mL生理鹽水灌胃,每日1次。中藥組:按生藥量16.14 g/(kg·d)灌胃瀉肺逐飲湯,每日 1次。 力爾凡組:力爾凡用生理鹽水 1∶1稀釋,按 1 mg/(kg·d),于造模后1、3、5、7 d,腹腔注射。聯合用藥組:按生藥量16.14 g/(kg·d)灌胃瀉肺逐飲湯,并予力爾凡以生理鹽水 1∶1稀釋,按1 mg/(kg·d),于造模后 1、3、5、7 d,腹腔注射。 各組給藥時間均為7 d。
1.7 標本采集與檢測 在造模后的第8日,將大鼠以25%烏拉坦麻醉后,頸動脈放血處死,每組處死12只。(1)大鼠惡性胸腔積液的采集:以75%乙醇消毒后切開皮膚,在胸前區右側第9肋間隙處以眼科鑷鈍性分離胸肌達胸腔內,游離膈肌腹面,小心地暴露右側胸腔,自膈肌腹面向右側胸腔進針,用5 mL注射器盡量抽取胸腔積液。觀察胸腔積液外觀,并記錄各組大鼠胸腔積液量,精確到0.1 mL。同時每只鼠收集2 mL胸液,以4℃、2500 r/min離心15 min,取上清液置于4℃恒溫箱內保存待測。(2)大鼠胸膜組織的采集:處死大鼠后,剪開右側胸腔,剪取壁層胸膜,固定于4%多聚甲醛固定液中,常規脫水,石蠟包埋,切成4 μm厚的切片,蘇木素-伊紅(HE)染色,光鏡下觀察組織形態學改變。組織標本制作固定后72 h內進行免疫組織化學染色法檢驗。
1.8 統計學處理 應用SPSS18.0統計軟件。計量資料以(±s)表示,等級資料采用χ2檢驗;組間比較用多樣本方差分析。P<0.05為差異有統計學意義。
2 結 果
2.1 各組大鼠胸水TGF-β1免疫組化結果 見表1。正常對照組大鼠胸水TGF-β1少量表達,各治療組胸水中癌細胞間質上均有表達。
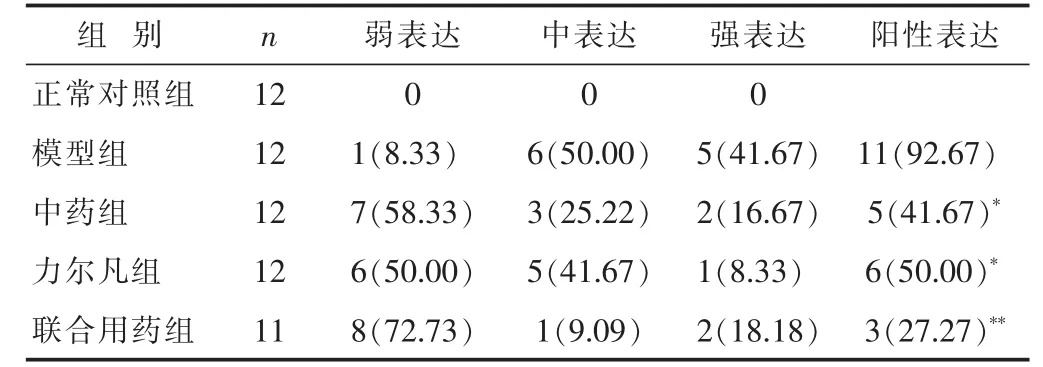
表1 各組大鼠胸水TGF-β1免疫組化結果比較n(%)
2.2 各組大鼠胸膜組織TGF-β1免疫組化結果 見表2。正常對照組大鼠胸膜組織TGF-β1少量表達,各治療組胸膜中癌細胞均有表達。
表2 各組大鼠胸膜TGF-β1免疫組化結果比較(±s)
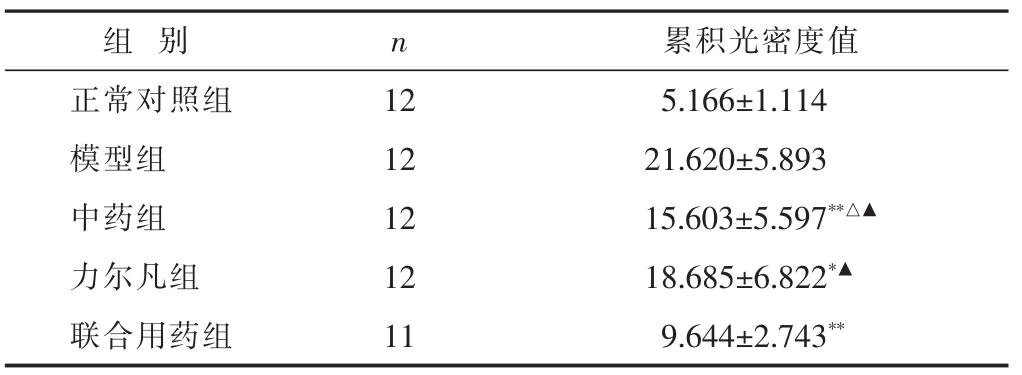
表2 各組大鼠胸膜TGF-β1免疫組化結果比較(±s)
與力爾凡組比較,△P<0.05;與聯合用藥組比較,▲P<0.01。
組 別正常對照組n 12累積光密度值5.166±1.114模型組 12 21.620±5.893中藥組 12 15.603±5.597**△▲力爾凡組 12 18.685±6.822*▲聯合用藥組 11 9.644±2.743**
3 討 論
TGF-β是一組具有多種調節功能的細胞因子,對細胞的生長、分化、凋亡、細胞外基質合成和免疫反應等有著廣泛影響[3]。TGF-β1對腫瘤細胞的生長具有雙向調節作用。腫瘤早期,TGF-β1能夠抑制c-myc基因表達的,使腫瘤細胞的生長停滯在G1期,而在腫瘤的晚期,由于機體對TGF-β1反應性降低,從而促進腫瘤細胞過度生長,TGF-β1對于T細胞的免疫抑制作用,也造成了腫瘤細胞的免疫逃逸。加之,TGF-β1可以促進腫瘤血管的形成,促進了腫瘤的過度生長。研究表明,TGF-β1還是一種致纖維化因子,可以促進胸膜組織的纖維化[4]。
本實驗結果顯示:模型組大鼠胸水中TGF-β1含量高于各治療組,與中藥組、力爾凡組、聯合用藥組比較差異顯著(P<0.05或0.01);力爾凡組、中藥組與聯合用藥組比較無差異(P>0.05)。模型組大鼠胸膜組織中TGF-β1含量高于各治療組,與中藥組和聯合用藥組比較有顯著差異(P<0.01);中藥組含量低于力爾凡組(P<0.05);聯合用藥組含量明顯低于中藥組和力爾凡組(P<0.01)。模型組大鼠胸水和胸膜組織中的TGF-β1含量高,提示了在惡性胸腔積液和組織中TGF-β1出現高表達,證實了TGF-β1對晚期的惡性腫瘤具有促進作用。而瀉肺逐飲湯能夠降低胸水和胸膜組織中的TGF-β1含量,說明瀉肺逐飲湯能降低惡性腫瘤組織TGF-β1的表達,從而抑制腫瘤的生長和轉移。
[1]Sahn SA.Management of malignant pleural effusions[J].Monaldi Arch Chest Dis,2001,56(5):394-399.
[2]蔣鵬娜.逐飲I號對惡性胸水大鼠血清TUM2-PK和胸膜組織bFGF 的影響[D].哈爾濱:黑龍江中醫藥大學,2008:26.
[3]Scott A,Sasse-Martin RJ,Gary DK.Pleural fluidtransforming growth factor-beta1 correlates with pleural fibrosis in experimental empyema[J].Am J Respir Crit Care Med,2003,168(6):700.
[4]Chen CH,Seguin-Devaux C,Burke NA,et al.Transforming growth factor beta blocks Tec kinase phosphorylation,Ca2+influx,and NFATc translocation causing inhibition of T cell differentiation[J].J Exp Med,2003,197(12):1689-1699.

