雙氫青蒿素對人骨肉瘤細胞株143B增殖和凋亡的作用
劉躍亮,羅進勇,張 彥,何通川,曾照芳
(1.重慶醫科大學檢驗醫學院,臨床檢驗診斷學教育部重點實驗室,重慶,400016; 2.美國芝加哥大學醫學中心分子腫瘤學研究室,芝加哥 60637)
骨肉瘤是兒童和青少年最常見的原發惡性骨腫瘤之一,具有高惡性、早轉移、預后差、生存率低等特點。雖然,近年來輔助化療和新輔助化療的廣泛開展與應用,大為改善患者生存率,但是,現有化療藥物毒副作用大,而且,長時間住院治療給患者帶來的經濟負擔,往往不能使患者堅持化療而導致腫瘤發生早轉移、復發,甚至被迫截肢,治療效率得不到提高,這越來越引起臨床醫生的關注和腫瘤研究者的重視。因此,研究新型的、高效低毒的抗人骨肉瘤藥,成為骨肉瘤治療研究的重點。
青篙素是我國學者從中藥青篙中提取的含有過氧基團的倍半萜內酯(藥用植物的生物活性組分)藥物。而雙氫青蒿素為青蒿素的衍生物之一,由青蒿素經四氫硼鈉還原而成,分子式為C15H24O5,分子質量為284.35 ku,是青蒿素類藥物在體內的主要的活性形式之一。很多文獻研究表明,雙氫青蒿素及其他衍生物除具有抗瘧作用外,還可有效減輕狼瘡腎炎動物模型的病理損害[1],此外,DHA也具有良好的抑制肺癌、前列腺癌、結直腸癌細胞、卵巢癌等的增殖和促進其凋亡的作用[2~6],具有明顯的腫瘤殺傷作用。新藥的多方面應用成為新藥研究的新思路。但是,DHA在抗骨肉瘤方面的研究甚少。本研究就雙氫青蒿素對人骨肉細胞的作用以及可能的作用機制進行探討,為雙氫青蒿素應用于人骨肉瘤治療提供理論依據。
1 材料與方法
1.1 設備 化學發光成像分析系統(BIO-RAD,ChemiDoc XRS+,bio-rad laboratories,Inc),凝膠成像分析系統(BIO-RAD,bio-rad laboratories,Inc)。
1.2 細胞培養及試劑 人骨肉瘤細胞購自ATCC (American type culture collection)。細胞培養用DMEM培養基含10%的胎牛血清和1%青、鏈霉素(P/S),培養條件為5%CO2和37℃。噻唑鹽MTT、二甲基亞砜(DMSO)和胰蛋白酶/EDTA溶液均購自美國Sigma公司。雙氫青蒿素購自四川三奇制藥有限責任公司,用DMSO溶解并配制為70 mmol·L-1藥液,備用。DMEM培養基、胎牛血清(FCS)、青霉素/鏈霉素(P/S)購自美國Thermo scientific公司。Hoechst 33258(C1011)購自Beyotime。β-Catenin熒光素酶報告質粒,由美國芝加哥大學醫學中心分子腫瘤學實驗室,何通川教授惠贈。Lipofectamine2000 (Cat.No.11668-02)購自Inveitrogen。熒光素酶檢測試劑購自Promega公司。BCA試劑盒,購自Thermo Scientific。以下抗體均購自Santa Cruze Biotechnology公司:mouse monoclonal antibody Bad(C-7):sc-8044;mouse monoclonal antibody Bcl-2(c-2):sc-7382;mouse monoclonal antibody Caspase-3(46):sc-136219;rabbit polyclonal antibody PCNA(FL-261): sc-7907。
1.3 方法
1.3.1 實驗分組 根據前期實驗,實驗分為Control(空白對照)、DMSO(溶劑對照)、15、25、35 μmol ·L-1DHA 5組。
1.3.2 MTT試驗 取對數生長期的單層貼壁細胞,用0.25%胰蛋白酶消化并吹打成單個細胞,制備成約為5×106個·L-1的細胞懸液,在96孔板中,每孔加入100 μl細胞懸液,待細胞貼壁后,按照預定的實驗分組進行實驗處理(每組進行8個復孔),處理結束前4 h,每孔加入 MTT(5 g·L-1) 0.02 ml,4 h后,在492 nm處進行吸光度(OD值)測定,并繪制細胞存活圖。此實驗重復3次。
1.3.3 克隆形成試驗 取對數生長期的單層貼壁細胞,用0.25%胰蛋白酶消化并吹打成單個細胞,制備成細胞密度約為150個/ml的細胞懸液,6孔板,每孔加入1 ml細胞懸液,待細胞貼壁后,按照預定的實驗分組進行實驗處理,置37℃,5%CO2及飽和濕度環境下,靜置培養,在d 10終止培養,棄去上清液,用PBS小心漂洗2次。固定(固定液為1∶3醋酸/甲醇)15 min,然后進行結晶紫活細胞染色30 min,用細流水緩慢漂洗去除染色液,自然風干。觀察細胞克隆形成,在顯微鏡(低倍鏡)計數大于10個細胞的克隆數,進行克隆形成計數并計算克隆形成率。此實驗重復3次。克隆形成率/%=克隆數/接種細胞數×100%。
1.3.4 Hoechst 33258染色 取對數生長期的單層貼壁培養細胞,用0.25%胰蛋白酶消化并吹打成單個細胞,制備成細胞密度約為5×107個·L-1的細胞懸液,24孔板,每孔加入0.5 ml細胞懸液,待細胞貼壁后,按照預定的實驗分組進行實驗處理。待處理時間結束,加入Hoechst 33258溶液(1 g·L-1),37℃水溶7 min,冰上冷卻,離心棄染液,PBS重懸,在紫外450 nm處觀察藍色熒光。正常對照細胞和壞死細胞呈弱藍色,凋亡細胞呈高亮藍色且觀察到核固縮。此實驗重復3次。
1.3.5 螢光素酶報告質粒試驗 將指數生長狀態的細胞鋪于24孔板中,待細胞貼壁后,利用Lipofectamine 2000轉染0.3 μg報告質粒,5 h后終止轉染并更換為正常培養基,按實驗分組處理,24 h后裂解細胞,按照試劑盒說明進行螢光素酶活性測定。BCA法測定裂解液總蛋白濃度,校正螢光素酶活性。每組實驗重復3次,結果取平均值。
1.3.6 Western blot 人骨肉瘤143B細胞在DHA處理24 h后,使用碧云天WESTERN BLOT細胞裂解液(按說明書操作),收集蛋白樣品(Protein sample preparation),在收集的蛋白樣品中加入適量濃縮的SDS-PAGE蛋白上樣緩沖液。沸水浴10 min,使蛋白質充分變性,然后進行SDS-PAGE電泳。此實驗重復3次。
1.4 統計學分析 利用IBM SPSS Statistics 19軟件對數據進行處理,實驗數據以±s表示,不同組間比較采用方差分析。
2 結果
2.1 DHA抑制骨肉瘤細胞143B增殖
2.1.1 DHA明顯地抑制143B細胞增殖活性和存活率(MTT比色法和結晶紫染色法) 不同濃度的DHA作用于人骨肉瘤143B細胞,24 h后,MTT比色法結果如Fig 1A所示,試驗組較對照組,細胞增殖活性明顯降低,且表現出濃度和時間依賴的的抑制效果。結晶紫染色結果如Fig 1B所示,處理組較對照組,細胞數明顯減少,DHA濃度達到35 μmol· L-1時,效果最為明顯。

Fig 1 Inhibitory effect of DHA on 143B osteasarcoma cell lines(±s,n=3)
2.1.2 DHA有效地減弱143B細胞克隆形成能力
DHA在明顯抑制143B細胞增殖活性的同時,也抑制其克隆形成能力,如Fig 2克隆形成實驗結果所示,各實驗分組克隆形成率分別為0.607、0.580、0.453、0.313、0.253。

Fig 2 Effect of clone formation after DHA played role in 143B osteosarcoma cells
2.1.3 DHA抑制了細胞增殖蛋白PCNA表達 為了進一步說明DHA具有抑制人骨肉瘤細胞143B增殖的能力,研究中檢測了增殖細胞核抗原(proliferating cell nuclear antigen,PCNA),DHA作用人骨肉瘤細胞143B,24 h后,Western blot檢測結果(如Fig 4)顯示PCNA蛋白表達減少,不能正常的發揮DNA聚合酶δ的輔助蛋白[7]的作用,使143B細胞DNA合成受限制,從而抑制其增殖。
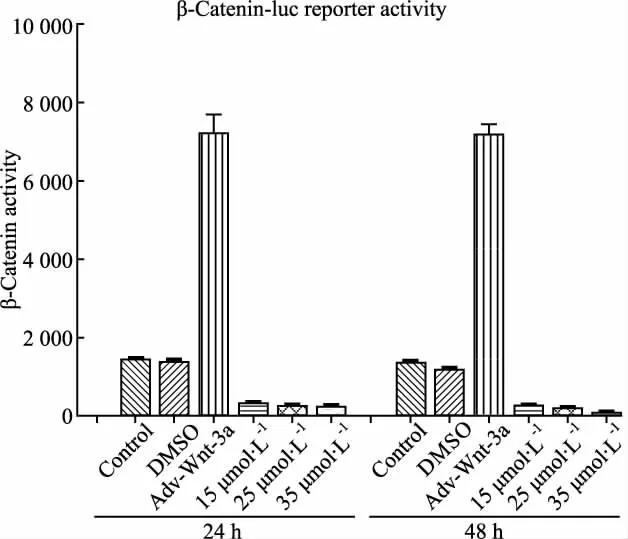
Fig 3 Activity of β-Catenin inhibited by DHA after its role in 143B cell lines
2.1.4 DHA抑制了Wnt-β-catenin信號轉導通路中關鍵蛋白因子β-Catenin活性 因為Wnt-β-catenin信號轉導通路異常與人類疾病密切相關,尤其是腫瘤方面。因此,研究中構建了β-Catenin熒光素酶質粒(p-Top),腺病毒介導的Wnt-3a過表達(陽性對照),結果顯示,如Fig 3,Adv-Wnt-3a可有效刺激β-Catenin活性,而實驗組只有很微弱的β-Catenin活性,表明DHA抑制了Wnt-β-catenin信號轉導通路中關鍵蛋白因子β-Catenin的活性。

Fig 4 Decreased expression of PCNA protein induced by DHA in 143B cell lines
2.2 DHA誘導人骨肉瘤細胞143B凋亡
2.2.1 DHA促進143B細胞凋亡(Hoechst 33258細胞凋亡染色法) Hoechst33258細胞凋亡染色結果,如Fig 5所示,DHA作用于143B細胞24 h后,對照組,細胞形態完整、核大小一致、熒光分布均勻且呈彌散狀,顯示微弱藍色,實驗組較對照組,細胞核表現為明顯的核縮小、染色質濃集,熒光著色不均勻,呈現細胞凋亡核形態,表明DHA具有誘導人骨內瘤細胞143B凋亡的作用。

Fig 5 Apoptosis of 143B osteosarcoma cell lines induced by DHA in Hoechst 33258 dye,and concentration-dependently
2.2.2 DHA使凋亡相關蛋白發生明顯改變 通過檢測與細胞凋亡密切相關的Bcl-2家族成員[8],Bcl-2和Bad,以及執行細胞凋亡的蛋白因子Caspase-3[9],在蛋白質水平上,進一步研究DHA誘導細胞凋亡的可能機制。Western blot結果,如Fig 6所示,Bcl-2蛋白表達下調,而Bad蛋白表達上調,增加了Bad與Bcl-2結合[10],從而抑制Bcl-2的抗凋亡活性,同時Caspase-3表達增高,表明其促凋亡功能被增強。所以,Western bolt結果提示DHA可有效地促進 143B細胞凋亡,可能是通過上調 Bad和Caspase-3蛋白,增加其促凋亡功能,并減弱Bcl-2蛋白的抗凋亡活性來發揮作用。
3 討論
雙氫青蒿素及其他衍生物,是一類藥效明顯、治愈率高、毒副作用和耐藥性發生極低的抗瘧藥物,尤其對耐氯喹或對多種藥物耐藥的腦型瘧和惡性瘧有效[11],因此,被廣泛應用于臨床,還被WHO批準為抗瘧一線藥物。雙氫青蒿素與青蒿素相比,水溶性較強,更易吸收,排泄和代謝迅速、高效、低毒等優點。隨著研究的深入,人們發現雙氫青蒿素除了特異地抗瘧作用外,還具有抗炎、調節免疫、抑制瘢痕增生及抗腫瘤作用,尤其在抗腫瘤方面,抗腫瘤活性強,而對正常組織細胞的毒性很低,因此被廣泛關注。本研究中,采用不同濃度的雙氫青蒿素(DHA)體外作用于人骨肉瘤細胞株143B,通過MTT比色法檢測發現(見Fig 1),不同濃度的DHA可以抑制骨肉瘤細胞143B的增殖,而且抑制率與DHA的濃度和時間存在依賴關系,當DHA濃度達到35 μmol ·L-1,作用48 h后,與對照組相比,抑制增殖效果最為明顯,差異有顯著性(P<0.01),而且143B細胞的克隆形成能力也明顯受到抑制(見Fig 2)。
腫瘤的發生和發展,是多步驟、多階段、多因素共同參與的結果。其中增殖和凋亡失控是其生理功能上最大的改變,表現為過度增殖和凋亡抑制。因此,對增殖和凋亡的干預,成為腫瘤治療研究中的切入點。
細胞凋亡是有機體為保持自身組織穩定、調控自身細胞的增殖和死亡之間的平衡、由基因控制的細胞主動性死亡過程[12]。正常的細胞凋亡,受凋亡調節基因的嚴格調控,其中Bad和Bcl-2蛋白是重要的凋亡調節蛋白家族的重要成員,在組織中廣泛表達。Bcl-2通過C末端疏水性氨基酸錨定于線粒體外膜,而Bad則散布于基質中,激活后移位至線粒體表面與Bcl-2作用,通過調控線粒體膜電位及通透性轉換通道,釋放線粒體膜間隙的促凋亡蛋白,如細胞色素C、Smac/DIABLO、AIF和endonuclease G(endoG)等,后者激活半胱氨酸蛋白酶(caspase)家族引發caspase級聯反應并最終引起膜泡形成,核碎裂和細胞凋亡[10]。細胞中Bcl-2與Bad之間的比例決定了細胞是否接受誘導凋亡的信號。在研究中發現,DHA可有效地抑制了Bcl-2的表達,同時上調了Bad蛋白Caspase-3蛋白表達,如Fig 6,即,Bcl-2與Bad之間的比例已經被破壞,高表達的Bad蛋白與Bcl-2結合增多,從而抑制了其抗凋亡作用,同時,通過高表達的Caspase-3,增強其凋亡執行能力,而使143B細胞凋亡增加(見Fig 5)。

Fig 6 Change of protein expression after DHA's role in 143B osteosarcoma cell lines detected by Western blot
研究表明,Wnt-β-Ceatenin信號轉導通路,無論在低等生物果蠅還是高等哺乳動物,都表現出其在生物進化中的保守性,使其成員都具有高度的同源性[13]。該信號通路異常與人類疾病密切相關,尤其在腫瘤的發生發展中。因此。對Wnt-β-Catenin信號轉導通路的研究,不僅有助于理解人類疾病(尤其是腫瘤)可能的發生機制,而且可以為疾病的治療提供一系列新的靶點。研究結果表明,DHA可以有效地降低β-Catenin的生物活性(Fig 3),因此,在后期實驗中,將重點對Wnt-β-Catenin信號通路進行研究,包括β-Catenin降解復合物中糖原合成激酶3β(Gycogen synthesis kinase-3β,GSK-3β)及其磷酸化產物(GSK-3β通過磷酸化Ser33、Ser37和Thr41標記蛋白)蛋白表達,磷酸化位點確認,以及β-ceatenin的靶蛋白,如Cyclin D1、c-Myc等蛋白的表達,進一步對可能的作用機制進行探討和研究,為雙氫青蒿素應用于臨床,提供更有價值的實驗依據。
[1] 董妍君,李衛東,屠呦呦,等.雙氫青蒿素對BXSB小鼠狼瘡腎炎的作用及機制研究[J].中國藥理學通報,2003,19(10): 1025-8.
[1] Dong Y J,Li W D,Tu Y Y,et al.The effect of DQHS on the pathologic changes in BXSB mice lupus nephritis and the effect mechanism[J].Chin Pharmacol Bull,2003,19(10):1125-8.
[2] Jemal A,Siegel R,Ward E,et al.Cancer statistics[J].CACancer J Clin,2008,58(2):71-96.
[3] 高小玲,羅子國,王丕龍,李慶春.雙氫青蒿素誘導前列腺癌PC-3細胞凋亡及其機制研究[J].中草藥,2010,41(1):81-5.
[3] Gao X L,Luo Z G,Wang P L,Li Q C.Induction of dihydroartemicinin on proctate cancer PC-3 apoptosis and its mechanism[J].Chin Tradit Herb Drugs,2010,41(1):81-5.
[4] 戰曉農,黃 燕,王 雷,等.雙氫青蒿素對人結直腸癌裸鼠移植瘤的抑制作用及機制研究[J].中藥新藥與臨床藥理,2011,22(5):491-4.
[4] Zhan X N,Huang Y,Wang L,et al.Antitumor Effect and mechanism of dihydroartemisinin on colorectal cancer in nude mice with transplanted tumor of human colorectal cancer[J].Tradit Chin Drug Res Clin Pharmacol,2011,22(5):491-4.
[5] Chen T,Li M,Zhang R,Wang H.Dihydroartemisinin induces apoptosis and sensitizes human ovarian cancer cells to carboplatin therapy[J].J Cell Mol Med,2009,13(7):1358-70.
[6] 邵義如,朱尤慶,劉 敏.二氫青蒿素對結腸癌細胞系SW480増殖凋亡的影響[J].武漢大學學報,2008,29(3):319-24.
[6] Shao Y R,Zhu Y Q,Liu M.Effects of Dihydroartemisinin on the proliferation and apoptosis of colon carcinoma cell line SW480[J].Med J Wuhan Univ,2008,29(3):319-24.
[7] Essers J,Theil A F,Baldeyron C,et al.Nuclear dynamics of PCNA in DNA replication and repair[J].Mol Cell Biol.2005,25(21): 9350-59.
[8] Lin B,Kolluri S K,Lin F,et al.Conversion of Bcl-2 from protector to killer by interaction with nuclear orphan receptor Nur77-TR3[J].Cell,2004,116(4):527-40.
[9] 牟鈺欽,周龍洋,楊秋珺,等.全反式維甲酸對骨肉瘤細胞143B生長的影響[J].中國藥理學通報,2011,27(8):1091-5.
[9] Mou Y Q,Zhou L Y,Yang Q J,et al.Effect of ATRA on the growth of 143B osteasarcoma cells[J].Chin Pharmacol Bull,2011,27 (8):1091-5.
[10]Norberg E,Gogvadza V,Ott M,et al.An increaseinintra-cellular Ca2+is reguired for the activation of mitochondrial calpain torelease AIF during cell death[J].Cell Death Differ,2008,15(12): 1857-64.
[11]蔡賢錚.抗瘧藥聯用治療我國抗藥性惡性瘧概述[J].海南醫學,2000,12(2):1-4.
[11]Cai X Z.The overview of drug-resistant falciparum malaria treatment by antimalarial combination in China[J].Hainan Med J,2000,12(2):1-4.
[12]Dlugosz P J,Billen L P,Annis M G,et al.Bcl-2 changes conformation to inhibit Bax oligomerization[J].EMBO J,2006,25(11): 2287-96.
[13] Clevers H.Wnt/beta-ceatenin signaling in development and disease[J].Cell,2006,127(3):469-80.

