糖絡寧對糖尿病大鼠背根神經節細胞凋亡的影響*
朱智耀,高彥彬,鄒大威,李步滿,彭繼升
糖尿病周圍神經病變(Diabetic peripheral neuropathy DPN)是糖尿病常見的慢性并發癥之一。其發病機制目前有多種學說,其中氧化應激引起的細胞凋亡在DPN的發生發展中發揮重要作用[1-3]。中藥復方糖絡寧治療DPN的療效在臨床和實驗研究中已得到初步證實[4-8]。本實驗通過觀察糖絡寧對糖尿病大鼠背根神經節(DRG)細胞凋亡、半胱天冬酶-3(Caspase-3)蛋白表達的影響,進一步探討其治療DPN的作用機制,為更好地指導臨床用藥提供理論及實驗依據。
1 材料
1.1 動物
SPF/VAF級雄性8周齡 SD大鼠,體重180g~220g,由北京維通利華實驗動物公司提供。分籠飼養于北京中醫藥大學屏障環境動物實驗室,環境溫度控制在 20℃ ~25℃,相對濕度 40% ~70%,12/12h光照/黑暗循環。實驗期間大鼠自由進水和進食。
1.2 藥物
中藥制劑糖絡寧浸膏(主藥為生黃芪、生地、牛膝、狗脊、丹參、川芎等)由北京中醫藥大學東方醫院制劑中心提供,1ml浸膏含生藥3g。
1.3 試劑
鏈脲佐菌素為美國 Sigma公司,兔抗大鼠Caspase-3多克隆抗體為美國 Cell Signaling Technology公司產品,原位細胞凋亡檢測試劑盒為Roche公司產品(天津灝洋生物分裝),兩步法免疫組化檢測試劑盒、DAB顯色試劑盒、Mayor,s蘇木素均購自武漢博士德生物工程有限公司。
1.4 儀器
Olympus BX51顯微鏡、Olympus DP71攝像系統、穩豪血糖儀以及血糖試紙(美國LifeScan,Inc)。
2 方法
2.1 模型建立與分組處理
選用雄性SD大鼠適應性喂養1周,隨機選擇8只為正常對照(control)組,其余大鼠禁食不禁水12h后,將鏈脲佐菌素(STZ)溶入檸檬酸緩沖液(p H值=4.2~4.5)配制成1%的溶液,按60mg/kg給予一次性腹腔注射(control組大鼠注射等體積的檸檬酸緩沖液)。72h后大鼠禁食8h斷尾取血,測血糖≥16.7mmol/L視為糖尿病造模成功,造模成功大鼠隨機分為模型組(model)、糖絡寧組(TLN),每組8只,隨即開始灌胃。糖絡寧組按生藥10g/(kg·d)灌胃,模型組給予等量蒸餾水灌胃,連續給藥32周。
2.2 一般情況觀察與血糖測定
觀察各組大鼠毛色、精神狀態、攝食量、飲水量、尿量、日常活動情況等;禁食8h后尾靜脈采血,4周測定1次血糖。
2.3 免疫組化檢測DRG中Caspase-3表達
切片脫蠟至水,3%H2O2室溫孵育10min,以消除內源性過氧化物酶的活性。蒸餾水沖洗后滴加封閉液,室溫孵育10 min甩去多余液體。滴加1∶150稀釋的一抗(Caspase-3多克隆抗體),4℃過夜(并同時用PBS代替一抗作為陰性對照)。次日PBS沖洗,滴加聚合HRP標記抗兔IgG,37℃孵育30 min,PBS沖洗,DAB顯色,自來水充分沖洗,蘇木素復染、脫水透明、封片。從Caspase-3在背根神經節中表達結果判斷,清晰的背景上胞質和(或)核棕黃色為陽性表達,陰性對照無特異性著色。
2.4 DNA末端標記法(TUNEL)檢測細胞凋亡
切片脫蠟至水,蛋白酶 K室溫消化30min后,PBS洗片,與阻斷劑(0.3%H2O2甲醇溶液)室溫孵育30 min,PBS洗片。滴加50ul的 TUNEL反應混合溶液,在濕盒中37℃孵育60 min,PBS沖洗后加入50ul轉化劑-POD,在濕盒中 37℃孵育 30 min,PBS沖洗3次,DAB顯色,蘇木素復染,脫水透明、封片。光鏡下觀察細胞核中出現棕黃色顆粒者為TUNEL染色陽性細胞。
2.5 圖像分析
每張切片在400倍光鏡下選取4個互不重疊的視野,使用Image Pro-Plus 5.0.1圖像分析軟件半定量測定每個視野中所有陽性像素的積分光密度值(IOD),取均值為Caspase-3的結果;TUNEL結果用凋亡神經元的陽性百分率表示,取均值為TUNEL的結果。
2.6 統計學分析
計量資料以均數±標準差(珋x±s)表示,多組均數比較采用方差分析,所有數據均經SPSS13.0軟件處理,P<0.05表示差異有統計學意義。
3 結果
3.1 大鼠一般情況觀察
正常組大鼠精神狀態良好,毛色有光澤,進食和飲水量以及尿量都正常,體重增加明顯,活動自如。模型組大鼠進食和飲水量以及尿量都明顯增多,神態萎靡,毛豎無光澤,尾巴蒼白濕冷,蜷臥拱背,活動少,體重增長緩慢。糖絡寧治療組的大鼠表現與模型組類似,但程度較輕。
3.2 糖絡寧對大鼠血糖值的影響
表1顯示,與正常對照組比較,造模后大鼠血糖明顯升高(P<0.05),同時在未進行糖絡寧干預前(0周),TLN組與模型組血糖值無差異(P>0.05)。在TLN干預8周后大鼠血糖開始下降,與模型組相比有統計學差異(P<0.05)。
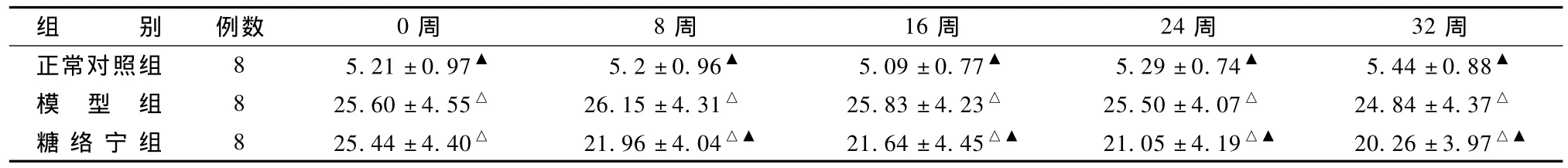
表1 糖絡寧對大鼠血糖值的影響
3.3 糖絡寧對大鼠背根神經節神經元凋亡陽性率的影響
表2圖1顯示,模型組背根神經節神經元的凋亡率與正常對照組相比明顯增加,有統計學差異(P<0.05);糖絡寧組的凋亡率低于模型組,有統計學差異(P<0.05)。
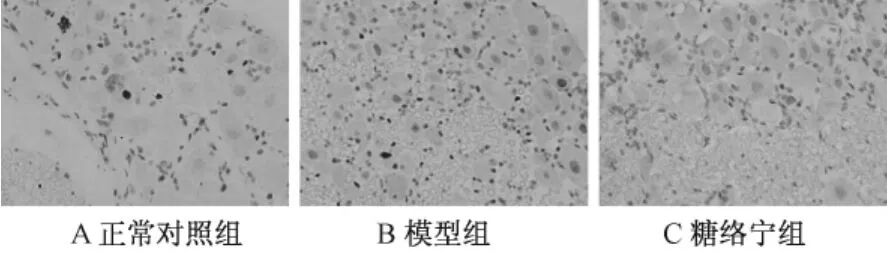
圖1 背根神經節TUNEL染色圖片(×400)
3.4 糖絡寧對大鼠背根神經節Caspase-3蛋白表達的影響
表2圖2顯示,Caspase-3免疫組織化學染色顯示在正常大鼠背根神經節中僅有少量陽性反應。模型組染色呈強陽性反應,棕黃色顆粒狀彌漫分布于胞漿中。經圖像分析處理,模型組積分光密度值與正常對照組相比明顯增多,有統計學差異(P<0.05)。糖絡寧干預后,大鼠背根神經節Caspase-3的表達減少,其積分光密度值與模型組比較有統計學差異(P<0.05)。
4 討論
細胞凋亡主要通路分別為死亡受體介導的凋亡途徑(外在途徑)和線粒體凋亡途徑(內在途徑)[9],內外途徑都是通過激活caspase家族引起細胞凋亡,在caspase蛋白家族中caspase-3又是研究的焦點,幾乎有關caspase的所有凋亡途徑最終都是通過激活caspase-3導致細胞凋亡[10]。Caspase-3酶原激活后可切割不同底物,形成蛋白酶級聯切割放大機制,最終導致細胞凋亡形態學和生化特征的形成。細胞凋亡的生化學特征主要是細胞核內的染色質在核小體間斷裂[11],產生若干大小不一的寡核苷酸片段。TUNEL檢測是1種將細胞凋亡時DNA斷端進行標記的方法,它的檢測原理是熒光素標記的dUTP在脫氧核糖核苷酸末端轉移酶的作用下連接到凋亡細胞中斷裂DNA的3-OH末端,而熒光素能被結合有過氧化物酶的抗熒光素抗體識別,最后利用過氧化物酶與其底物反應而標記出凋亡的細胞核。該方法是最為常用的檢測凋亡手段之一,優點是靈敏度高,特異性強,可原位顯示凋亡細胞及其分布。

表2 糖絡寧對大鼠背根神經節神經元凋亡陽性率及Caspase-3蛋白表達的影響
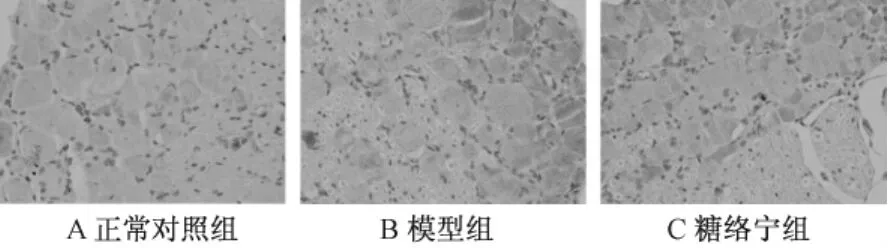
圖2 背根神經節Caspase-3蛋白表達圖片(×400)
糖尿病周圍神經病變是多因素共同作用的結果,細胞凋亡在DPN的發生發展中發揮重要作用。關于DPN細胞凋亡的研究主要集中在背根神經節和坐骨神經,本研究以背根神經節為主。Srinivasan等[12]認為,糖尿病大鼠背根神經節細胞凋亡的增加是DPN的致病因素。Schmeichel等[13]研究也發現,糖尿病大鼠隨病程的延長,DRG神經元凋亡率逐漸上升,且Caspase-3蛋白表達和DRG神經元凋亡與DNA氧化損傷存在明顯相關性,支持氧化損傷導致細胞凋亡。另外,通過體外對DRG神經元的培養發現,隨著培養基中葡萄糖增加,神經突的退變和細胞凋亡增加[14]。在本實驗中,模型組同樣也出現DRG中Caspase-3表達增加、神經元凋亡率上升的現象,在應用糖絡寧干預后細胞凋亡有明顯改善,提示糖絡寧有抑制凋亡的作用。另外,本實驗還觀察到糖絡寧有一定降低大鼠血糖的功效。
現代醫學對于DPN的治療尚無理想方法。糖絡寧以生黃芪、生地、牛膝、狗脊、丹參、川芎等為主要組成,具有益氣養陰、滋補肝腎、活血通絡之效。經多年臨床驗證,可以明顯改善患者肢體麻木、疼痛、反射減弱等神經系統癥狀,對神經傳導速度、末梢微循環積分以及患者氧化應激狀態均有改善作用,在治療過程中未見明顯的不良反應[4、5]。同時動物實驗證明,糖絡寧可有效提高糖尿病大鼠坐骨神經傳導速度,改善糖尿病大鼠的痛覺異常以及氧化應激狀態[6、8]。本實驗結果表明,糖絡寧能抑制DRG中神經元凋亡,從而起到神經保護作用,這可能為DPN治療提供新思路,為DPN臨床防治用藥提供實驗依據,但糖絡寧是通過何種凋亡通路發揮作用有待進一步研究。
[1] Raha S,Robinson BH.Mitochondria,oxygen free radicals,and apoptosis[J].Am J Med Genet,2001,106(1):62-70.
[2] Russell JW,Golovoy D,Vincent AM,et al.High glucose-induced oxidative stress and mitochondrial dysfunction in neurons[J].FASEB J,2002,16(13):1738-1748.
[3] Vincent AM,Russell JW,Low P,et al.Oxidative stress in the pathogenesis of diabetic neuropathy[J].Endocrine Reviews,2004,25(4):612-628.
[4] 周暉,高彥彬,劉銅華,等.糖絡寧治療糖尿病性周圍神經病變的臨床觀察[J].北京中醫藥大學學報,2002,25(4):59-62.
[5] 李步滿,高彥彬,夏晶,等.糖絡寧治療糖尿病周圍神經病變臨床療效及其對氧化應激反應的影響[J].中國中醫藥信息雜志,2011,18(8):8-10.
[6] 張濤靜,高彥彬,關崧,等.糖絡寧對鏈脲佐菌素誘導糖尿病大鼠的血糖及冷、熱刺激反應的影響[J].北京中醫藥大學學報(中醫臨床版),2009,16(2):6-8.
[7] 張濤靜,高彥彬,周暉,等.糖絡寧對STZ誘導糖尿病大鼠坐骨神經傳導速度及病理學的影響[J].中華中醫藥雜志,2009,24(8):1010-1013.
[8] 夏晶.糖絡寧治療糖尿病周圍神經病變的臨床觀察及對氧化應激的影響[D].北京:北京中醫藥大學,2010.
[9] Huang Y,Sheikh MS.TRAIL death receptors and cancer therapeutics[J].Toxicol Appl Pharmacol,2007,224(3):284-289.
[10] Yuan J,Yankner BA.Apoptosis in the nervous system[J].Nature,2000,407(6805):802-809.
[11] 陳青,陳麗.糖尿病及其慢性并發癥與細胞凋亡[J].國外醫學.內分泌學分冊,2001,21(5):236-239.
[12] Srinivasan S,Stevens M,Wiley JW.Diabetic peripheral neuropathy-evidence for apoptosis and associated mitochondrial dysfunction[J].Diabetes,2000,49(11):1932-1938.
[13] Schmeichel AM,Schmelzer JD,Low PA.Oxidative injury and apoptosis of dorsal root ganglion neurons in chronic experimental diabetic neuropathy[J].Diabetes,2003,52(1):165-171.
[14] Russell JW,Sullivan KA,Windebank AJ,et al.Neurons undergo apoptosis in animal and cell culture models of diabetes[J].Neurobiol Dis,1999,6(5):347-363.

