抗C3a多克隆抗體對實驗性結腸炎小鼠的療效初探
陳 宇 魏克民 鄭純威 黃 強 李端楊 吳人照
炎癥性腸病(inflammatory bowel disease,IBD)包括潰瘍性結腸炎(ulcerative colitis,UC)和克羅恩病(Crohn's disease,CD),是一種慢性腸道炎癥,多是由于遺傳易感人群對腸道菌群的異常炎性免疫反應所引發[1]。此病在西方發達國家是一種常見病和多發病。在我國,發病率雖低于西方,但呈明顯上升趨勢,已成為嚴重影響人民健康的消化道疾病之一,對其發病機制和治療方法的探討一直是免疫學研究的重點和難點。三硝基苯磺酸(trinitrobenzene sulfonic acid,TNBS)誘導的小鼠結腸炎病理特征與人類炎癥性腸病(尤其是CD)極為相似,是研究IBD的發病機制,評價治療方案的絕佳動物模型[2]。其主要發病機制為Th1型細胞因子分泌異常造成結腸黏膜損傷[3]。
近年來,有研究表明,補體系統參與了許多炎性和免疫性疾病的發生和發展[4]。但關于炎癥性腸病是否存在補體系統的異常活化以及補體異常活化與炎癥性腸病的關聯性,研究甚少,本文對此問題進行了初步的實驗研究。
材料與方法
1.動物:BALB/c小鼠,雄性,SPF級,體重18~22g,中科院上海實驗動物中心提供,生產許可證號為SCXK(滬)2007-0005。日本大耳白兔,雌性,體重2.0~2.5kg,購自浙江省實驗動物中心,生產許可證號為SCXK(浙)2006-0025。實驗場地為浙江省中醫藥研究院,實驗動物使用許可證號為SYXK (浙)2009-0122。
2.試劑:TNBS為Sigma產品,貨號:P2297。C3a、TNF-α ELISA檢測試劑盒購自BD Bioscience公司。MPO檢測試劑盒和蛋白酶抑制劑購自Roche Diagnostics公司。ACD抗凝劑購自美國Baxter公司。
3.抗C3a抗體的制備:C3a多肽序列為IPMRYSCQRRARLITQGENC,將其與噬孔血藍蛋白(KLH)連接(由杭州中肽公司合成),免疫日本大耳白兔。每次免疫抗原用量為1mg,采用北部多點皮下注射免疫方式,首次免疫(抗原與完全弗氏佐劑質量比為1∶1)后3周加強免疫,以后隔2周免疫(加強免疫時,抗原與不完全弗氏佐劑質量比為1∶1)1次,第3次免疫后14天取血,ELISA檢測血清抗體效價,并檢測抗體對C3a刺激外周血白細胞高表達CD11b生物學效應的影響,評價其中和活性。所獲得的多抗兔血清經硫酸銨飽和沉淀法粗提和蛋白A親和層析柱純化獲得IgG。
4.分組、造模和給藥:BALB/c小鼠隨機分為對照組(n= 10),模型組(n=15),抗C3a抗體預防組(n=15),抗C3a抗體治療組(n=15),潑尼松龍治療組(n=15)。小鼠禁食12h后,腹腔注射速眠新+氯胺酮(速眠新和氯胺酮按1∶1混勻,50微升/只),待小鼠麻醉后,用帶9號針頭的直徑約0.5cm的硅膠管從肛門插入1cm,注入50μl TNBS溶液,對照組注入50μl 50%乙醇,然后將導管繼續插入腸內至4cm,將100μl上述溶液注入腸內,總注入體積為150μl,TNBS劑量為2.5毫克/只。倒置小鼠1min,使藥液達全結腸。對照組和模型組腹腔注射兔IgG,抗體預防組腹腔注射抗C3a抗體,時間間隔為-2,0,2,5天各注射1次,劑量分別為10、50、100微克/(次·只)。抗體治療組的注射劑量為50微克/(次·只),但時間間隔為2、5天各注射1次。潑尼松龍治療組的腹腔注射劑量為1mg/kg,時間間隔與抗體治療組相同。每天稱量體重,觀察腹瀉和血便性狀。
5.結腸病理:分離小鼠結腸組織,甲醛固定,常規包埋、切片,蘇木素和伊紅染色,鏡下觀察。
6.結腸蛋白上清的提取:分離小鼠結腸組織,剪取其中部分(約1.5cm),稱重,將蛋白酶抑制劑與結腸組胺1m l/100mg組織比例混合,用組織勻漿器充分勻漿,將勻漿液轉入1.5ml離心管中,11000g,4℃,離心15min,收集上清,凍于 -40℃待測。
7.酶聯免疫吸附實驗:小鼠靜脈采血后,ACD抗凝,2000r/min離心10min,收集上清,-40℃保存。實驗操作嚴格按照ELISA試劑盒說明進行。
8.統計學方法:采用SPSS統計軟件,數據以均數±標準差±s)表示,多組間兩兩比較采用Oneway-ANOVA統計分析方法,以P<0.05為差異有統計學意義。
結果
1.TNBS腸炎模型建立早期出現明顯的補體活化:補體系統被激活后,形成C3轉化酶,將C3裂解成為C3a和C3b。C3a水平的升高反映了補體活化。因此,我們通過檢測C3a水平以驗證腸炎建立初期是否存在補體活化。如圖1所示,TNBS腸炎建立后2h,與對照組相比,血漿和結腸蛋白上清中C3a含量顯著升高。24h時,血漿中的C3a降至對照組水平,但結腸組織中的C3a水平仍明顯高于對照組。上述結果提示,TNBS腸炎建立早期存在明顯的補體活化,補體活化可能是誘發腸炎的早期事件之一。
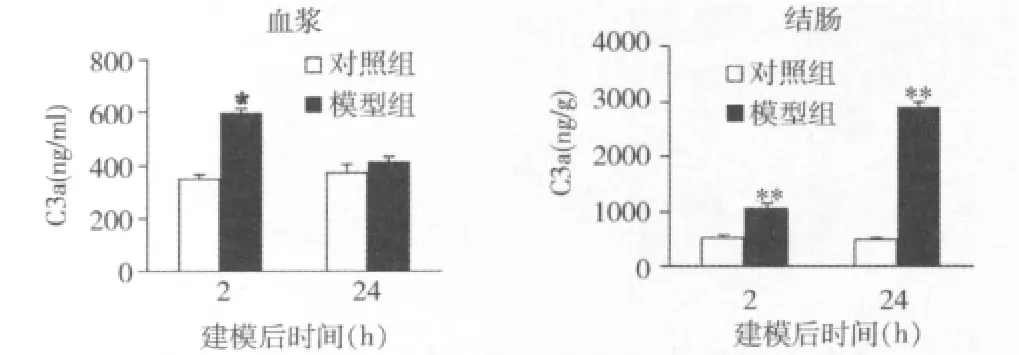
圖1 TNBS腸炎模型建立后不同時間點血漿和結腸組織中補體C3a表達水平檢測
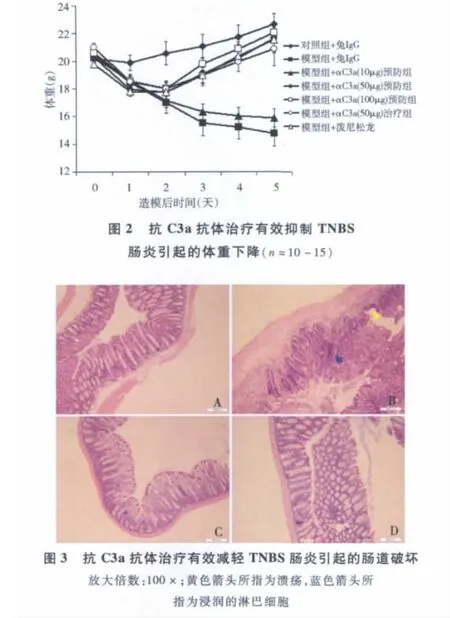
2.抗C3a抗體治療有效緩解TNBS腸炎引起的體重下降:為評價補體C3a在TNBS腸炎中的病理作用,我們制備了抗C3a的多克隆抗體,通過建模前和建模后分別給藥,觀察抗體的治療效果。如圖2所示,與給予兔IgG模型組相比,抗體預防組小鼠體重下降得到明顯遏制,且療效呈一定的劑量依賴性,且小鼠腹瀉癥狀明顯減輕,血便性狀顯著緩解。更為有意義的是,當TNBS腸炎小鼠腹腔注射抗C3a抗體50微克/(次·只)后,小鼠體重降低的癥狀亦得到顯著緩解,腹瀉和血便癥狀明顯減輕,療效與潑尼松龍相當。這表明,抗C3a抗體治療可能具有潛在的臨床應用價值。
3.抗C3a抗體治療有效減輕TNBS腸炎對腸道的破壞:觀察期結束后,分離小鼠結腸組織,進一步觀察抗體治療后腸炎的病理變化。如圖3所示,模型組小鼠結腸絨毛破壞嚴重,腺體減少,可見大量炎性細胞浸潤,而抗體治療組小鼠腸道破壞程度明顯減輕,與潑尼松龍治療組相當。人克羅恩病極為相似,是研究克羅恩病病理機制的理想模型。目前的許多研究主要著重于探究克羅恩病發展后期導致病理性改變的各種因素,并已取得重要的研究進展。但對于誘發克羅恩病的早期事件研究較少,本研究重點探究了補體活化與實驗性腸炎產生之間的關聯性。
我們的實驗結果證實了補體活化是TNBS腸炎建立時的早期事件,并借助抗C3a抗體治療證實了補體活化可能是一個重要的促炎因素。鑒于補體C3a是一公認的趨化因子,TNBS腸炎建立時,機體可通過多種途徑激活補體系統(如經典、旁路、凝集素途徑),產生大量的C3a,從而募集粒細胞、巨噬細胞、淋巴細胞等前炎性細胞等至病灶部位,分泌包括TNF-α在內的多種炎性因子,破壞腸道組織,導致腸炎發生。上述結果在一定程度上支持這一假設。
此外,我們的實驗結果表明,抗C3a抗體可能具有潛在臨床應用價值。目前,抗C3a的單克隆抗體正在加緊研制中。有意思的是,有文獻報道,抗C5a抗體可有效緩解體重下降的癥狀,減輕腸道的破壞,此結論與抗C3a抗體治療一致[8]。但由于補體C5a只在補體活化初期高表達,過表達的C5a可與細胞膜表面的C5a受體相結合,引起受體內化,從而導致體液中C5a含量降低,而C3a的內化效應并不明顯。因此,有理由推測,相比于C5a,中和C3a可能具有更好的應用前景。
4.抗C3a抗體治療下調TNF-α和MPO的表達:TNF-α是IBD的關鍵致病因子[5~7]。MPO表達水平反映了結腸病灶組織內中性粒細胞的浸潤程度。我們在建模后4天,分離小鼠結腸組織,提取蛋白上清,檢測TNF-α和MPO的含量。如圖4所示,TNBS腸炎誘導后,結腸內TNF-α和MPO的含量明顯升高。抗C3a抗體治療能有效降低這兩個因子的表達水平,這可能是抗C3a抗體治療的機制之一。
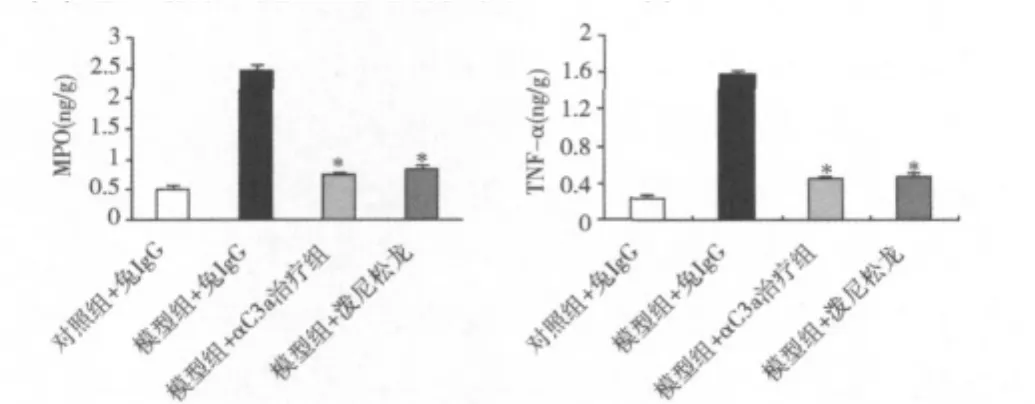
圖4 抗C3a抗體治療下調TNF-α和M PO的表達
討論
TNBS誘導的實驗性腸炎病理特征和發病過程與
1 Sartor RB.Current concepts of etiology and pathogenesis of ulcerative colitis and Crohn's disease[J].Gastroenterol Clin North Am,1995,24:475-507
2 TamboliCP,Doman DB,Patel A.Currentand future role ofbiomarkers in crohn's disease risk assessment and treatment[J].Clin Exp Gastroenterol,2011,4:127-140
3 te Velde AA,Verstege MI,Hommes DW.Critical appraisal of the current practice inmurine TNBS-induced colitis[J].Inflamm Bowel Dis,2006,12(10):995-999
4 Neurath MF,Fuss IJ,Kelsall BL,et al.Antibodies to interleukin 12 abrogate established experimental colitis in mice[J].J Exp Med,1995,182:1281-1290
5 Guo RF,Ward PA.Role of C5a in inflammatory responses[J].Annu Rev Immunol,2005,23:821-852
6 Rutella S,Fiorino G,Vetrano S,etal.Infliximab therapy inhibits inflammation-induced angiogenesis in the mucosa of patients with crohn's disease[J].Am JGastroenterol,2011,106(4):762-770
7 Triantafillidis JK,Merikas E,Georgopoulos F.Current and emerging drugs for the treatment of inflammatory bowel disease[J].Drug Des Devel Ther,2011,5:185-210
8 Mika D,Guruvayoorappan C.Myeloperoxidase:the yin and yang in tumor progression[J].JExp Ther Oncol,2011,9(2):93-100