不同培養方式和pH對草地早熟禾原生質體分裂和生長的影響
白生軍,馬暉玲,馬 祥,安惠惠
(甘肅農業大學 草業學院/草業生態系統教育部重點實驗室/甘肅省草業工程實驗室/中-美草地畜牧業可持續發展研究中心,甘肅 蘭州 730070)
草地早熟禾(Poa pratensis)是禾本科早熟禾屬一種優質冷季型草坪草。草地早熟禾抗寒性較差[1],植物生殖方式復雜多樣,常以兼性無融合生殖方式進行繁殖[2-6],有些品種無融合生殖率高達98%以上[3,6],有性雜交率低,很難獲得雜種優勢品種。以原生質體培養為基礎和前提條件的體細胞雜交技術不失為選育草地早熟禾雜種細胞可行而有效的育種途徑之一。Vander等[7]開創了草地早熟禾原生質體培養的先河,Kisten等[8]的研究進一步奠定草地早熟禾原生質體培養的基礎,但目前來看,早熟禾體細胞雜交技術還不成熟,研究相對不夠深入,僅獲得一些階段性成果[9,10]。
實驗以草地早熟禾午夜2號(MidnightⅡ)、新格萊德(Nuglade)和橄欖球2號(RugbyⅡ)3個品種的優質愈傷組織為材料,研究不同培養方式和pH對原生質體分裂和生長的影響,探索不同品種原生質體的最佳培養方式,以期為進一步完善草地早熟禾的原生質體培養奠定基礎。
1 材料和方法
1.1 實驗材料
將3個草地早熟禾午夜2號、新格萊德和橄欖球2號品種的成熟種子接種于添加各品種誘導愈傷組織適宜濃度激素的 MS培養基上(午夜2號:1mg/L 2,4-D+0.3mg/L 6-BA;新格萊德:3mg/L 2,4-D+0.5 mg/L 6-BA;橄欖球2號:3mg/L 2,4-D+0.1mg/L 6-BA;),誘導并優化培養得到生長狀態質地良好的愈傷組織。
1.2 實驗方法
挑選各品種繼代20次生長狀態良好的愈傷組織1g,置10mL酶液(13%甘露醇CPW+1%的纖維素酶+1%的離析酶+0.3%的崩潰酶+0.3%的果膠酶和5mol/L的 MES,pH 5.8),25±1℃,50r/min搖床暗中酶解16h。用200目和300目尼龍網過濾混合液,離心5min,依次用CPW-13溶液和原生質體培養液清洗2~3次后用培養液調整原生質體密度為2×105個/mL后進行培養[11]。
用液體淺層培養和固液雙層培養進行草地早熟禾原生質體培養。其中,液體淺層培養以KM8P為基本培養基,添加不同品種各自愈傷組織誘導時適宜濃度的激素(0.45μm微孔濾膜抽濾滅菌),將純化得到的原生質體懸浮于其中,滴加2mL懸浮液到直徑6cm的培養皿底部,形成一薄層,用保鮮膜封口,于26±1℃下,恒溫培養箱中靜置培養;固液雙層培養法:在培養皿底部先鋪8~10mL MS培養基(不添加激素,pH 5.8),再在上面滴加2mL含有原生質體的KM8P培養液進行淺層培養,用保鮮膜封口,于26±1℃下恒溫培養箱中靜置培養,每天輕輕晃動培養皿數次,使原生質體與氧氣充分接觸。KM8P培養液的pH值設置5.6、5.8、6.0共3個水平。
原生質體培養15d后在倒置顯微鏡下統計分裂頻率。比較不同品種的草地早熟禾原生質體的分裂生長及再生能力差異。
原生質體分裂頻率(%)=(分裂的原生質體數/接種原生質體數)×100
2 結果與分析
2.1 不同培養方式及培養基pH對3個品種原生質體分裂的影響
培養方式和培養基的pH對午夜2號原生質體的分裂生長均有影響。固液雙層培養比液體淺層培養更能得到較高的原生質體分裂率(圖1)。
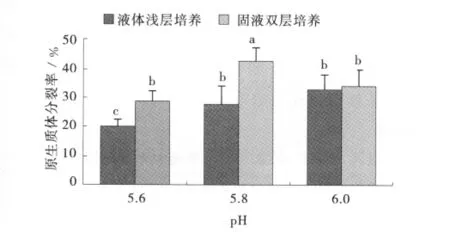
圖1 不同培養方式和培養基pH對午夜2號原生質體分裂生長的影響Fig.1 Effect of different cultivation methods and pH of medium on growth of MidnightⅡprotoplast
pH對原生質體的分裂率具有明顯影響。固液雙層培養中,pH5.8時原生質體分裂率最大(42.8%),顯著高于pH為5.6和6.0時的分裂率。研究表明,午夜2號原生質體培養過程中,最適宜的培養條件是固液雙層培養方式,pH為5.8。
新格萊德的培養基pH為5.6時,原生質體分裂率在2種培養方式中均最低,而pH為5.8和6.0時,2種培養方式中原生質體分裂率相近,均在45%,固液雙層培養,pH6.0時原生質體分裂率達到最大值,為50.1%(圖2)。
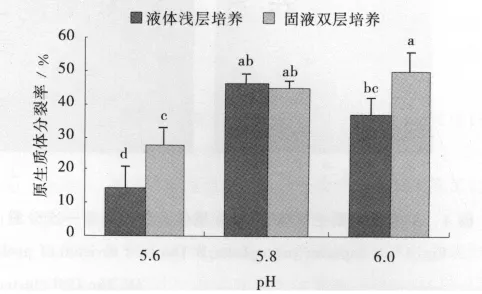
圖2 不同培養方式和培養基pH對新格萊德原生質體分裂生長的影響Fig.2 Effect of different cultivation methods and pH of medium on growth of Nuglade protoplast
培養方式和pH對橄欖球2號原生質體分裂的影響不甚明顯,原生質體分裂率均保持在22.5%~29.4%。同一pH值下,相對液體淺層培養,橄欖球2號原生質體培養采用固液雙層培養可得到較高的原生質體分裂率;下層固體培養基和上層液體培養基pH均為5.8時,原生質體分裂率達到最大值,為29.4%(圖3)。
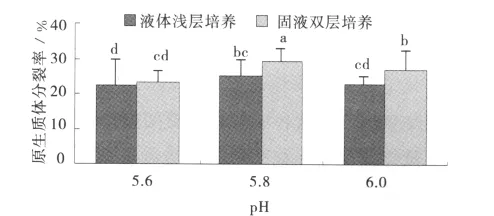
圖3 不同培養方式和培養基pH對橄欖球2號原生質體分裂生長的影響Fig.3 Effect of different cultivation methods and pH of medium on growth of RugbyⅡprotoplast
2.2 3個草地早熟禾品種原生質體形態及其變化
原生質體培養初期,3個草地早熟禾品種的原生質體狀態基本相似,在倒置顯微鏡下觀察均表現為形狀規則、邊緣清晰、大小均一和內含物較多的特性(圖4A)。培養2~3d后,可觀察到原生質體再生細胞的第1次、第2次分裂(圖4B,C)。隨后再生細胞持續分裂,在低倍鏡下即可觀察到再生細胞形成的小細胞團(圖4D)。比較3個品種原生質體分裂率發現,新格萊德原生質體的分裂率最高(圖2),午夜2號略低于新格萊德(圖1),而橄欖球2號原生質體的分裂率遠低于前兩者(圖3)。
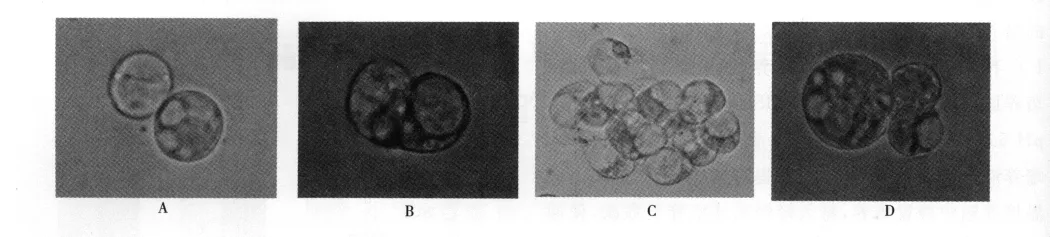
圖4 A優質的原生質體;B原生質體再生細胞第一次分裂;C原生質體再生細胞第二次分裂;D原生質體分裂產生的小細胞團Fig.4 A Superior protoplasts;B The first division of protoplast-derived cell;C The second division of protoplast-derived cell;D The Cell clusters formed from protoplasts
3 討論
3.1 不同培養方式對原生質體分裂和生長的影響
不同的培養方式為原生質體提供不同的生長環境,液體淺層培養適用于較易分裂的原生質體,操作比較簡單,對原生質體損傷較小,能有效防止有害物質過多積累,且易于添加新鮮培養基。但該方法也存在諸如原生質體分布不均勻、原生質體粘連、難以定點觀察原生質體等缺點。固液雙層培養是對液體淺層培養的改善。培養過程中,固體培養基中的營養成分可以被上層液體中的原生質體吸收利用,同時,原生質體產生的有害代謝物可被固體培養基吸收,尤其在固體培養基中添加吸附劑時這種吸附作用更明顯。黃文川等[12]研究了液體淺層培養和固液雙層培養對煙草原生質體分裂率的影響,發現固液雙層培養的原生質體分裂率顯著高于液體淺層培養時的分裂率,當加厚雙層培養基中的固相至液相厚度的4~5倍時,更有利于煙草愈傷組織的快速形成和植株再生。實驗以2種培養方式對3個草地早熟禾品種的原生質體進行培養,結果表明,固液雙層培養比液體淺層培養效果好,在固液雙層培養中原生質體具有較高的分裂頻率。
3.2 培養基pH對原生質體分裂和生長的影響
原生質體在液體培養過程中,被完全浸沒在培養液中,液體培養基的pH值通過影響滲透壓穩定劑活性而影響原生質體的分裂、生長,酶液的pH值條件主要影響溶壁酶系統和滲透壓穩定劑活性[14]。當培養基pH低于6.0時,新格萊德原生質體分裂率下降,午夜2號和橄欖球2號原生質體在培養基pH為5.8時也達到最大分裂頻率。這與馬向東等[13]的研究結果一致,但金凌云研究[15]認為,原生質體再生率與pH關系不大,今后有待進一步研究。
3.3 基因型的差異與原生質體生長和分裂的影響
實驗研究中,選取20次繼代后第8d生長狀態相近的愈傷組織進行原生質體游離和培養,培養條件和培養密度相同,但3個品種原生質體分裂率呈現出較大差異。培養初期未見品種間差異,持續培養發現橄欖球Ⅱ號再生細胞在培養過程中停止分裂生長,而新格萊德和午夜Ⅱ號再生細胞能持續分裂,長勢良好。可見不同品種之間原生質體培養效果差異很大,趙小強[11]對于草地早熟禾原生質體培養的研究結果也證實了這一結論,可能是由于原生質體供體材料的生理狀態的差異造成的[16]。故合適的基因型是進行草地早熟禾原生質體培養成功的重要條件[5]。
[1] 李顯利,米福貴,閆立軍,等.草地早熟禾不同品種抗旱性的評價分析[J].草原與草坪,2010,30(3):43-46.
[2] Akerberg E.Apomictic and sexual seed formation in poa pratensis L[J].Hereditas,1979,25:359-371.
[3] Bashaw E C.Apomixis and its application in crop improvement[M]//W R Fehr,H H Hadley,Hybridization of crop plants.New York:Amer.Madison Press,1980:455-633.
[4] Grazi F M.Observation on the mode of reproduction and embryology of poa pratensis L[J].Hereditas,1961,47:489-541.
[5] Hanna W W,E C Bashaw.Apomixis:its identification and use in planting breeding[J].Crop Science,1987,27(6):1136-1139.
[6] 殷朝珍,王兆龍,葛才林.草地早熟禾無融合生殖及其育種利用研究進展[J].草原與草坪,2006(1):18-23.
[7] Vander V,Zaal P,Creemers-Molenaar J.Regeneration of albino plantlets from suspension culture derived proto-plasts of Kentucky bluegrass(Poa protensis L)[J].Euphytica,1988(5):169-176.
[8] Kirsten Annette Nielsen,Else Larsen,Elisabeth Knudsen.Regeneration of protoplast-derived green plants of Kentucky Bluegrass(Poa pratensis L)[J].Plant Cell Report,1993(12):537-540.
[9] 馬暉玲,趙小強,白小明.草地早熟禾午夜Ⅱ號原生質體培養及植株再生[J].草地學報,2010,18(1):103-107.
[10] 趙小強,馬暉玲,林棟,等.草地早熟禾新格萊德胚性愈傷組織原生質體培養及植株再生的研究[J].草業學報,2010,19(2):55-66.
[11] 趙小強.草地早熟禾原生質體培養及體細胞的雜交[D].甘肅:甘肅農業大學,2009.
[12] 黃文川,楊其光.一種簡化有效的普通煙草原生質體培養方法[J].西北農業大學學報,2000,28(6):101-103.
[13] 朱至清.植物細胞工程[M].北京:化學工業出版社,2003:25.
[14] 馬向東.猴頭菌原生質體制備條件的研究[J].河南科學,1995,13(1):65-69.
[15] 金凌云.蛹蟲草原生質體誘變及主要活性物質提取工藝研究[D].陜西:西北農林科技大學,2010.
[16] 馬暉玲,張崇浩,肖尊安,等.影響植物原生質體分裂的生理生化因素[J].甘肅農業大學學報,1998,33(1):42-46.

