不同消化液介質對難溶中藥溶出量的影響:以牛黃為例
劉斐斐 張萍 王伽伯 馬致潔 臧清策 肖小河
溶出是難溶性藥物發揮藥效的關鍵環節,是化學藥固體制劑的重要研究內容,而中藥及其制劑的研究對溶出問題重視不足[1]。在中藥臨床調劑中,難溶性藥材仍主要是按照傳統方式提取處理的,其中藥效成分是否有效溶出,給臨床療效帶來多大影響?藥效成分的溶出比例是多少,是否有藥材浪費問題?這些均缺少科學試驗數據的支持。
牛黃(Calculusbovis)為脊椎動物哺乳綱偶蹄目牛科動物黃牛(BostaurusdomesticusGmelin)或水牛(BubalububalisL.)的干燥膽結石[2]。牛黃在中國應用歷史悠久,是臨床常用的名貴中藥,也是多種著名中成藥的重要原料,如牛黃解毒片、安宮牛黃丸、清開靈注射液[3,4]等都以牛黃為主藥。牛黃為難溶性結石藥物,其所含主要成分如多種游離膽汁酸、膽紅素(鈣鹽)、膽固醇[5-7]等均為難溶性物質。牛黃傳統用藥方式主要為口服,因此牛黃藥效成分是否能在消化道溶出,將直接影響其臨床療效的發揮;同時藥效成分溶出率的大小也直接影響該名貴藥物的有效利用。目前,人工牛黃為天然牛黃的常用代用品,其所含成分與天然牛黃基本一致,但有不少文獻報道人工牛黃的藥效弱于天然牛黃[8]。人工牛黃與天然牛黃是否存在溶出差異,并是否影響療效,尚未見報道。為此,本文以天然牛黃、人工牛黃為研究對象,考察其所含膽汁酸類重要成分在人工胃液、小腸液和大腸液中的溶出差異,從體外溶出的角度探討影響難溶中藥療效的可能因素。
1 材料與方法
1.1 試藥與儀器
天然牛黃購于北京同仁堂中醫醫院(生產廠家為北京亞微飲片廠,批號0812450);人工牛黃購于武漢某藥業有限公司(批號110206)。對照品膽酸(cholic acid,CA)、去氧膽酸(deoxycholic acid,DCA)、鵝去氧膽酸(chenodeoxycholic acid,CDCA)、熊去氧膽酸(ursodeoxycholic acid,UDCA)、牛磺膽酸(taurocholic acid,TCA)、甘氨膽酸(glycocholic acid,GCA)、甘氨去氧膽酸(glycodeoxycholic acid hydrate,GDCA)、牛磺去氧膽酸(taurodeoxycholic acid hydrate,TDCA)購自中國藥品生物制品檢定所(批號分別為110795-200505、110796-200716、110757-200206、110759-200804、110758-200610、110799-200806、110725-200608、877-200001),甲醇(分析純及色譜純,由北京泰博昌生物技術有限公司提供)。其余試劑均為分析純。
XC-00 dt超聲儀(南京新辰生物科技有限公司),Waters Acquity UPLC TM超高效液相色譜儀(Waters, Milford, MA, USA),ZKYY-5L智能型恒溫水浴鍋(鞏義華儀器有限責任公司)。
1.2 人工消化液的配制
人工胃液(pH 1.2)的配制:取1 mol/L的稀鹽酸16.4 ml,加水800 ml與胃蛋白酶10 g,搖勻后,加水稀釋成1000 ml。人工小腸液(pH 6.8)的配制:取磷酸二氫鉀6.8 g,加水500 ml使溶解,用0.1 mol/L NaOH溶液調節pH值至6.8,另取胰酶10 g。加水使適量溶解,將兩液混合后,加水稀釋至1000 ml。人工大腸液(pH 7.6)的配制:取磷酸二氫鉀27.22 g,加水使溶解至1000 ml,取500 ml,加0.2 mol/L NaOH溶液42.4 ml,再加水稀釋至200 ml。
1.3 對照品溶液制備
分別精密稱取膽酸等8種膽汁酸對照品適量,加甲醇分別制成每1 ml含膽酸、去氧膽酸、鵝去氧膽酸、熊去氧膽酸、牛黃膽酸、甘氨膽酸、甘氨去氧膽酸、牛磺去氧膽酸各900 μg的儲備液,該儲備液在4℃避光冷藏可穩定保存2個月以上。用0.22 μm的微孔濾膜過濾,備用。
1.4 供試樣品制備
取天然牛黃、人工牛黃各約0.1 g,精密稱定,分別以甲醇、人工胃液(pH 1.2)、人工小腸液(pH 6.8)和人工大腸液(pH 7.6)為溶出介質,溫度37℃,超聲提取3次,每次30分鐘,合并上清,晾干,并定容至20 ml,沉淀蛋白。樣品置于-20℃冷凍可穩定保存2個月以上,UPLC進樣前用0.22 μm的微孔濾膜過濾,測定膽汁酸類成分溶出后的含量。
1.5 膽汁酸UPLC測定
色譜柱:Waters Acquity CSH C18色譜柱(50 mm×2.1mm,1.7 μm),柱溫35℃。流動相組成:流動相A:乙腈;流動相B:0.2%甲酸-水。線性梯度洗脫程序:0~2.0分鐘,10%~12%;2.0~3.0分鐘,12%~25%A;3.0~3.01分鐘,25%~35%A;3.01~10分鐘,35%~37%A;10~17分鐘,37%~43%A;17~17.01分鐘,43%~48%A;17.01~20分鐘, 48%~52%A。流速0.40 ml/min,檢測波長254 nm;進樣量5μl;理論塔板數按膽酸計算,應不低于3000。檢測GCA、TCA、CA、GDCA、TCDCA、CDCA和DCA共7個成分在不同人工消化液中的含量,計算溶出比例(人工消化液中的溶出成分峰面積占甲醇中溶出成分峰面積的的百分率)。
2 結果
天然牛黃和人工牛黃在不同溶劑中的溶出結果見圖1和表1。
天然牛黃中各膽汁酸成分在甲醇、人工胃液、人工小腸液和人工大腸液中的溶出比例較同溶劑中人工牛黃高。如在人工大腸液中,天然牛黃CDCA的溶出比例是人工牛黃的9.13倍。
不同溶劑間,以甲醇為參比,天然牛黃和人工牛黃在人工小腸液、大腸液中各膽汁酸成分的溶出均高于人工胃液中的溶出。如天然牛黃中CDCA的溶出人工大腸液是人工胃液的1.83倍;人工牛黃中DCA在人工大腸液中的溶出是人工胃液的1.36倍。
各膽汁酸成分的溶出間,天然牛黃中GCA、GDCA的溶出比例較大,均高于80%,而TCA、CA和DCA等成分溶出比例小,最低為16.6%;人工牛黃中GDCA的溶出比例最高,在人工大腸液中為73%;CDCA溶出最小,在各溶劑中的溶出比例均為8%。
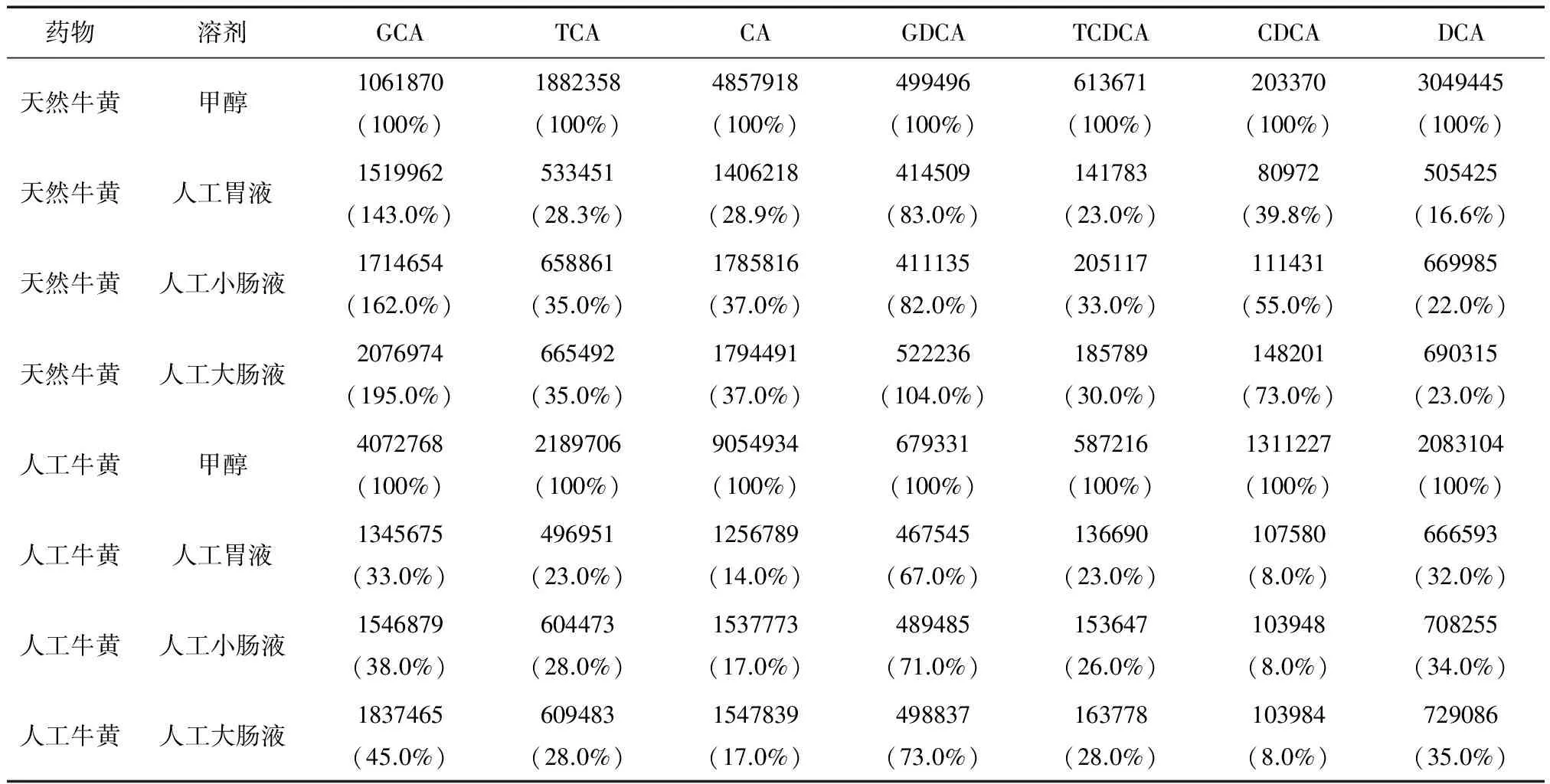
表1 天然牛黃、人工牛黃膽汁酸成分在不同溶劑中的溶出量比較[溶出成分峰面積(mV·min),溶出比例(%)]
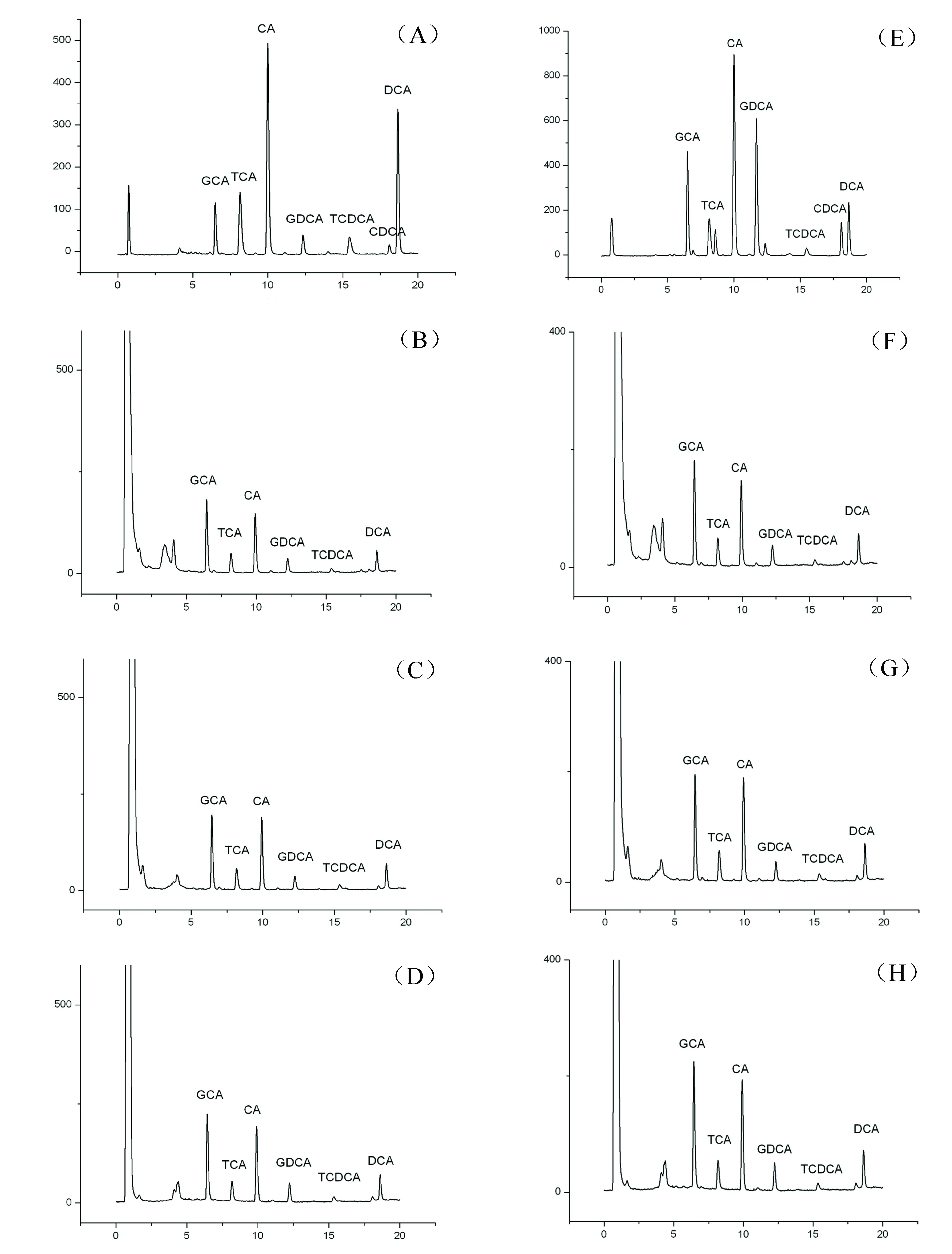
(A)天然牛黃+甲醇;(B)天然牛黃+人工胃液;(C)天然牛黃+人工小腸液;(D)天然牛黃+人工大腸液;(E)人工牛黃+甲醇;(F)人工牛黃+人工胃液;(G)人工牛黃+人工小腸液;(H)人工牛黃+人工大腸液圖1 天然牛黃、人工牛黃在不同溶劑中溶出成分色譜圖
3 討論
膽汁酸類成分是牛黃的重要藥效物質[9-11],并且游離膽汁酸類成分均為難溶性物質,因此本文選擇膽汁酸類成分作為評價指標,考察天然牛黃和人工牛黃在人工胃液、小腸液及大腸液中溶出能力。需要說明的是,本實驗不是嚴格意義的溶出試驗,常規溶出試驗需要大量的天然牛黃,成本過高。因此為了方便比較,本文采用平行對比的方式,以膽汁酸的良溶劑甲醇為參比,比較天然牛黃和人工牛黃在3種模擬人體胃腸消化液中的溶出成分差異。
在含量測定方法方面,現有文獻報道中多用HPLC[12-15]作為牛黃膽汁酸類成分的檢測手段;本文采用的UPLC法,能夠更加快速、高效的進行成分的分離和指認,實驗結果表明天然牛黃和人工牛黃各膽汁酸類成分均能較好的分離。
本文研究發現,所檢測的8種膽汁酸成分除UDCA外在不同pH的人工消化液中均可檢測到,其中結合型膽汁酸因具有甘氨酸或牛磺酸親水性基團,故比游離型膽汁酸的溶出率高,提示牛黃溶出成分主要以結合型膽汁酸為主。文獻報道,結合型膽汁酸如GCA在鎮靜、解痙、鎮咳、祛痰、抗炎等多方面的藥效作用強于游離型膽汁酸如CA、DCA等[16-18]。因此,盡管從藥材含量上看游離型膽汁酸是牛黃的主要膽汁酸類成分,但由于結合型膽汁酸溶出較好、藥效較強,結合型膽汁酸可能是牛黃的主要藥效物質。現行藥典質量控制指標為膽酸,而未考慮結合型膽汁酸,有待補充完善。
按現行藥典規定,人工牛黃配方中應加入熊去氧膽酸。本文實際檢測發現,所購人工牛黃樣品的甲醇提取液中卻未檢測出熊去氧膽酸。由于藥典標準中并不要求控制熊去氧膽酸,故該樣品按藥典標準仍屬合格品,但實際上該批次產品可能未按藥典要求生產。熊去氧膽酸具有較強的利膽作用,市售產品如熊去氧膽酸膠囊是臨床治療原發性膽汁性肝硬化(primary biliary cirrhosis,PBC)的一線藥物。但由于現行藥典標準未控制UDCA,不利于人工牛黃的質量控制,建議補充修改藥典標準。
比較3種人工消化液,各膽汁酸成分在人工胃液溶出最差,在人工大腸液(pH 7.6)中溶出相對較好。如CDCA在人工大腸液中溶出量達73.0%,而在人工胃液僅39.8%,相差1.83倍。這與膽汁酸類成分均含有酸性基團,在偏堿性條件的溶解度較好有關。結果提示,牛黃膽汁酸類成分在腸道尤其是大腸部位溶出較好,通過制劑學手段延長牛黃在腸道停留時間,將有助提高牛黃中膽汁酸類成分的生物利用度及臨床療效。另外,GCA在人工消化液中的溶出量高于甲醇,可能與GCA親水性較強有關。
根據本文結果,天然牛黃中除GCA、GDCA和CDCA外,其它膽汁酸成分的溶出比例均較低。通過制劑學手段提高名貴中藥牛黃的溶出量,進而提高藥材利用率,對提高牛黃制劑的療效、節約藥材等具有重要意義。進一步與人工牛黃對比發現,天然牛黃中各膽汁酸成分(除DCA外)的溶出率均高于人工牛黃,其中尤以CDCA相差最顯著,在人工大腸液中溶出比例相差達9.13倍。提示溶出能力偏差可能是人工牛黃臨床療效低于天然牛黃的原因之一。據報道,國產UDCA片劑的溶出能力顯著低于進口產品,其原因可能與晶型有關[19]。人工牛黃溶出能力偏低的原因尚有待深入研究。
目前難溶性中藥的溶出研究尚沒有得到足夠重視,由此可能給臨床療效發揮帶來巨大影響[20]。本文以牛黃為例,初步探討了難溶中藥在不同介質中溶出的問題和可能的影響因素,為重視和解決難溶性中藥的溶出問題提供了數據支持,對于保障難溶性中藥及其制劑的臨床療效具有一定的參考意義。
參考文獻
[1] 袁海龍,黃雪,肖小河.中藥固體制劑溶出度研究與展望[J].世界科學技術-中醫藥現代化,2010,12(6):915-919.
[2] 國家藥典委員會.中華人民共和國藥典(一部)[S].北京:化學工業出版社,2005:41.
[3] 江英橋.HPLC-ELSD法測定清開靈注射液中膽酸和豬去氧膽酸的含量[J].中國藥品標準,2006,7(4):31-33.
[4] 徐雅,李澎濤,陳杰,等.安宮清開靈對自發性高血壓大鼠腦出血模型前炎癥細胞因子與黏附分子含量的影響[J].世界科學技術-中醫藥現代化,2007,9(2):45-49,72.
[5] 曹流,孫冶,曹瀾,等.人工牛黃中膽紅素含量測定的影響因素[J].中國衛生工程學,2005,4(2):91-92.
[6] 鄧峰.氣相色譜法對血清總膽固醇的測定[J].中華醫學檢驗雜志,1988,11(3):133.
[7] 洪筱坤,陳怡,范廣平,等.6個熊膽樣品中結合型膽汁酸的種類和含量研究[J].中成藥,1999,21(8):426.
[8] 趙艷紅,阮金秀.牛黃及其代用品的藥理作用及臨床應用[J].軍事醫學科學院院刊,2007,31(2):175-178.
[9] 侯世祥,廖工鐵,吳德全,等.人工牛黃的質量分析[J].華西藥學雜志,1990,5(3):149-151.
[10] 張明霞,歐陽貴平.膽汁酸衍生物的合成及應用[J].合成化學,2009,17(2):140-145.
[11] 徐偉,袁惠楠,路岐祥,等.人工牛黃與幾種新配方的藥理學比較研究[J].中藥藥理與臨床,1994,27(6):34.
[12] 李文春,孫永慧.HPLC-ELSD法測定青羚散中膽酸的含量[J].中國實驗方劑學雜志,2005,11(5):18-20.
[13] 司徒少金,羅建明,馬玲云,等.HPLC-ELSD測定消痔靈片中膽酸的含量[J].中藥材,2005,28(4):344-345.
[14] 倪坤儀,王健,陳健,等.反相高效液相色譜法測定牛黃類中成藥中膽汁酸的含量[J].藥學學報,1994,29(8):629-632.
[15] 陳劍,劉頻健,王曉一,等.HPLC法測定復方制劑中人工牛黃的膽紅素含量[J].安徽農業科學,2009,37(21):9839-9840.
[16] 彭順金,鄒其超,張金枝,等.反相高效液相色譜法分析人體膽汁中結合型膽汁酸[J].分析試驗室,2000,19(3):12.
[17] 王猛,張曉清,丁敏,等.反相高效液相色譜法測定鼠膽汁中游離與結合型膽汁酸[J].分析測試技術與儀器,2007,13(1):1-4.
[18] 王文娟,鄧文平,王猛,等.高效液相色譜法同時測定膽汁中9種結合型膽汁酸[J].重慶醫科大學學報,2009,34(1):59-62.
[19] 張濤,趙先英.藥物研究和生產過程中的多晶型現象[J].中國新藥與臨床雜志,2003,22(10):615-620.
[20] 黃獻,潘洪平,莫志江,等.不同廠家牛黃解毒片的體外溶出度考察[J].中成藥,2005,27(1):107-109.

