Bmi-1在非小細胞肺癌組織中的表達和意義
劉春靈 宋文剛 李惠翔
肺癌是嚴重危害人類健康的常見惡性腫瘤之一,有關肺癌的發病機制目前尚未徹底闡明,但已經逐步認識到肺癌的發生是涉及多基因、多步驟的互相協同、互相作用的癌變過程。癌基因的異常激活和過度表達在肺癌發生發展中的作用越來越受到人們的重視。
Bmi-1(B-cell specific moloney leukemia virus inserti on site 1, Bmi-1)是PCG (polycomb of genes)成員,其最初發現是作為一種原癌基因,與另一種癌基因c-myc協同作用引起細胞轉化和腫瘤形成,導致轉基因鼠B細胞淋巴瘤的發病[1]。研究發現,Bmi-1在多種惡性腫瘤組織中呈現過表達[2-4],被認為是一種癌基因。目前國內鮮見Bmi-1與非小細胞肺癌(non-smallcell lung cancer,NSCLC)相關性的報道。本文對42例非小細胞肺癌及其癌旁正常肺組織標本中Bmi-1的表達情況進行了初步的研究和分析,以探討Bmi-1在NSCLC進展中的作用及其潛在的臨床應用價值。
1 材料與方法
1.1 臨床資料
收集漯河市中心醫院2007~2010年手術切除的非小細胞肺癌石蠟標本42例。其中男性29例,女性13例,平均年齡59.4歲;病理診斷為鱗癌26例,腺癌16例;中、高分化29例,低分化13例;TNM分期Ⅰ~Ⅱ期27例,Ⅲ~Ⅳ期15例。術前未放療或化療。所有標本均經10%中性甲醛溶液固定,石蠟包埋。
1.2 試劑與方法
每個蠟塊4μm厚連續切片進行免疫組化染色。鼠抗Bmi-1單克隆抗體,SP免疫組化試劑盒購自北京中杉公司。PBS代替一抗做陰性對照。
1.3 免疫組化染色
(1)石蠟包埋組織切片,脫蠟水化,磷酸鹽緩沖液(PBS)沖洗5min×3次;(2)將切片置于新鮮配制的3%H2O2中浸泡30min,PBS洗5min×3次;(3)抗原修復。高壓鍋加熱,加熱至噴氣時開始計時,2min后端離熱源,冷卻至室溫,PBS洗5min×3次;(4)吸去片上的PBS,滴加10%正常血清,室溫下置濕盒內30min;(5)棄去多余的血清,滴加用PBS液稀釋的一抗(1∶500),置濕盒4℃冰箱中過夜;以PBS液代替一抗作陰性對照;(6)第2天取出置室溫1h后,PBS漂洗5min×3次;(7)滴加第二抗體,室溫孵育20min,PBS漂洗5min×3次;(8)滴加辣根過氧化物酶標記鏈霉卵白素工作液,室溫孵育20min,PBS漂洗5min×3次;(9)二氨基聯苯胺(DAB)顯色1~2min,顯微鏡下控制顯色時間,自來水終止顯色反應,蘇木精復染,脫水,中性樹膠封片。
1.4 結果判斷
Bmi-1蛋白表達結果判定參照馮艷等[5]計分方法。光學顯微鏡下觀察組織標本的著色程度,高倍鏡下(400×)隨機取4個不同的視野,計數細胞總數及核陽性細胞數,根據染色的強弱程度計分:陰性染色1分,弱染色2分,中等強度染色3分,強染色4分,按陽性細胞所占的百分比計分:≤10%為1分,>10%且≤50%為2分,>50%且≤75%為3分,>75%為4分;同時,根據二者的乘積判斷結果:≤4分為陰性表達,>4為陽性表達。免疫組化結果判定由兩位病理醫師采用盲法進行觀察及評估。
1.5 統計學分析
所有數據均采用SPSS15.0統計學軟件進行統計學處理,陽性率之間的比較采用x2檢驗,α=0.05為檢驗水準。
2 結果
2.1 Bmi-1在非小細胞肺癌及其相應癌旁正常肺組織中的表達
Bmi-1蛋白陽性表達呈棕黃色顆粒,主要分布在癌細胞胞核中,僅少量表達見于胞漿。見圖1、圖2。肺癌組織中Bmi-1陽性表達率為73.8%(31/42)。在癌旁肺組織中Bmi-1表達率為11.9%(5/42),肺癌與相應癌旁正常肺組織中Bmi-1蛋白的表達,差異有統計學意義(P<0.05)。見表1。

表1 肺癌及癌旁正常肺組織中Bmi-1蛋白的表達

圖1 Bmi-1在鱗癌中的陽性表達(SP×400)

圖2 Bmi-1在腺癌中的陽性表達(SP×400)
2.2 Bmi-1蛋白與肺癌臨床病理因素的關系
Bmi-1的表達水平與肺癌的組織學類型無關;低分化肺癌Bmi-1的陽性表達率高于中高分化肺癌,但差異無統計學意義(P>0.05);而與TNM分期有關,即Ⅲ~Ⅳ期的癌組織組中Bmi-1的陽性表達率高于Ⅰ~Ⅱ期組,差異有統計學意義(P<0.05)。見表2。
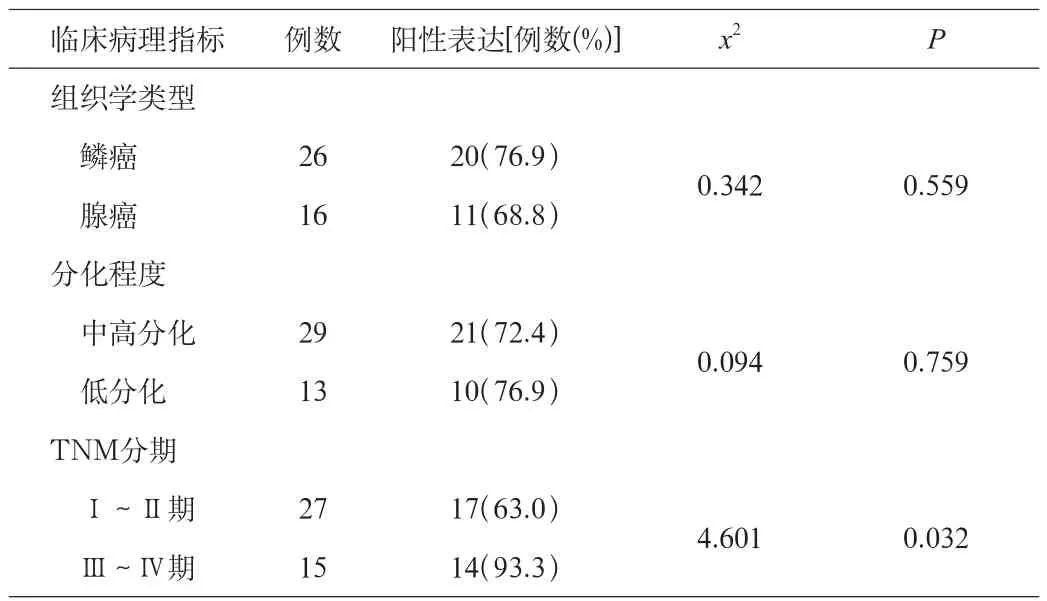
表2 Bmi-1蛋白與肺癌臨床病理因素的關系
3 討論
機體在正常發育和分化過程中,腫瘤抑制基因和原癌基因作用的平衡性具有重要的意義,腫瘤抑制基因激活后通過促進細胞死亡或干細胞老化而抑制再生,原癌基因則具有轉化細胞及維持干細胞自我更新的能力,進而促進增生,任何一方面出現基因表達調控失常都有可能導致腫瘤的發生,Bmi-1基因屬于多梳基因家族(polycomb of genes,PCG)成員之一,是一種廣泛表達的核蛋白,調節HOX基因的轉錄,參與細胞的增殖調控[6]。人Bmi-1基因定位于10P13,含10個外顯子編碼一個含326個氨基酸的蛋白質,該蛋白質含有一個位于N末端的環指結構域(ring finger domain,RF)和位于中心的保守DNA結合模序螺旋-轉角-螺旋-轉角(H-T-H-T),起轉錄抑制作用,正是這個結構域對細胞的增殖和腫瘤形成有著重要作用[7]。
本研究結果發現,非小細胞肺癌組織中Bmi-1的表達比癌旁正常肺組織中明顯升高,且與患者臨床分期密切相關,而Bmi-1的表達與組織學類型無關,低分化癌組織中Bmi-1的表達稍高于分化較好的癌組織,但差異無統計學意義。黃開紅等[8]研究認為在胃癌組織中Bmi-1基因的表達狀態與胃癌的生長和浸潤轉移關系密切,Bmi-1基因陽性表達者生存率明顯低于陰性者,Bmi-1基因表達的測定有助于腫瘤預后的判斷。本研究的結果也顯示Bmi-1基因可能在非小細胞肺癌的發生發展中起著重要作用,并有望成為一個新的預測腫瘤預后的標志物。
[1]Haupt Y,AlexanderWS,Barri G,et al.Novel zinc finger gene implicated as myc collaborator by retrovirally accelerated lym-phomagenesis in E mu- myc transgenic mice[J].Cell,1991,65(5):753-763.
[2]Van- Leender s GJ,Dukers D,Hesse l s D,et al.Poly-comb-group oncogenes EZH2,BM I1,and RI NG1 are overexpressed in prostate cancer with adverse pathologic and clinical feature[J].EurUroL,2007,52(2):455-463 .
[3]Wang H,Pan K,ZhangHK,et al.Increased poly comb- group oncogene Bmi-1 expression correlates with poor prognos is in hepatocellular carcinoma[J].CancerRes Oncol,2008,134(5):535-541.
[4]Arnes JB,Collett K,Akslen LA. Independent prognostic value of the basal-like phenotype of breast cancer and as sociations with EGFR and candidate stem cellmarker BMI-1[J].Histopathology,2008,52(3):370-380.
[5]馮艷,宋立兵,郭寶紅,等.Bmi-1在乳腺癌組織中的表達及意義[J].癌癥,2007,26(2):154-157.
[6]AriasAM.Ep ithelial mesenchymal interactions in cancer and development[J].Cell,2001,105(4):425-431.
[7]A lexander GM,James EC,Norris SW,et al.Genomescans provide evidence forkeloid susceptibility locion chromosomes 2q23 and 7p11 [J].J Invest Demato l,2004,122(5):1126-1133.
[8] 黃開紅,劉建華,李學先,等.Bmi-1在胃癌組織中的表達及相關性研究[J].中國腫瘤臨床,2006,34(17):961-965.

