胰腺癌中血管內(nèi)皮生長(zhǎng)因子C、D表達(dá)與血管淋巴管新生的關(guān)系
李智峰 李高強(qiáng) 田云霄 袁艷龍 司華鵬 陶 麗
1.河北省邯鄲市第一醫(yī)院,河北邯鄲 056802;河北省邯鄲市中心醫(yī)院,河北邯鄲 056802
胰腺癌是常見的消化系統(tǒng)惡性腫瘤之一,其5年生存率僅為3%左右[1],預(yù)后較差。腫瘤細(xì)胞的淋巴管轉(zhuǎn)移是人類腫瘤的一個(gè)早期特征[2],胰腺腺癌也不例外。事實(shí)上,胰腺內(nèi)分泌腫瘤更容易發(fā)生淋巴結(jié)轉(zhuǎn)移。本文探討胰腺癌中血管內(nèi)皮生長(zhǎng)因子C(VEGF-C)及血管內(nèi)皮生長(zhǎng)因子D(VEGF-D)的表達(dá)與血管淋巴管新生的關(guān)系。
1 資料與方法
1.1 一般資料
63例胰腺癌標(biāo)本來自2005年1月~2009年12月邯鄲市第一醫(yī)院及邯鄲市中心醫(yī)院肝膽外科行胰頭十二指腸切除的胰腺癌病例并均經(jīng)病理證實(shí),其中,男43例,女20例,年齡37~79歲,平均59.7歲;有淋巴結(jié)轉(zhuǎn)移者25例,占39.7%。按照國(guó)際抗癌聯(lián)盟(UICC)胰腺癌TNM(T指原發(fā)腫瘤情況,N指淋巴轉(zhuǎn)移情況,M指遠(yuǎn)處轉(zhuǎn)移情況)分期(2002年)診斷標(biāo)準(zhǔn)[3]:Ⅰ~Ⅱ期33例,Ⅲ~Ⅳ期30例,所有患者術(shù)前均未行任何抗癌治療。癌周組織為距腫瘤邊緣0.3~0.5 cm無癌細(xì)胞浸潤(rùn)處。正常胰腺標(biāo)本共13例,來自邯鄲市第一醫(yī)院病理科非胰腺疾病死亡者尸檢存檔蠟塊,病理學(xué)檢查證實(shí)全部為正常胰腺組織。
1.2 方法
兔抗人VEGF-C、VEGF-D及CD31單克隆抗體購(gòu)自北京中杉生物技術(shù)有限公司,Envision二抗等購(gòu)自上海長(zhǎng)島公司。切片常規(guī)脫蠟,微波抗原修復(fù),Envision法免疫組化染色,常規(guī)復(fù)染封片。用已知的乳腺癌陽(yáng)性切片作陽(yáng)性對(duì)照,以磷酸鹽緩沖溶液(PBS)代替VEGF-C、VEGF-D單克隆抗體作陰性對(duì)照。結(jié)果判定:VEGF-C、VEGF-D以癌細(xì)胞胞漿呈現(xiàn)棕黃色顆粒為陽(yáng)性細(xì)胞,每例切片至少計(jì)數(shù)10個(gè)400倍視野,評(píng)分標(biāo)準(zhǔn)按Shimizu方法[4]:≥3分為陽(yáng)性。毛細(xì)血管淋巴管的記數(shù)參照Weidner等[5]報(bào)道的方法:先在低倍視野下觀察切片,選取癌周毛細(xì)血管淋巴管數(shù)量最豐富的區(qū)域,在200倍視野下記數(shù)5個(gè)視野毛細(xì)血管淋巴管數(shù),取其平均值。所有鏡檢及計(jì)數(shù)均由兩名不了解患者臨床病理特征的病理醫(yī)師完成。
1.3 統(tǒng)計(jì)學(xué)方法
采用SPSS 16.0統(tǒng)計(jì)軟件進(jìn)行分析,計(jì)量資料數(shù)據(jù)以均數(shù)±標(biāo)準(zhǔn)差(x±s)表示,比較采用t檢驗(yàn),計(jì)數(shù)資料采用百分率表示,組間對(duì)比采用χ2檢驗(yàn)。以P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 胰腺癌組織中VEGF-C和VEGF-D蛋白的表達(dá)
VEGF-C和VEGF-D陽(yáng)性物質(zhì)呈棕黃色細(xì)顆粒狀,主要位于癌細(xì)胞胞漿。VEGF-C和VEGF-D表達(dá)具有異質(zhì)性,以腫瘤邊緣的癌組織表達(dá)相對(duì)較強(qiáng)。63例標(biāo)本中VEGF-C陽(yáng)性率為 60.3%(38/63),與正常胰腺組織 23.1%(3/13)比較差異有統(tǒng)計(jì)學(xué)意義(P < 0.05);VEGF-D 陽(yáng)性率為 63.5%(40/63),與正常胰腺組織23.1%(3/13)比較差異有統(tǒng)計(jì)學(xué)意義 (P<0.05)。VEGF-C與VEGF-D在胰腺癌中的表達(dá)無相關(guān)性(χ2=2.361,P > 0.05)。 見表 1。
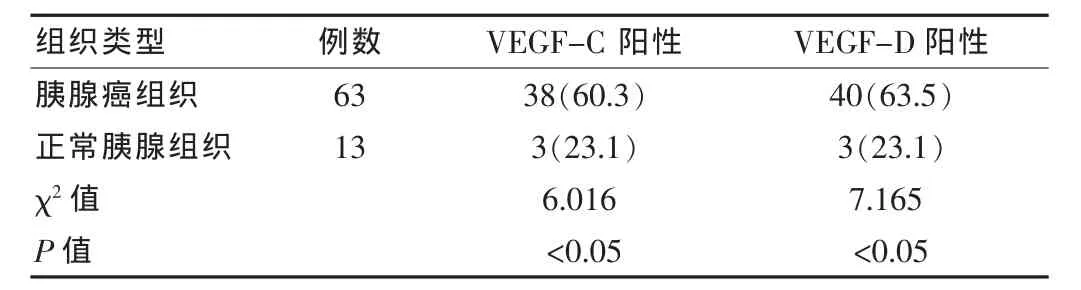
表1 胰腺癌組織中VEGF-C和VEGF-D蛋白的表達(dá)[n(%)]
2.2 胰腺癌組織中VEGF-C和VEGF-D與微血管淋巴管密度(MVD/MLVD)及淋巴結(jié)轉(zhuǎn)移的關(guān)系
在胰腺癌周組織及正常胰腺組織中MVD/MLVD的均值分別為(14.83±4.32)、(8.08±3.07),差異有統(tǒng)計(jì)學(xué)意義(P <0.05)。 VEGF-C 陽(yáng)性組中的癌周 MVD/MLVD(16.84±3.25)顯著高于陰性組的(11.76±3.97),差異有統(tǒng)計(jì)學(xué)意義(P < 0.05);VEGF-C陽(yáng)性組淋巴結(jié)轉(zhuǎn)移率[55.26%(21/38)]高于陰性組的 16%(4/25),差異有統(tǒng)計(jì)學(xué)意義(P <0.05)。 VEGF-D 陽(yáng)性組中的癌周MVD/MLVD (16.95±3.21)顯著高于陰性組的(11.13±3.45),差異有統(tǒng)計(jì)學(xué)意義(P < 0.05);VEGF-D 陽(yáng)性組淋巴結(jié)轉(zhuǎn)移率[57.5%(23/40)]高于陰性的 8.7%(2/23),二者差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。見表2。
3 討論
相關(guān)研究發(fā)現(xiàn)無論是良性還是惡性腫瘤,都存在瘤內(nèi)淋巴管;在良性腫瘤內(nèi)淋巴管密度與腫瘤大小相關(guān),惡性腫瘤的淋巴管密度與肝轉(zhuǎn)移發(fā)生率相關(guān)[6],但與淋巴管轉(zhuǎn)移發(fā)生率無關(guān)[7];近年來隨著淋巴管標(biāo)記物以及淋巴管生成因子的發(fā)現(xiàn),對(duì)淋巴管生成性腫瘤轉(zhuǎn)移的關(guān)注很多。腫瘤細(xì)胞VEGF-C的高表達(dá)和乏氧無明確聯(lián)系[8]。腫瘤細(xì)胞VEGF-D的高表達(dá)cadherin似乎有聯(lián)系,而腫瘤細(xì)胞VEGF-C的高表達(dá)可能是同樣道理。這些發(fā)現(xiàn)證實(shí),腫瘤中存在淋巴管新生,VEGF-C的表達(dá)與淋巴管侵襲及轉(zhuǎn)移的發(fā)生相關(guān)[9-10]。
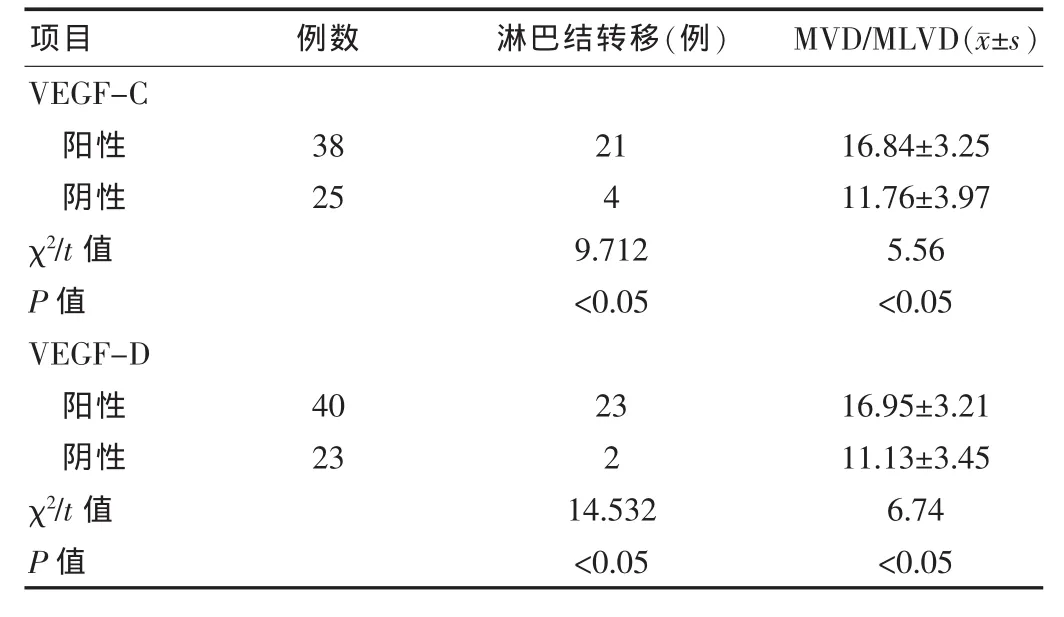
表2 胰腺癌組織中VEGF-C和VEGF-D與微血管淋巴管密度(MVD/MLVD)及淋巴結(jié)轉(zhuǎn)移的關(guān)系
VEGFR-3:血管內(nèi)皮生長(zhǎng)因子-C的受體之一,以往認(rèn)為它在正常成人組織和胚胎組織中特異的表達(dá)淋巴管,也是培養(yǎng)的淋巴管內(nèi)皮細(xì)胞中保持特異性表達(dá)的唯一標(biāo)志物。并且是一個(gè)淋巴管發(fā)生的調(diào)節(jié)因子。但最近有研究者認(rèn)為它并非具有特異性,除存在淋巴管上皮細(xì)胞外,在正常組織的有孔血管、視網(wǎng)膜、傷口、腫瘤血管中亦有表達(dá)。腫瘤細(xì)胞表達(dá)VEGF-C,其中 21%(4/19)良性腫瘤為陽(yáng)性,而 67%(6/9)的交界瘤與82%(9/11)的惡性瘤呈陽(yáng)性表達(dá)。Onogawa等[11-12]發(fā)現(xiàn)在人結(jié)腸癌VEGF-C、VEGF-D高表達(dá),且與結(jié)腸癌的淋巴管侵犯及淋巴結(jié)轉(zhuǎn)移密切相關(guān)。筆者研究表明,在63例胰腺癌組 織中,VEGF-C 陽(yáng)性率 60.3%(38/63),VEGF-D 為63.5%(40/63),且以腫瘤邊緣部分及腫瘤與正常組織交界處表達(dá)最高,與正常對(duì)照組比較差異有統(tǒng)計(jì)學(xué)意義(P<0.05);在胰腺癌周組織中MVD/MLVD的均值為(14.83±4.32),明顯高于正常胰腺中的 (8.08±3.0), 差異有統(tǒng)計(jì)學(xué)意義 (P<0.05);且VEGF-C及VEGF-D陽(yáng)性組淋巴結(jié)轉(zhuǎn)移率均高于陰性組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。提示胰腺癌中VEGFC和VEGF-D蛋白表達(dá)升高,具有促進(jìn)胰腺癌周血管淋巴生成、促進(jìn)淋巴道轉(zhuǎn)移的作用。此外,VEGF-C、VEGF-D蛋白表達(dá)與患者性別、年齡、腫瘤的大小及分化程度無關(guān),與腫瘤的TNM分期有關(guān),Ⅲ~Ⅳ期高于Ⅰ~Ⅱ期。
在腫瘤或VEGF-C誘導(dǎo)的新生淋巴管模型中,筆者發(fā)現(xiàn)在腫瘤周邊區(qū)域,淋巴管新生的程度與淋巴管密度有相關(guān)性。研究顯示[13-14]:在腫瘤淋巴管新生和腫瘤細(xì)胞經(jīng)淋巴管轉(zhuǎn)移的過程中,新形成的淋巴管是從即存的淋巴管網(wǎng)通過發(fā)芽方式產(chǎn)生的,而來源于骨髓的內(nèi)皮祖細(xì)胞在其中只起很小或不起作用。VEGF-C、VEGF-D蛋白陽(yáng)性組中胰腺癌周血管淋巴管密度明顯增加,且與VEGF-C、VEGF-D的高表達(dá)明顯正相關(guān)(P<0.05)。可能是促進(jìn)淋巴管,導(dǎo)致腫瘤細(xì)胞進(jìn)入淋巴管引起胰腺癌淋巴管侵襲和轉(zhuǎn)移有關(guān)[15]。筆者推測(cè)VEGFC、D促進(jìn)胰腺癌淋巴道轉(zhuǎn)移機(jī)制是:胰腺癌癌細(xì)胞分泌的VEGF-C、D作為促血管淋巴管增生的始動(dòng)因素,上調(diào)癌周組織內(nèi)血管淋巴管內(nèi)皮細(xì)胞膜上VEGFR的表達(dá),二者互作用,使癌周血管淋巴管數(shù)目增多,內(nèi)皮細(xì)胞增生,管壁結(jié)構(gòu)通透性增加,增大了瘤細(xì)胞與淋巴管內(nèi)皮接觸的面積,改變了淋巴管內(nèi)皮黏附特性或表面趨化因子的表達(dá)[16],再加上癌組織對(duì)淋巴管內(nèi)皮細(xì)胞的破壞溶解作用,為癌細(xì)胞進(jìn)入淋巴管提供了更加便利的通道[17]。
[1]Mohammed RA,Green A,El SS,et al.Prognostic significance of vascular endothelial cell growth factors-A,-C and-D in breast cancer and their relationship with angio-and lymphangiogenesis[J].Br J Cancer,2007,96:1092-1100.
[2]Jung HC,Young HO,Yong WP,et al.Correlation of Vascular Endothelial Growth Factor-D Expression and VEGFR-3-Positive Vessel Density with Lymph Node Metastasis in Gastric Carcinoma[J].JKorean Med Sci,2008,23(4):592-597.
[3]Arigami T,Natsugoe S,Uenosono Y,et al.Vascular endothelial growth factor-C and-D expression correlates with lymph node micrometastasis in pNO early gastric cancer[J].JSurg Oncol,2009,99(3):148-153.
[4]Shimizu M,Saitoh Y,Itoh H.Immunohistochemical staining of Ha-ras oncogene product in normal,benign,and malignant human pancreatic tissues[J].Hum Pathol,1990,21(6):607-612.
[5]Weidner N.Intratumor microvessel density as a prognostic factor in cancer[J].Am JPathol,1995,147:9-19.
[6]Makinen T,Jussila L,Veikkola T,et al.Inhibition of lymphangiogenesis with resulting lymphedema in transgenic mice expressing soluble VEGF receptor-3[J].Nat Med,2001,7(2):199-205.
[7]Stefano J,Mandriota,Lotta Jussila,et al.Vascular endothelial growth factor-C-mediated lymphangiogenesis promotes tumour metastasis[J].EMBO J,2001,20(4):672-682.
[8]Tanja Veikkola,Lotta Jussila,Taija Makinen,et al.Signalling viavascular endothelial growth factor receptor-3 is sufficient for lymphangiogenesis in transgenic mice[J].EMBO J,2001,20 (6):1223-1231.
[9]Hung CJ,Ginzinger DG,Zarneger R,et al.Expression of vasclar endothelial growth factor Cin benign and malignant thyrotumors[J].JClin Endocrinol Meta,2003,88(8):3694-3699.
[10]Lucie K,Tanja V,Valentin G,et al.Distinct Roles of Vascular Endothelial Growth Factor-D in Lymphangiogenesis and Metastasis[J].Am JPathol,2007,170(4):1348-1361.
[11]Onogawa S,Kitadai Y,Tanaka S,et al.Expression of VEGF-C and VEGF-D at the invasive edge correlates with lymph node metastasis and prognosis of patients with colorectal carcinoma [J].Cancer Sci,2004,95(1):32-39.
[12]Onogawa S,Kitadai Y,Amioka T,et al.Expression of vascular endothelial growth factor(VEGF)-C and VEGF-D in early gastric carcinoma:correlation with clinicopathological parameters[J].Cancer Lett,2005,226:85-90.
[13]Yancopoulos GD,Davis S,Gale NW,et al.Vascular-specif growth factors and blood vessel formation[J].Nature,2004,07(6801):242-248.
[14]Makinen T,Veikkola T,Mustjoki S,et al.Isolated lymphatic edothelial cells transduce growth,survival and migratory signavia the VEGF-C/D receptor VEGFR-3[J].EMBOJ,2001,(17):4762-4773.
[15]Marconcini L,Marchios,Morbidelli L,et al.c-fos-induced growtfactor/vascular endothelial growth factor D induces angiogenesin vivo and in vitro[J].Proc Natl Acad Sci USA,1999,96(17):9671-9676.
[16]Nathanson SD.Insights into the mechanisms of lymph node metastasis[J].Cancer,2003,98(2):413-423.
[17]Daniel BC,Eric HJ,Ashok KS,et al.Molecular targeted thrapies for pancreatic cancer[J].Am JSurg,2008,196(3):430-441.

