雷帕霉素對大鼠缺血再灌注腎細胞凋亡和P53蛋白表達的影響
鄭傳東 茍 欣 張 力 胡興平
1.成都市第五人民醫院泌尿外科,四川成都 611130;2.重慶醫科大學附屬第一醫院泌尿外科,重慶 400016
雷帕霉素(RPM)是放線菌培養液中分離的大環內酯類抗生素,是一種強有力的免疫抑制劑,已應用于腎移植中[1]。腎移植失敗的重要因素之一是腎缺血再灌注導致了嚴重的腎小管損傷。目前有研究表明,缺血再灌注導致腎損害的重要環節是細胞發生了凋亡[2]。降低腎缺血再灌注中細胞凋亡的發生對腎損傷的防治有顯著的臨床意義。有研究表明,細胞凋亡能被雷帕霉素抑制[3],促凋亡相關基因中P53是重要的因素之一[2]。本實驗建立腎缺血再灌注大鼠模型,探討雷帕霉素對大鼠缺血再灌注注損傷的療效及對P53表達的影響。
1 資料與方法
1.1 主要試驗藥物和試劑
TUNEL試劑盒購自Roche公司;兔多抗P53,SA1022,DAB顯色液均購自武漢博士德公司;RPM購自華北制藥集團新藥研究開發有限責任公司,RPM 批準文號2002HL0259,每毫升含RPM 1 mg。
1.2 試驗動物和分組
54只8~9周的Wistar雄性大鼠,購自重慶醫科大學實驗動物中心(合格證號:檢動字2002A040)。隨機分成假手術(sham)組、手術(IR)組和藥物(RPM+IR)組。再灌注后以0、24、48、72 h為4個觀察時相(每個觀察時相6只)。
l.3 動物模型的建立及用藥
大鼠腎模型的建立[4]:給予10%水合氯醛(3 mL/kg)腹腔注射,皮膚消毒。腹部正切口,切除右腎,分離左腎動脈,無損傷動脈夾夾閉,腎臟血流阻斷以腎臟顏色發白即可確認,缺血45 min后,松開動脈夾,腎臟血流恢復,腎臟由蒼白變為紅潤可確認。假手術組只分離左腎動脈,不夾閉。假手術組、手術組以等量生理鹽水代替藥物,以做陰性對照,藥物組于術前灌胃給藥RPM 4 mg(/kg·d)×3 d,術日術前2 h灌胃,術后給藥至0、24、48、72 h 各個觀察時相。
l.4 HE染色組織學觀察
腎標本予4%的多聚甲醛固定,石蠟處理,制成3 μm厚的石蠟切片,HE染色切片后,光鏡觀察各組的各時相腎臟切片。
l.5 細胞凋亡率檢測
二甲苯進行各組各時相腎臟石蠟切片脫蠟至水,TUNEL試劑盒測定凋亡率,進行脫水、透明、封片。光鏡下觀察,棕黃色細胞核的細胞為凋亡細胞,切片各隨機選擇10個無重疊視野于分析儀(Noesis S.A.Frence)200倍光鏡下,測定陽性染色平均光密度MOD及陽性染色面積率,計算細胞凋亡指數(apoptotic index,AI):AI(%)= MOD× 陽性表達面積率×100%。
l.6 免疫組化檢測P53
進行三組的各時相腎臟石蠟切片脫蠟至水,按兔SABC法免疫組化試劑盒操作,切片各隨機選擇10個無重疊視野(×400),予醫學圖像分析系統處理。陽性細胞率=陽性細胞數/視野所有細胞總數×100%,計數陽性細胞數及細胞總數,各計數100個細胞,檢測P53表達的平均光密度值MOD,計算P53陽性表達指數=MOD×陽性細胞率×100%。
1.7 統計學處理
采用SPSS13.00軟件,數據均以(x ± s)表示,多組間均數比較,采用單因素方差分析,以P<0.05為有統計學意義。
2 結果
2.1 建模成功后各組腎臟形態學變化
肉眼下:假手術組正常;藥物組輕度淤血和水腫;手術組嚴重淤血、水腫,髓質明顯變蒼白。光鏡下:假手術組各組無病理改變。手術組再灌注不同時間的腎臟病理改變各不相同。0 h組:腎臟正常。24 h組:腎小管腔被大量壞死細胞殘留物質堵塞,腎小管的結構輪廓尚見,大量腎小管上皮細胞呈空泡樣腫脹,部分壞死脫落,基底膜僅剩輪廓。48 h組:腎小管開始修復,腎小管中壞死的堵塞物質明顯減少。72 h組:部分腎小管結構完全修復,管腔干凈,通暢,壞死物質極少。光鏡下,手術組各個時相的病變均較藥物組嚴重,藥物組腎小管上皮細胞僅呈空泡樣腫脹、少許顆粒樣變性,無壞死,間質無異常。見圖1~2。
2.2 細胞凋亡率檢測
TUNEL陽性細胞的細胞質無染色,細胞核黃褐色。腎小球陰性表達;腎小管陽性表達,髓質明顯。見圖3~4。圖像分析陽性表達后。見表1。假手術組呈極弱陽性表達;手術組的細胞陽性率明顯增加(P<0.05);藥物組的細胞陽性率相對手術組顯著減少(P<0.05)。
2.3 P53蛋白的表達
P53陽性細胞細胞質無染色,細胞核黃褐色,腎小球陰性表達;腎小管陽性表達,髓質明顯。見圖5~6。圖像分析陽性表達后。見表1。假手術組呈極弱陽性表達;手術組的細胞陽性率明顯增加(P<0.05);藥物組的細胞陽性率相對手術組顯著減少(P<0.05)。
3 討論
3.1 細胞凋亡和腎臟缺血再灌注損傷關系
在動物實驗中發現,腎小管上皮細胞凋亡在腎臟缺血再灌注損傷中會大量出現[5],對移植后的尸體腎活檢,發現了同樣的情況[6],而且供腎冷缺血時間與細胞凋亡和缺血再灌注損傷呈正相關[7]。腎臟缺血再灌注損傷后細胞凋亡的機制極其復雜,氧自由基[8]、鈣離子超載[9-10]、炎性因子和炎癥介質[11]、與凋亡相關的基因,是多因素協同的病理生理過程。目前觀點認為,根據激活的半胱天冬酶種類不同分為“外在”通路和“內在”通路[12]。亦即傳統的死亡受體凋亡通路和線粒體凋亡通路。本實驗與手術組比較,藥物組細胞凋亡率顯著下降(P<0.05),說明雷帕霉素能明顯控制腎臟缺血再灌注中細胞凋亡的發生的作用。
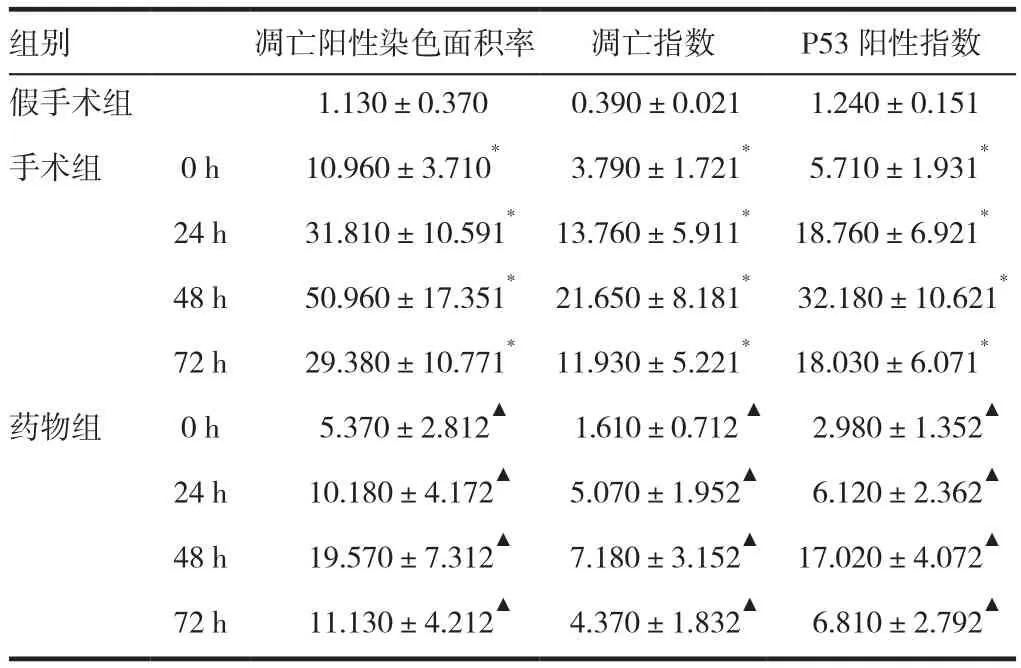
表1 TUNEL法測定腎缺血再灌注后大鼠腎小管上皮細胞凋亡結果及P53陽性細胞率(n=6,x ± s,%)

圖1 手術組24 h的腎組織HE染色(SABC×400)

圖2 藥物組24 h的腎組織HE染色(SABC×400)

圖3 手術組48 h的腎組織凋亡(SABC×400)

圖4 藥物組48 h 的腎組織凋亡(SABC×400)

圖5 P53在手術組72 h的腎組織的表達(SABC×400)
圖6 P53在藥物組72 h的腎組 織的表達(SABC×400)
3.2 P53在腎缺血再灌注中的作用
P53介導的線粒體凋亡通路:P53蛋白激活靶基因Bax,形成Bax-Bax二聚體,釋放細胞色素C和胞質內的ATP,導致caspase-9裂解caspase-3,出現細胞凋亡。P53介導的死亡受體凋亡通路:P53誘導Fas激活caspase-8,導致caspase的裂解,細胞凋亡。實驗表明:與手術組比較,藥物組P53表達強度明顯減弱(P<0.05),提示雷帕霉素能降低P53表達,抑制線粒體凋亡和死亡受體凋亡通路兩條途徑,抑制細胞凋亡的發生。
3.3 雷帕霉素作用的可能機制
RPM在結構上與FK506極為相似,FK506為鈣調神經素抑制劑類免疫抑制劑,而RPM為具有不同作用機制的增殖信號抑制劑(proliferation signal inhibitors,PSI)類免疫抑制劑[13]。研究發現,RPM通過非直接通路使激活的T細胞凋亡,阻止樹突狀細胞抗原呈遞,抑制其成熟,減少細胞因子的分泌[14]。阻止樹突狀細胞在腎組織遷移聚集,改善大鼠缺血再灌注腎組織的病理損傷及腎功能[15]。RPM抑制內皮細胞、平滑肌細胞和成纖維細胞等的增殖[16]。RPM可能是通過抑制細胞凋亡,抑制炎癥,減少自由基的生成,抑制T細胞、T細胞依賴性B細胞、樹突狀細胞的活性,減少細胞因子的分泌;抑制平滑肌細胞、內皮細胞和成纖維細胞等的增殖改善腎臟微循環等多種途經減輕腎組織損傷。RPM已應用于臨床器官移植中抗急、慢性排斥反應。此實驗表明:給藥RPM后,P53蛋白表達水平降低,細胞凋亡損害明顯降低,降低缺血再灌注造成的腎組織損傷,在臨床預防和減輕腎缺血再灌注損傷有很好的運用前景。
[1] Kuypers DR.Benefit-risk assessment of sirolimus in renal transplantation[J].Drug Saf,2005,28(2):153-181.
[2] 吳其夏,余應年,盧建.病理生理學[M].第2版.北京:中國協和醫科大學出版社,2003:271-296.
[3] 何小玲,逯寧,劉彤,等.雷帕霉素和中藥百令膠囊對大鼠小腸移植后細胞凋亡和FasL mRNA表達作用[J].中國中西醫結合外科雜志,2001,7(2):102-105.
[4] 張世卿,茍欣, 李云祥,等.FK506對缺血再灌注腎TNF-α,p38MAPK蛋白表達的影響 [J].醫學臨床研究,2006,23(4):465-467.
[5] Jiang s,Chen Y,Zou J,et a1.Diverse effects of ischemic pretreatments on the long-term renal damage induced by ischemia-reperfusion[J].Am J Nephro1,2009,30(5):440-449.
[6] Castaneda MP,Swiatecka-Urban A,Mitsnefes MM,et a1.Activation 0f mitochondrial apoptotic pathways in human renal allografts following ischemia[J].Transplantation,2003,76(1):50-54.
[7] Zhang GX,Kimura S,Murao K,et a1.Inhibition of cytochrome C release by 10-N-nonyl acridine orange,a cardiolipin-specific dye,during myoeardial ischemia-reperfusion in the rat[J].Am J Physiol Heart Circ Physiol,2010,298(2):H433-H439.
[8] Schramm L,Seibold A,Schneider R,et a1.Ischemic acute renal failure in the rat effects of L-arginine and superoxide dismutase on renal function[J].Nephrol,2008,21(2):229-235.
[9] Li Z,Nickkholgh A,Yi X,et a1.Melatonin protects kidney grafts from ischemia/reperfusion injury through inhibition of NF-kB and apoptosis after experimental kidney transplantation[J].J Pineal Res,2009,46(4):365-372.
[10] salas MA,Valverde CA,S6nchez G,et a1.The signalling pathway of CaMKII-mediated apoptosis and necrosis in the ischemia/reperfusion injury[J].J Mol Cell Cardiol,2010,48(6):1298-1306.
[11] 薛福平,李榮山.中華眼鏡蛇毒抑制腎缺血再灌注損傷的實驗研究[J].中華腎臟病雜志,2005,21(8):483-486.
[12] Devarajan P,Mishra J,Supavekin S,et a1.Gene expression in early ischemic renal injury:clues towards pathogenesis,biomarker discovery,and novel therapeutics[J]. Molecular Genetics and Metabolism,2003,80(4):365-376.
[13] Lehmkuhl H,Ross H,Eisen H,et a1.Everolimus(certican)in heart transplantation:optimizing renal function through minimizing cyclosporine exposure[J].Transplant Proc,2005,37(10):4145-4149.
[14] Monti P,MercaIIi A,Leone BE,et a1.Rapamycin impairs antigen uptake of human dendritic cells[J].Transplantation,2003,75(1):137-145.
[15] 周同,孫桂芝,張玉梅,等.黏附分子與樹突狀細胞在大鼠肝和腎缺血-再灌注損傷中作用及抗黏附干預的影響[J].中國微循環,2004,8(5):342-343.
[16] 黃赤兵,張銀甫.雷帕霉素作用機制研究及在腎移植中的應用進展[J].中國藥房,2006,17(7):547-549.

