蠅蛆復合發酵蛋白替代魚粉對彭澤鯽的生長性能和肝臟功能的影響
西南大學動物科技學院水產系 郭玉陽 羅 莉*陳任孝 朱根廷
新希望集團技術研發中心 羅 浩 李洪琴
蠅蛆復合發酵蛋白 (fermented maggot protein,FMP)是將集中孵化的幼蛆搭配其他蛋白原料,在適宜條件下與特定微生物共生培養而得到的一種復合發酵蛋白,該蛋白含有大量游離氨基酸、多肽及其他未知促生長因子。本試驗以FMP替代彭澤鯽飼料中魚粉,研究其對彭澤鯽的生長性能和肝臟功能的影響,以期科學評價FMP的替代效果,為FMP替代魚粉的應用提供試驗依據。
1 材料與方法
1.1 試驗設計及日糧 根據鯽魚的營養參數,以魚粉、豆粕、小麥、米皮糠等為主要原料配制基礎日糧,日糧組成及營養水平見表1(張萍等,2001)。試驗日糧以6%、10%和16%的FMP等量替代基礎日糧中的魚粉,相當于替代魚粉總量的37.5%、62.5%和100%,分別為M-6%組、M-10%組和M-16%組。預處理后的原料粉碎過60目篩,按配方稱重后均勻混合,擠壓成粒徑為1.5 mm,風干成水分含量為11%的顆粒飼料,置于-18℃冰箱保存備用。
1.2 試驗魚與飼養管理 彭澤鯽購自重慶市北碚區歇馬漁場,在室內循環水養殖系統中進行養殖試驗。挑選體格健壯,體重(9.00±0.50)g的鯽魚,用基礎飼料馴養15 d,待攝食正常后開始正式試驗。生長試驗分為4個組,每組3個重復,每個重復 50 尾魚,每天投喂 4 次(8∶00、11∶30、15∶00、18∶30),日投喂量為體重的3% ~5%,根據試驗魚的增重情況,每隔10 d調整一次投飼率。每個試驗桶容積330 L(有效體積)。飼養期間水溫22~28℃,溶解氧 >8.0 mg/L,氨氮含量 <0.10 mg/L,pH 6.6~7.0,亞硝酸鹽<0.1 mg/L。正式試驗期56 d。
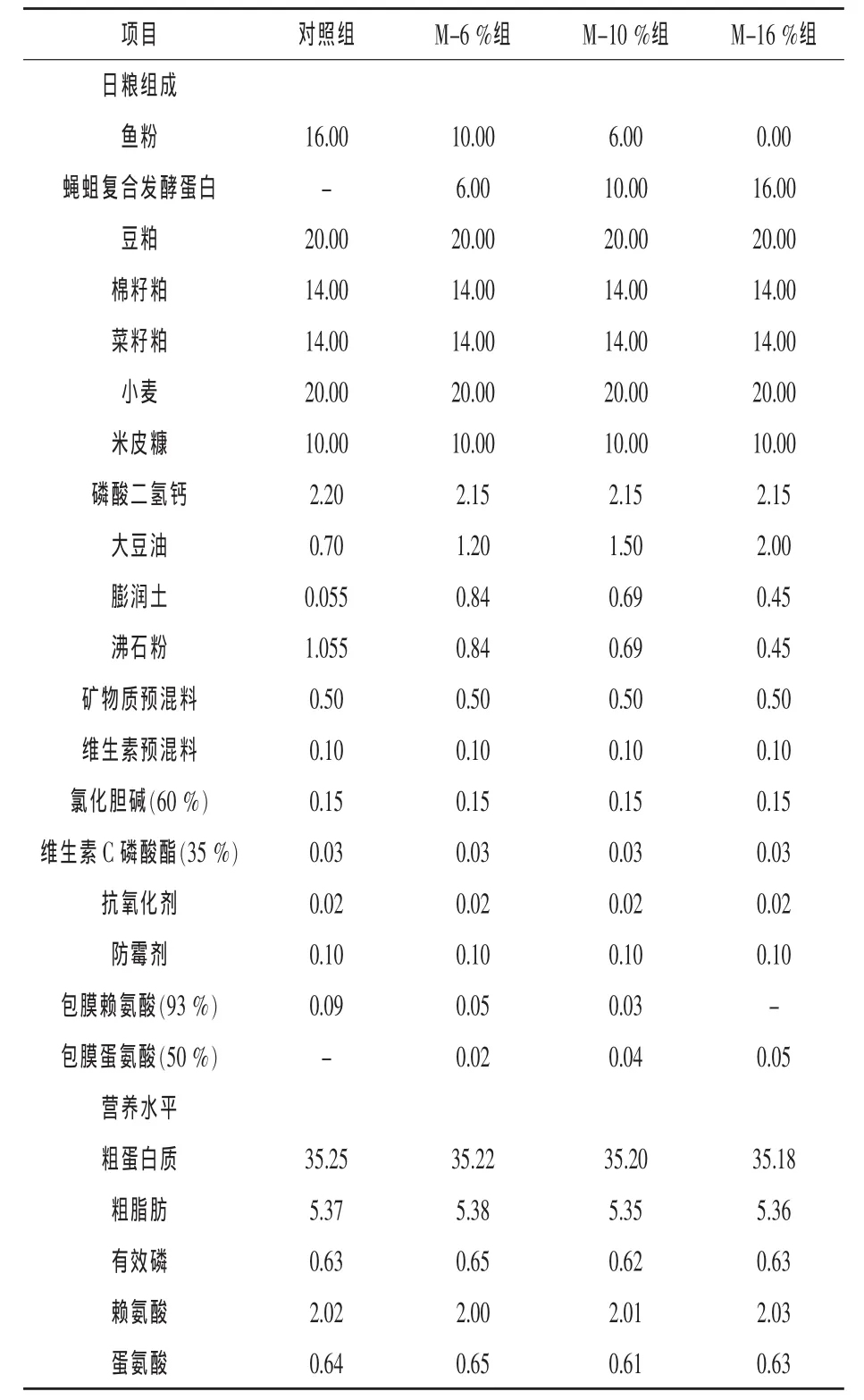
表1 基礎日糧組成及營養水平(風干基礎)%
1.3 樣品采集與制備 試驗前取30尾魚作為初始樣本,每組取100 g飼料待測。試驗結束,試驗魚禁食24 h,測定每缸魚的總重,記錄飼料投喂量。并從每重復組隨機取出15尾魚,立即于冰盤上解剖,取出腸道和肝臟,分別稱重后剪碎,按1∶9(g:mL)加入魚用生理鹽水(4 ℃),迅速轉入玻璃勻漿器勻漿(勻漿過程在冰浴環境中進行),將勻漿液離心(4 ℃,3500 r/min)15 min,取上清液即得粗酶液,置-80℃超低溫冰箱中冷凍保存,用于腸道和肝臟指標的測定。
1.4 測定指標及測定方法
1.4.1 試驗原料和飼料樣品的分析 試驗原料和飼料樣品的水分、粗蛋白質、粗脂肪和粗灰分含量按國際標準方法(AOAC,1995)測定。氨基酸采用酸水解法測定,由于色氨酸在酸水解過程中被破壞,未測定到,所用儀器為日立835-50型氨基酸自動測定分析儀。
1.4.2 生長性能指標
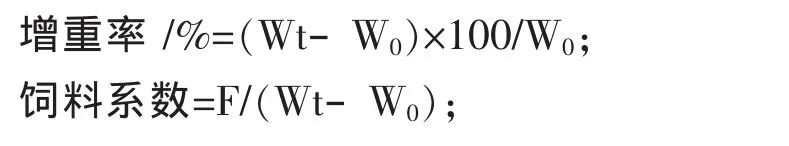
式中,W0為魚初始尾均重 /g;Wt為魚終末尾均重 /g;F為平均攝食飼料總量/g。
1.4.3 腸道消化酶活性的測定 蛋白酶活性采用福林-酚法測定(中山大學生物系,1979);淀粉酶活性采用淀粉-碘顯色法測定 (上海市醫學化驗所主編,1979);脂肪酶活性采用聚乙烯醇橄欖油乳化液水解法測定(中山大學生物系,1979)。
1.4.4 肝胰臟常規指標的測定 肝臟常規指標均采用南京建成生物研究所研制的相應試劑盒和752型分光光度計測定。谷丙轉氨酶(GPT)和谷草轉氨酶(GOT)活性采用賴氏法測定;γ-谷氨酰氨轉移酶(γ-GT)和堿性磷酸酶(AKP)活性采用比色法測定;超氧化物歧化酶(SOD)活性采用黃嘌呤氧化酶法測定;丙二醛(MDA)含量采用TBA法測定。
1.5 數據處理 采用SPSS13.0統計軟件進行單因子方差分析 (One-way ANOVA),同時進行Duncan’s多重比較,P<0.05為差異顯著,結果以“平均值±標準差”表示。
2 結果
2.1 不同比例FMP替代魚粉對彭澤鯽生長性能的影響 由表2可知,對照組彭澤鯽增重率和飼料利用率均最高,各試驗組隨替代比例升高呈下降趨勢,與對照組相比均差異顯著(P<0.05),增重率分別比對照組降低5.88%、10.62%和13.74%,飼料系數分別較對照組提高10%、18.33%和20%。試驗魚成活率均為100%。
2.2 不同比例FMP替代魚粉對彭澤鯽腸道消化酶活性的影響 由表3可知,FMP的替代提高了彭澤鯽的腸道脂肪酶活性,降低了腸道蛋白酶和淀粉酶活性。其中,M-6%組的腸道脂肪酶活性與對照組差異不顯著(P>0.5);其他各組與對照組均差異顯著 (P<0.05),M-10%組和M-16%組分別較對照組提高27.77%和39.97%。
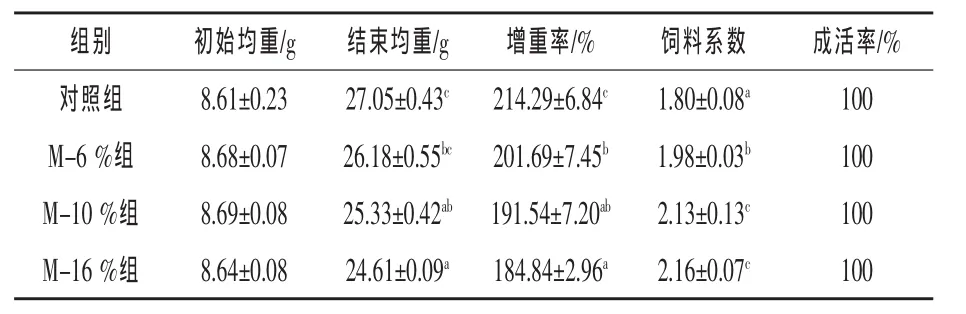
表2 FMP替代魚粉對彭澤鯽生長性能的影響

表3 FMP替代魚粉對彭澤鯽腸道消化酶活性的影響
2.3 不同比例FMP替代魚粉對彭澤鯽肝臟功能的影響
2.3.1 FMP對彭澤鯽肝臟功能常規指標的影響由表4可知,隨FMP替代比例的增加彭澤鯽肝臟中GOT和GPT活性呈下降趨勢,各替代組與對照組相比差異顯著 (P<0.05),GPT/GOT比值呈下降趨勢,但M-6%組與對照組差異不顯著(P>0.05)。試驗組γ-GT活性均顯著低于對照組(P<0.05),且呈下降趨勢;AKP活性逐漸降低,各替代組中M-6%組值最高。
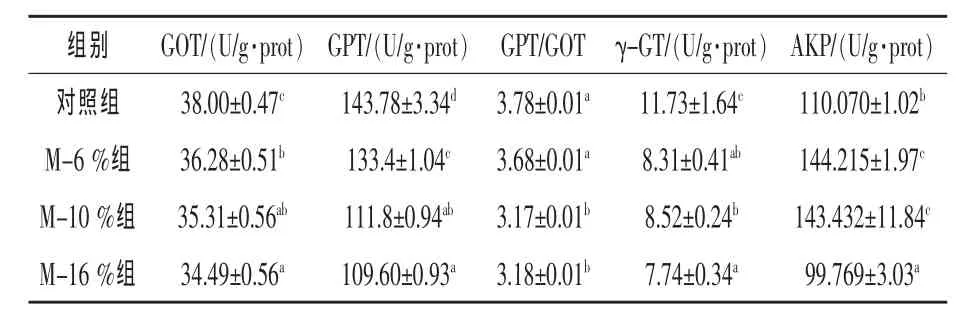
表4 FMP替代魚粉對彭澤鯽肝臟功能指標的影響
2.3.2 FMP對彭澤鯽肝臟抗氧化能力指標的影響 由表5可知,各試驗組SOD活性均低于對照組,隨著替代比例的增加,替代組肝臟SOD活性逐漸升高,其中M-16%組SOD活性與對照組差異不顯著(P>0.05);肝臟MDA含量先升高后降低,各組間差異顯著(P<0.05)。
3 討論
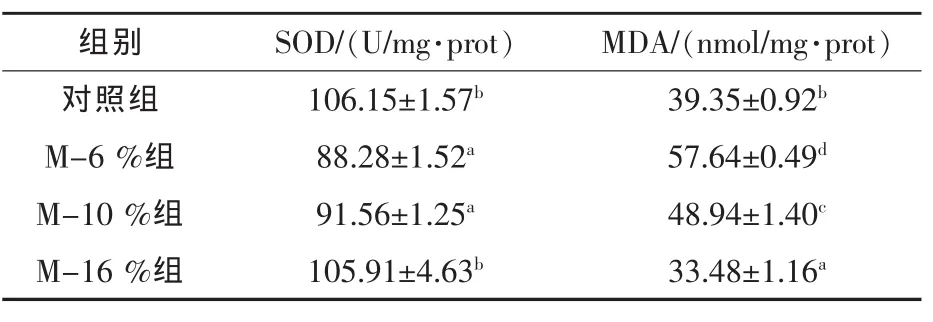
表5 FMP替代魚粉對彭澤鯽肝臟抗氧化能力的影響
魚體對蛋白質的利用與氨基酸的種類、含量及平衡有關(劉超等,2002;張滿龍和鄧理,2002;Tesseraud等,1996)。研究表明,氨基酸平衡能提高動物對蛋白質和氨基酸的利用率,促進動物生長,節約飼料蛋白質資源,減少含氮物質對環境的污染(李桂梅等,2010)。本試驗日糧配方的配制,通過補充包膜氨基酸僅平衡了試驗日糧的賴氨酸和蛋氨酸含量,而魚粉是公認的氨基酸平衡性最好的動物蛋白源,作為替代蛋白原的FMP與魚粉的氨基酸模式相差較大(表6),隨著替代魚粉比例增大,氨基酸不平衡的缺陷越明顯,故而彭澤鯽的生長性能逐漸下降。
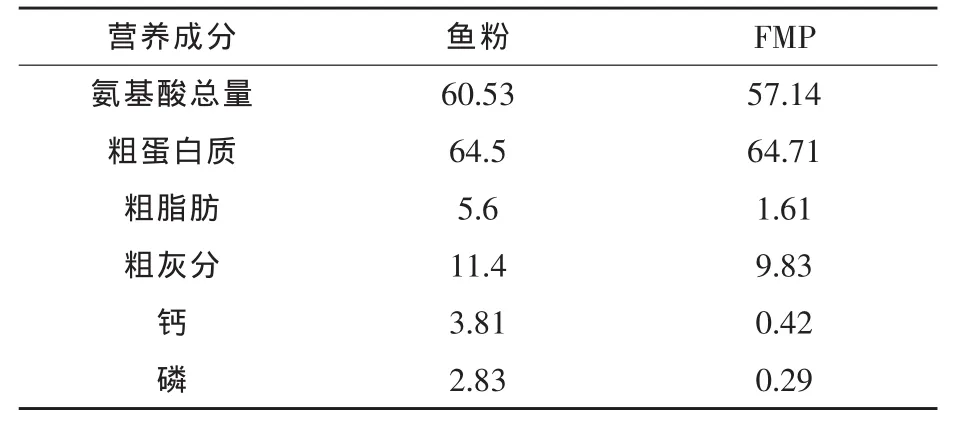
表6 FMP和魚粉的營養成分比較 %
消化與吸收是魚類獲取營養物質與能量的基本途徑,這一過程主要由消化酶對食物進行化學性消化來完成。國內外學者對鱖魚 (錢國英,1998)、黃鱔(楊代勤等,2004)、胡子鯰(Uys 和Hecht,1987)、鯉(Ragyanszki,1980)研究表明,魚類攝取的食物對體內消化酶分泌有較大的影響,消化道內存在的食物種類與魚類消化酶的分泌數量及種類有一定相關性。隨著FMP替代魚粉比例的增加,彭澤鯽的腸道蛋白酶活性和淀粉酶活性下降,可能與FMP在發酵過程中使用了消化率低于魚粉的其他蛋白原料有關,且其他餅粕類蛋白原料中抗營養因子并沒有通過發酵完全去除。脂肪酶活性的升高機制和影響目前尚不清楚,需進一步的研究。
正常情況下機體自由基的產生與清除處于一種動態平衡,當自由基產生過多而清除物質過少時,就會對機體造成氧化損傷(Sies,1997)。 SOD對體內自由基的清除具有重要作用,其含量可以反映機體對自由基的清除能力 (Fattman等,2003);MDA的含量可反映自由基的產生量和生物膜的損傷程度(Traystman等,1991)。本試驗中,隨著FMP替代魚粉的比例增加,彭澤鯽肝臟自由基清除能力先下降后升高,這可能與蠅蛆發酵蛋白在發酵中獲得的其他有益生長因子,如益生菌、游離氨基酸或功能性小肽等有關 (沈文英等,2011;王炳祥等,2011;王一娟等;2011)。 當 FMP的替代量增加時,日糧中所含的有益生長因子也相應增多,故而表現出肝臟抗氧化能力先下降后升高的現象。
GPT和GOT是機體最重要的兩種轉氨酶,廣泛分布于各組織器官,肝臟是GOT含量最高的組織,肝臟中GPT的含量也很高,僅次于心臟。這兩種酶在機體蛋白質和氨基酸代謝中起重要作用,其活性與氨基酸代謝強弱有關(李桂梅等,2010)。γ-GT參與谷胱甘肽循環,生理作用主要是參與蛋白質的合成,并控制組織谷胱甘肽水平,攝取血漿中的谷氨酸以供合成蛋白質之用,其活性的強弱可反應機體蛋白質代謝的強度(王繼貴,1996)。本試驗中各替代組的肝臟GOT、GPT和γ-GT活性下降表明氨基酸代謝降低,蛋白質分解升高,不利于氮在體內的蓄積,在生產中即表現為體增重下降。
AKP可以催化各種含磷化合物水解,在動物機體的骨化,營養的吸收、轉運與利用,解毒體系和免疫反應中發揮作用(孫靜秋等,2007;He和Sun,1992)。本試驗中彭澤鯽肝臟AKP活性升高后下降,可能是FMP中某些有益生長因子的作用,提高了彭澤鯽代謝及免疫力;也可能是受有毒物質誘導,肝臟內AKP的合成出現生理補償現象,而隨劑量增加,肝臟無法適應,AKP活性隨之下降,與一些魚類的毒性試驗結果類似(孔祥會等,2007)。
GPT/GOT比值在臨床上可作為評判肝炎病人肝纖維化和肝硬化的一個獨立的指標,其比值隨肝病病程變長、病程加重而升高(傅淑艷,2002;Sheth等,1998)。本試驗中,雖然各檢測指標與對照組相比有高有低,但并不能說明彭澤鯽肝臟受一定損傷或有病理變化,其可能是在正常范圍內。至于魚類各項檢測指標的參考范圍及評價標準尚有待進一步研究。
[1]傅淑艷.肝病患者AST/ALT比值的檢測及臨床意義[J].浙江臨床醫學,2002,4(12):942 ~ 943.
[2]孔祥會,劉占才,郭彥玲,等.汞暴露對草魚器官組織中堿性磷酸酶活性的影響[J].中國水產科學,2007,14(2):270 ~ 275.
[3]劉超,閔育娜,雷海寧,等.飼料中可利用氨基酸研究進展[J].農業大學學報,2002,4:401 ~ 409.
[4]李桂梅,解綬啟,雷武,等.異育銀鯽幼魚對飼料中纈氨酸需求量的研究[J].水生生物學報,2010,34(6):1157 ~ 1165.
[5]錢國英.不同馴食方式對鱖魚胃、腸道消化酶活性的影響[J].浙江農業大學學報,1998,24(2):201 ~ 210.
[6]沈文英,李衛芬,梁權,等.飼料中添加枯草芽孢桿菌對草魚生長性能、免疫和抗氧化功能的影響[J].動物營養學報,2011,23(5):881 ~ 886.
[7]孫靜秋,許燕,張慧綺,等.凡納對蝦體內 ACP、AKP酶的細胞化學定位[J].復旦學報(自然科學版),2007,46(6):947 ~ 951.
[8]上海市醫學化驗所主編.臨床生化檢驗(上冊)[M].上海:科學技術出版社,1979.366~ 368.
[9]王炳祥,顧國生,李鑫雨,等.山羊胎盤小肽的分離及對小鼠抗氧化能力的影響[J].西南農業學報,2011,1:315 ~ 318.
[10]王一娟,何義進,謝俊,等.抗菌肽對河蟹生長、免疫及抗氧化能力的影響[J].江蘇農業科學,2011,39(2):340 ~ 343.
[11]王繼貴.臨床生化檢驗[M].長沙:湖南科學技術出版社,1996.
[12]楊代勤,嚴安生,陳芳,等.不同飼料對黃鱔消化酶活性的影響[J].水產學報,2004,27(6):558 ~ 563.
[13]中山大學生物系.生化技術導論[M].北京:人民教育出版社,1979.52~54.
[14]張萍,趙振倫,楊沁芳.鯽營養需求與營養生理的研究進展[J].水利漁業,2001,21(3):9 ~ 11.
[15]張滿龍,鄧理.氨基酸在魚類養殖中的作用[J].水利漁業,2002,22(6):25~26.
[16]Fattman C L,Schaefer L M,Oury T D.Extracellular superoxide dismutase in biology and medicine[J].Free Radical Bio Med,2003,35:236 ~ 256.
[17]He H Q,Sun F.Studies on the characteristics of acid and alkaline phosphatase in Chinese shrimp,Penaeus chinensis[J].Oceanoiogia Et Limnoiogia Sinica,1992,23(5):555 ~ 560.
[18]Ragyanszki M.Preliminary investigations on the proteolytic digestive enzymes of carp fry[J].Aquaculture,1980,2:27 ~ 30.
[19]SiesH.Oxidativestress:oxidantsand antioxidants [J].Exp Physiol,1997,82:291 ~ 295.
[20]Sheth S G,Flamm S L,Gordon F D,et al.AST/ALT ratio predicts cirrho-sis in patietns with chronic hepatitis Cvirusinfection[J].Am J Gastroent,1998,93:44 ~ 48.
[21]Tesseraud S,Maaa N,peresson R,et al.Relative responses of protein turnover in three different skeletal muscles to dietary lysine deficiency in chicks[J].Bri poult Sci,1996,37(3):641 ~ 650.
[22]Traystman R J,Kirsch J R,Koehler R C.Oxygen radical mechanisms of brain injury following ischemiaand reperfusion[J].J Appl Physiol,1991,71:1185~1195.
[23]Uys W,Hecht T.Changes in digestive enzyme activities of catfish Claria gariepinus[J].Aquaculture,1987,621:243 ~ 250.

