蘿卜EST-SSR標記PCR反應體系的建立與優化
付衛民 ,王淑芬 ,王秀峰 ,何啟偉 ,劉賢嫻 ,韓曉雨
(1.山東農業大學園藝科學與工程學院,泰安,271018;2.山東省農業科學院蔬菜研究所/山東省設施蔬菜生物學重點實驗室/國家蔬菜改良中心山東分中心)
蘿卜 (Raphanus sativusL.var.longgpinnatus Bailey)為十字花科蘿卜屬一、二年生草本植物,起源于我國,目前在世界各地廣泛栽培,是主要的蔬菜作物之一。近年來,隨著蘿卜育種工作的不斷進步和蘿卜種質資源深入挖掘利用,使得蘿卜種質資源日益豐富,但同時也對蘿卜的遺傳多樣性鑒定、新品種測試與保護工作提出了新的挑戰。
基于DNA多態性分析的分子標記技術已經成為遺傳多樣性鑒定與評價的通用方法。隨機序列擴增多態性 (RAPD)、限制性片段擴增多態性(AFLP)、微衛星標記(SSR)等是植物遺傳多樣性研究中運用最多的幾種方法[1]。而近幾年新興的ESTSSR標記技術除具有SSR標記多態性高、重復性好等優點外,還很好地彌補了其缺點,例如操作簡單,引物獲取比較容易,可以直接根據公共數據庫中的EST序列篩選SSR,設計引物等。EST-SSR標記能更準確地反映出不同基因型之間的遺傳差異和親緣關系[2],且引物的通用性更好[3],另外,由于EST序列直接位于基因的編碼區,因此更容易篩選到與功能基因緊密連鎖的標記。目前該方法已廣泛應用于小麥、大豆、黃瓜、辣椒、油菜、番茄等作物的分子標記研究[4~9]。但鑒于該方法基于PCR技術,反應條件易受多種因素影響,因此,有必要對實際研究中相應的反應體系進行優化,以提高研究效率和獲得更為準確的研究結果。
本研究對較為常用的20 μL PCR技術體系,利用 L16(45)正交試驗設計,從模板 DNA、Mg2+、dNTP、引物、Taq酶等5個因素4種水平對蘿卜EST-SSR反應體系進行優化分析,以期建立一套適合蘿卜的EST-SSR反應體系。
1 材料與方法
1.1 試驗材料
試驗所用蘿卜品種為紫玉。快捷型植物基因組DNA提取試劑盒購自北京天根公司;Mg2+、dNTPs、TaqDNA聚合酶均購自寶生物工程 (大連)有限公司;引物合成于北京六合華大基因科技股份有限公司,其他常規試劑均購自上海生工生物工程技術有限公司;50 bp maker購自Fermentas公司。
1.2 試驗方法
①DNA的提取 在蘿卜苗期,取上數第3~4片葉100 mg,洗凈,加入適量液氮充分研磨,采用快捷型植物基因組DNA提取試劑盒進行。
②PCR擴增 PCR擴增在ABI2720PCR儀上進行。反應體系為20 μL。反應條件為94℃預變性2 min,94℃變性 30 s,54℃退火 30 s,72℃延伸 1 min,共40個循環,72℃延伸7 min,4℃保存。FWM11為優化引物,其他10對為驗證引物(表1)。
③正交試驗設計 本研究設計為DNA模板濃度、Mg2+、dNTPs、引物濃度和TaqDNA聚合酶濃度5個因素 4 個水平的 L16(45)正交試驗(表 2),另外每管加 2 μL 不含 Mg2+的 10×PCR Buffer。 擴增產物在8%聚丙烯酰胺凝膠上檢測,銀染顯色,照相保存。
2 結果與分析
2.1 基因組DNA濃度和純度檢測
供試材料的基因組DNA,紫外分光光度檢測A260/A280值均在1.8~2.0;0.8%的瓊脂糖凝膠電泳檢測(圖1)顯示,條帶清晰,無降解,純度高,達到EST-SSR分析的要求。
2.2 正交優化結果分析
PCR反應體系擴增結果表明(圖2),3、11和14擴增條帶清晰,14號反應體系條帶最濃,試劑使用最經濟,因此確定最佳體系為DNA模板65 ng/20 μL,Mg2+0.8 mmol/L,dNTPs 0.25 mmol/L,Taq DNA 酶0.4 U/20 μL,每個引物 0.8 μmol/L。
2.3 優化體系的驗證
本試驗采用紫玉蘿卜F2代綠葉植株構建的基因池和11對引物對14號反應體系進行驗證,F2基因組DNA為對照。結果表明(圖3),10對引物擴增條帶符合預期片段大小,條帶清晰,均為有效擴增。
3 小結與討論
由上述擴增結果表明,DNA模板在4個水平范圍都有效擴增,對反應體系影響最小;引物、TaqDNA酶和dNTPs在3個水平內有效擴增,對反應體系影響也不大;Mg2+濃度為0.8 mmol/L時,擴增條帶特異性好,條帶清晰,均為預擴增條帶,且Mg2+對擴增效率也有影響,濃度過高或過低均使非特異性擴增產物減少或導致擴增反應失敗,故Mg2+對該反應體系影響最大。本研究結果與王娟等[10]優化蘋果ESTSSR標記PCR反應最佳體系、韓明利等[9]優化番茄EST-SSR標記PCR反應體系、李紅雙等[11]優化蘿卜SRAP-PCR反應體系中的關鍵Mg2+因素相一致。而與佟海申等[12]研究大白菜EST-SSR標記PCR反應體系4因素(不包括Mg2+)的最佳反應濃度和關鍵影響因素有差異,原因可能是沒有單獨對Mg2+因素考慮和試驗材料不同所致。
本研究利用正交試驗優化蘿卜EST-SSR標記的PCR反應體系,具有擴增條帶清晰、重復性好、多態性豐富等特點,為蘿卜種質資源的鑒定與評價、EST-SSR分子標記輔助選擇育種等奠定了十分重要的基礎,具有很好的應用價值。

表1 PCR反應體系引物

表2 正交試驗設計L16(45)
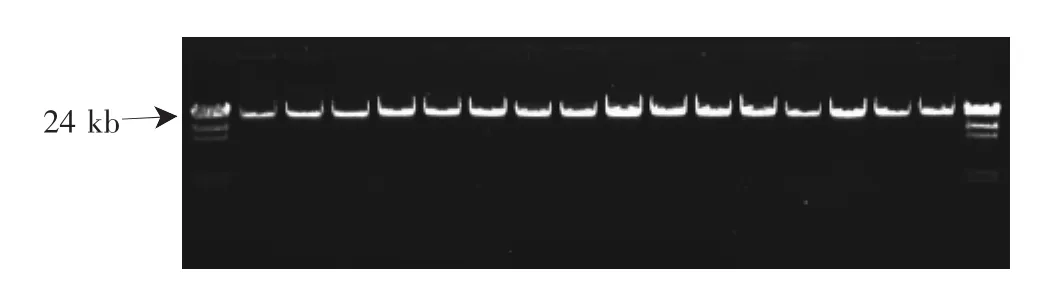
圖1 基因組DNA電泳結果

圖2 正交設計EST-SSR反應體系擴增結果

圖3 14號反應體系在F2中的驗證
[1]Powell W,Morgante M,Andre C,et al.The comparison of RFLP,RAPD,AFLP and SSR (microsatellite)markers for germplasm analysis[J].Mol Breed,1996,2:225-238.
[2]李建明,李洪杰,柴守誠,等.普通小麥 Genomic-SSR和EST-SSR分子標記遺傳差異[J].安徽農業科學,2007,35(26):8 173-8 175,8 183.
[3]宿俊吉,柴守誠,劉偉華,等.普通小麥SSR和EST-SSR引物對冰草通用性的比較分析 [J].西北植物學報,2007,27(7):1 311-1 316.
[4]Li W,Dong P,Wei Y M,et al.Genetic variation in Triticum turgidumL.ssp.turgidumLandraces from China assessed by EST-SSR markers[J].Agricultural Sciences in China,2008,7(9):1 029-1 036.
[5]藺宇,徐靜靜,王曉鳴,等.適用于大豆疫霉菌遺傳分析的新 EST-SSR 標記[J].中國農業科學,2008,41(8):2 294-2 301.
[6]胡建斌,李建吾.黃瓜基因組EST-SSRs的分布規律及EST-SSR 標 記 開 發 [J].西 北 植 物 學 報 ,2008,28(12):2 429-2 435.
[7]李晶晶,王述彬,劉金兵,等.辣椒EST-SSR標記的開發[J].分子植物育種,2008,6(6):1 219-1 222.
[8]李小白,張明龍,崔海瑞.油菜EST-SSR標記的建立[J].分子細胞生物學報,2007,40(2):137-144.
[9]韓明利,侯麗霞,崔娜,等.番茄EST-SSR標記PCR反應體系的優化[J].西北園藝,2011(16):142-144.
[10]王娟.蘋果EST-SSR引物的開發及部分品種親緣關系分析[D].鄭州:河南農業大學,2009:30-32.
[11]李紅雙,邱楊,李錫香.蘿卜SRAP-PCR反應體系的建立與優化[J].華北農學報,2009,24(增刊):91-95.
[12]佟海申,宋琳,張志剛,等.大白菜EST-SSR反應體系優化及引物篩選[J].科技導報,2010,28(3):76-81.

