微波輔助超強酸催化合成乳酸丁酯的研究
寧小飛, 李曼菲, 吳 杰, 焦慶周, 柴多里
(1.合肥工業大學 化學工程學院,安徽 合肥 230009;2.合肥工業大學 醫學工程學院,安徽 合肥 230009)
微波輔助超強酸催化合成乳酸丁酯的研究
寧小飛1, 李曼菲1, 吳 杰2, 焦慶周1, 柴多里1
(1.合肥工業大學 化學工程學院,安徽 合肥 230009;2.合肥工業大學 醫學工程學院,安徽 合肥 230009)
文章采用微波輻射法制備了ZrO2/SO42-固體超強酸,并以其為催化劑合成了乳酸丁酯;考察了醇酸的摩爾比、催化劑用量、帶水劑用量、反應溫度及微波輻射時間等因素對酯化率的影響。結果表明,較佳的醇酸摩爾比為1.3∶1,催化劑用量為原料總質量的1.5%,反應溫度為90℃,帶水劑用量為16mL(15mL乳酸),可合成純度較高的乳酸正丁酯。微波輻射可提高反應選擇性,產品純度高,并明顯縮短酯化反應時間至30min,酯化率達94%。
微波輻射法;固體超強酸;酯化率;乳酸正丁酯
0 引 言
乳酸丁酯,化學名稱為α-羥基丙丁酯,是一種化學性質穩定并呈牛奶香味和甜奶油香氣且微溶于水的無色液體。乳酸丁酯是一種性能優良、用途廣泛的溶劑,主要用于天然樹脂、印刷油墨、油漆等,同時也是合成香料的重要原料[1]。傳統的以濃硫酸為催化劑合成乳酸丁酯的工藝存在許多的弊端,如工序流程較長、設備腐蝕嚴重、產品色澤較差、副反應多及環境污染較大等[2-3]。為克服上述缺陷,許多研究者在不斷地探索具有優良性能的催化劑以及新的工藝制備路線和制備方法[4]。固體超強酸具有耐高溫、反應活性高、選擇性好、不腐蝕設備、易分離、可重復使用及環境友好等優點[5],因而具有較高的工業應用價值。文獻[6]利用納米固體超強酸/TiO2作為催化劑,采用乳酸與正丁醇的摩爾比為1∶3合成了乳酸丁酯,在最佳條件下,乳酸丁酯的收率可達86%以上。同時有研究表明[7-10],摻雜少量的稀土元素,能夠改變催化劑表面的化學狀態,提高催化劑表面元素的極化程度,從而達到改善催化劑活性及壽命的目的。而微波技術在有機合成反應中的優越性,也使其應用受到了人們的關注[11-12]。
本文采用微波輔助的方法,以固體超強酸作為催化劑,由乳酸和正丁醇合成了乳酸正丁酯,并優化了產品的合成工藝條件,使酯化率達到94%。
1 實 驗
1.1 主要試劑和儀器
五水硝酸鋯(AR)、2,4-二硝基甲苯(AR)、氨水(AR)、濃硫酸(AR)、乳酸(工業品自提純>98%)、正丁醇(AR)、環己烷(AR)、氯化鈉(AR)、無水碳酸鈉(AR)等試劑均購自國藥集團化學試劑有限公司。
Nicolet 67傅里葉紅外光譜儀(美國Thermo Nicolet),GC9790J氣相色譜儀(中國福立)。
1.2 催化劑的制備
稱取適量五水硝酸鋯溶于去離子水中,用氨水調節pH值至10,低溫沉壓,抽濾,洗滌,將濾餅在100℃下干燥10h,研磨至100目以下,用2.0mol/L硫酸溶液浸泡12h。將該溶液進行微波輻射反應后抽濾,所得濾餅置于干燥箱中干燥后轉移至坩堝中,在馬弗爐內于550℃下焙燒3h,得到白色粉末狀固體超強酸。
1.3 乳酸正丁酯的合成
在裝有溫度計、油水分離器和回流裝置的三口燒瓶中,加入設定量的正丁醇、乳酸、帶水劑環己烷、催化劑(ZrO2/)固體超強酸和沸石。加熱回流,同時將反應產生的水通過油水分離器從體系中分離,直至無水帶出,視為反應終點。抽濾反應液,分離催化劑,依次用飽和Na2CO3溶液和飽和NaCl溶液對濾液進行洗滌和分液后,對上層溶液進行減壓蒸餾,收集95~105℃的餾分,得到無色透明產品。
2 結果與討論
2.1 Hammett指示劑法表征固體超強酸
稱取0.25g 2,4-二硝基甲苯(Ho=-13.8),完全溶解于2.5mL苯。趁熱加入制得的ZrO2/固體,一段時間后由白色逐漸變為灰黑色,說明制得的物質的酸強度Ho<-13.8,是固體超強酸[13]。
2.2 醇酸摩爾比對酯化率的影響
為優化酯化反應條件,通過控制變量法,在不同的醇酸摩爾比條件下分別進行反應,研究醇酸摩爾比對酯化率的影響,結果如圖1所示。
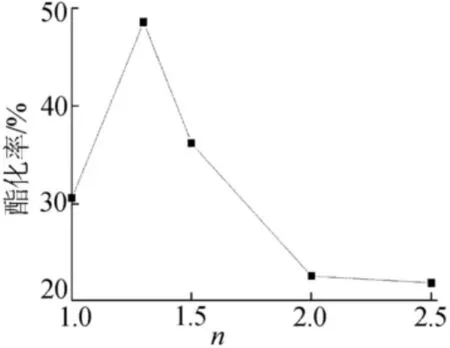
圖1 醇酸摩爾比對酯化率的影響
由于正丁醇與乳酸價格相差較大,因此為了使價格較高的乳酸能夠盡量完全反應,采用了醇過量的設計方案。由圖1可知,增大醇酸的摩爾比,能夠促進乳酸完全參與反應,酯化率也隨之提高。當醇酸摩爾比達到1.3∶1時,酯化率達到最大。若繼續增大正丁醇的投加量,可能是由于反應體系中催化劑或乳酸的含量下降,酯化率呈現下降的趨勢。因此,醇酸摩爾比宜為1.3∶1。
2.3 催化劑用量對酯化率的影響
采用醇酸摩爾比1.3∶1,加入不同用量的催化劑進行酯化反應,研究催化劑用量對酯化率的影響,結果如圖2所示。

圖2 催化劑用量對酯化率的影響
由圖2可知,隨著催化劑用量的增加,酯化率也相應地增大。當催化劑的質量分數為1.5%時,酯化率達到最大。當繼續增大催化劑的用量時,可能會加劇副反應的發生而使酯化率略有下降,但已趨于穩定。因此,催化劑的最佳用量為1.5%。
2.4 反應溫度對酯化率的影響
控制醇酸比1.3∶1,催化劑用量1.5%,其他條件保持不變,在不同反應溫度下進行酯化反應,反應溫度對酯化率的影響如圖3所示。
由圖3可以看出,在溫度低于90℃時,隨著反應溫度的升高,酯化率有明顯的提高。但當溫度升高到90~105℃時,酯化率達到了一個較高的數值。此時若繼續升高反應溫度,酯化率出現了大幅度的下降,是因為酯化反應是放熱反應,逆反應是吸熱反應,升高溫度促進逆反應進行。因此,90~105℃為最合適的反應溫度范圍。
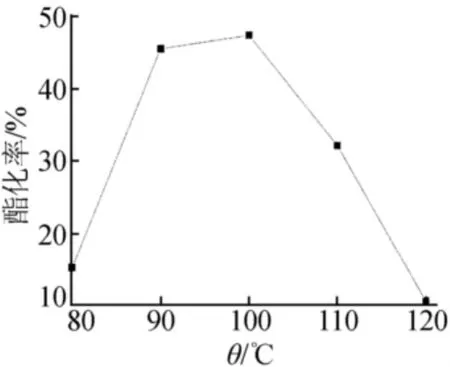
圖3 反應溫度對酯化率的影響
2.5 帶水劑用量對酯化率的影響
帶水劑作為酯化反應的重要因素,對酯化率也有重要的影響作用。帶水劑的不同用量對酯化率的影響如圖4所示。
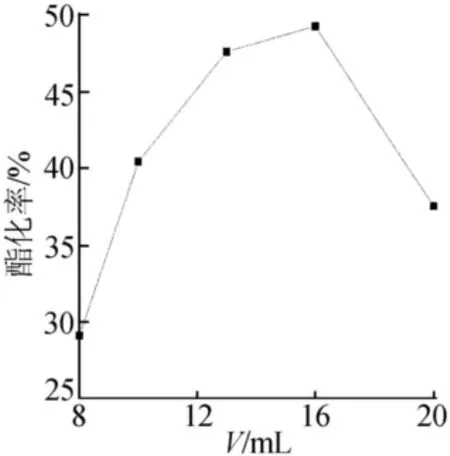
圖4 帶水劑用量對酯化率的影響
由圖4可知,帶水劑的用量對酯化率有著重要的影響。若帶水劑用量過少,反應體系產生的水無法及時脫離體系,從而使酯化平衡在正反應方向上逐漸減弱,不利于酯的生成。而若帶水劑用量過多,則會降低反應物的濃度,不利于酯化正方向反應的進行,從而造成酯化率的降低。因此適宜的帶水劑用量為16mL(15mL乳酸)。
2.6 反應時間對酯化率的影響
控制醇酸摩爾比1.3∶1(乳酸15mL),催化劑用量1.5%,反應溫度90℃,帶水劑用量16mL,研究反應時間對酯化率的影響,結果如圖5所示。
由圖5可以看出,隨著反應時間的增長,反應的進程也逐漸增大,酯化率也隨之提高。當反應時間達到2.5h時,酯化率達到最大值。繼續延長反應時間,可能有其他副產物的生成,導致酯化率下降。因此,適宜的反應時間為2.5h。

圖5 反應時間對酯化率的影響
2.7 微波輻射時間對酯化率的影響
由于微波的致熱效應可以加速有機反應速率,因此在相同的其他反應條件下,考察了微波輻射時間對酯化率的影響,如圖6所示。
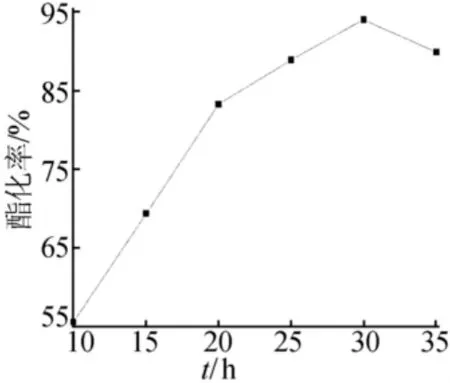
圖6 微波輻射時間對酯化率的影響
由圖6可知,微波輻射的條件不但大大縮短了反應時間,同時使酯化率出現了大幅度的提高,微波輻射時間為30min時,酯化率已達到94%。但繼續增長反應時間,酯化率反而出現下降的趨勢,可能是由于反應時間過長,造成逆反應加強、副反應增多或產品分解,從而導致酯化率降低。因此,適宜的微波輻射時間為30min。
2.8 產品分析
實驗所得產品均為無色透明液體,具有果香氣味。產品的紅外光譜圖如圖7所示。
在圖7中1 738cm-1處為C=O鍵的伸縮振動引起的強烈吸收峰,1 209cm-1處出現了C—O—C的非對稱伸縮振動,1 130cm-1處出現了C—O—C鍵的對稱伸縮振動吸收峰,以上吸收峰表明了酯鍵的生成。3 477cm-1處較寬的吸收峰為游離的—OH振動吸收峰,2 964cm-1處為C—H的伸縮振動吸收峰。產品的紅外光譜圖與乳酸正丁酯標準圖譜基本一致,說明合成的產品為目標產物乳酸正丁酯。
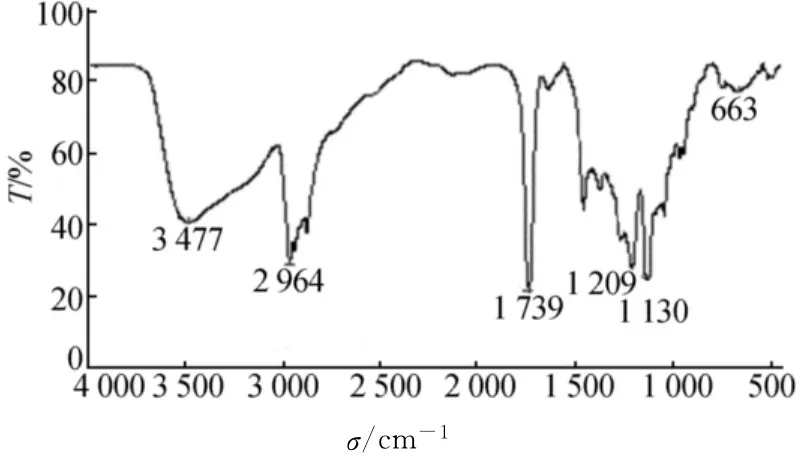
圖7 產品的紅外光譜圖
產品的氣相色譜如圖8所示。從圖8可以看出,產品的保留時間為2.932min,與標準樣乳酸正丁酯的保留時間基本一致,且色譜峰單一,樣品純度接近99%,表明反應具有較高的選擇性,沒有交酯及其他的反應副產物生成。

圖8 產品的氣相色譜圖
3 結 論
本文采用微波輻射法制備了ZrO2/固體超強酸,并測試其酸強度Ho<-13.8。用制備的固體超強酸催化劑合成乳酸正丁酯,確定酯化反應的最佳反應條件如下:正丁醇與乳酸摩爾比為1.3∶1,催化劑用量為原料總質量的1.5%,反應溫度為90℃,帶水劑用量為16mL。利用微波輻射技術可將反應時間縮短至30min,同時酯化率達到94%。紅外光譜圖和氣相色譜圖表明產品為純度較高的乳酸正丁酯。
本實驗成本低、工藝簡單、能耗低、不腐蝕設備,對環境污染極小,產品色澤好,純度高。利用微波輻射法縮短了反應時間,提高了酯化率和反應選擇性。
[1]許戈文,李布青.合成香料產品技術手冊[M].北京:中國商業出版社,1996:343-344.
[2]蘇本玉,陳 震,曹曉群.乳酸丁酯的合成分析[J].泰山醫學院學報,2007,28(4):291-292.
[3]陳丹云,郭新勇,崔紅慶.乳酸丁酯合成用催化劑進展與展望[J].河南化工,2001(9):3-6.
[4]李 莉,陳小燕,劉萬毅.用濃 H2SO4-K2Cr2O7改性煤基活性炭催化合成乙酸正丁酯[J].化學研究與應用,2008,20(6):745-747.
[5]杜迎春,吳彩金.固體酸催化劑上酯化反應研究進展[J].工業催化,2003,11(5):30-33.
[6]孟憲昌,安一平,王孟歌.納米固體超強酸/TiO2催化合成乳酸正丁酯[J].上海化工,2004,29(6):21-23.
[7]Kazushi A,Hiromi M,Makoto H,et al.Synthesis of solid superacids and their activities for reactions of alkanes[J].Catalysis Today,2003,81:17-30.
[8]Reddy B M,Patil M K,Lakshmanan P,et al.Synthesis,characterization and activity study of/CexZr1-xO2solid superacid catalyst[J].Journal of Molecular Catalysis A:Chemical,2006,244:1-7.
[9]郝文正,于少明,陸亞玲,等.改性鋁層柱粘土固體酸催化合成乙酸正丁酯[J].合肥工業大學學報:自然科學版,2005,28(4):386-388.
[10]王宇紅,董順喜,盧冠忠.不同稀土改性/ZrO2催化劑的結構與性能表征[J].無機化學學報,2007,23(4):677-682.
[11]Gedye R,Smith F,Westaway K,et al.The use of microwave ovens for rapid organic synthesis[J].Tetrahedron Letters,1986,27(3):279-282.
[12]朱學文,廖列文,崔英德.微波在化學中的應用及進展[J].精細化工,2001,18(5):295-299.
[13]徐金光,張成志.固體超強酸的合成與應用研究:Ⅰ 量熱滴定法測定超強酸的酸強度[J].淮北煤炭師范院學報,1994,15(4):49-53.
Synthesis of n-butyl acetate catalyzed by solid super-acid under microwave irradiation
NING Xiao-fei1, LI Man-fei1, WU Jie2, JIAO Qing-zhou1, CHAI Duo-li1
(1.School of Chemical Engineering,Hefei University of Technology,Hefei 230009,China;2.School of Medical Engineering,Hefei University of Technology,Hefei 230009,China)
The solid super-acid ZrO2/SO42-,which was used as catalyst for the synthesis of n-butyl acetate,was prepared via microwave irradiation.Effects of molar ratio of reactants,dosage of catalyst and water entrainer,reaction temperature and microwave radiation time on the degree of esterification were investigated.The results show that the optimum conditions for the synthesis of n-butyl acetate are as follows:molar ratio of n-butyl alcohol to lactic acid is 1.3∶1,dosage of catalyst is 1.5%(weight),water entrainer is 16mL(15mL lactic acid)and reaction temperature is 90℃.The product is n-butyl acetate with high purity.Reaction time is apparently reduced to 30min via microwave irradiation,while the yield of n-butyl acetate reaches 94%,with high reaction selectivity and purity.
microwave irradiation;solid super-acid;yield of esterification;n-butyl acetate
TQ225.241
A
1003-5060(2012)11-1550-04
10.3969/j.issn.1003-5060.2012.11.026
2012-03-28;
2012-05-22
合肥工業大學化學工程學院創新實驗大賽資助項目
寧小飛(1986-),男,河北衡水人,合肥工業大學碩士生;
柴多里(1957-),男,安徽淮南人,博士,合肥工業大學副教授,碩士生導師.
(責任編輯 閆杏麗)

