不同年生人參中8種酶活力的比較研究
王思明, 趙 雨, 張 惠, 陳 雨, 林艷玲, 連樹林
(1.長春中醫藥大學中醫藥與生物工程研發中心,吉林長春130117;2.長春中醫藥大學附屬醫院,吉林長春130117)
人參Panax ginseng C.A.Mey.為中國傳統中藥材,藥用歷史悠久。人參具有大補元氣、復脈固脫、補脾益肺、生津安神的功效[1]。人參生長年限是影響和判斷人參品質的重要因素之一。不同年生人參在藥理作用上有所差異[2]。酶是具有催化功能的蛋白,在植物生長中起著催化和調節的作用。對不同年生人參中酶活力比較可反映其生理代謝水平。氧化還原酶和水解酶為國際酶學委員會(I.E.C)規定的六大類酶中的兩類。氧化還原酶是能催化底物發生氧化還原反應的酶的總稱,其中過氧化物酶 (POD)、過氧化氫酶 (CAT)、多酚氧化酶 (PPO)[3]和抗壞血酸過氧化物酶 (APX)是植物有氧呼吸作用三羧酸循環末端氧化系統中的關鍵酶,與活性氧代謝有關。水解酶是催化底物發生水解反應的酶的總稱,淀粉酶 (AMY)、酯酶(EST)、酸性磷酸酯酶 (ACP)和堿性磷酸酯酶(ALP)分別參與植物的糖代謝、脂類代謝和磷代謝等。本實驗對不同年生人參中該8種酶進行活力測定,為了解人參品質與生長年限的關系、確定采收期及質量鑒定提供理論依據。
1 實驗材料
1.1 材料 實驗用人參購于吉林省撫松縣,經長春中醫藥大學中藥鑒定教研室姜大成教授鑒定,均為五加科植物Panax ginseng C.A.Mey.,符合中國藥典2010年版一部的規定。
1.2 儀器與試劑
1.2.1 儀器 UV—2550紫外分光光度計 (日本島津公司);AL204型電子天平 (上海梅特勒-托利多儀器有限公司);5804 R冷凍型臺式高速離心機(德國艾本德公司);DS2l型高速組織搗碎機 (上海標本模型廠)。
1.2.2 試劑 過氧化氫 (北京化工廠);焦兒茶酚 (天津市光復精細化工研究所);抗壞血酸 (北京鼎國生物技術有限責任公司);愈創木酚 (天津市光復精細化工研究所);3,5-二硝基水楊酸(DNS)(國藥集團化學試劑有限公司);酒石酸鉀鈉 (天津市光復科技發展有限公司);固藍B鹽(長春鼎國生物有限公司);乙酸-α-萘酯 (國藥集團化學試劑有限公司);α-萘酚 (國藥集團化學試劑有限公司);對硝基苯磷酸二鈉 (PNPP)(上海晶純試劑有限公司)。所用試劑均為分析純。
2 方法
2.1 樣品制備 將樣品洗凈后以料液比1∶4在已預冷的磷酸二氫鈉和磷酸氫二鈉緩沖液(pH7.4)中研磨,4℃浸提20 min后過濾,濾液以10000 r/min離心20 min后所得上清液即為粗酶液,于4℃保存備用。
2.2 過氧化物酶 (POD)活力測定[4]取磷酸鹽緩沖液150 mL,愈創木酚84 mL,加熱溶解,待冷卻后加入30%H2O257 μL,混合均勻后37℃預熱。取出3 mL混合液加入1 mL酶液,在470 nm處測定POD第0、1、2 min時的吸光度。POD活力以單位時間內 (1 min)每克樣品使A470變化0.01為1個酶活力單位。
2.3 過氧化氫酶 (CAT)活力測定[5]取酶液0.2 mL,磷酸緩沖液1.5 mL,蒸餾水1 mL,于37℃水浴預熱10 min后加入0.1 mol/L的H2O20.3 mL,在240 nm處測定CAT第0、1、2 min時的吸光度。CAT活力以單位時間內 (1 min)每克樣品使A240減少0.1為1個酶活力單位。
2.4 多酚氧化酶 (PPO)活力測定[6]取緩沖液1.5 mL,加入焦兒茶酚溶液1 mL,在37℃水浴鍋中預熱10 min,再加入0.5 mL酶液,于525 nm處測定PPO第0、30、60 s時的吸光度。PPO活力以單位時間內 (1 min)每克樣品使A525變化0.01為1個酶活力單位。
2.5 抗壞血酸過氧化物酶 (APX)活力測定[6]分別取水浴預熱10 min后的緩沖液2 mL,1.8 mmol/L AsA 0.5 mL,酶液0.1mL,0.36 mmol/L H2O20.5 mL,在290 nm處測定APX第0、1、2 min時的吸光度。APX活力以單位時間內 (1 min)每克樣品反應產生1 μmol AsA為1個酶活力單位。
2.6 淀粉酶 (AMY)活力測定[7]取酶液1 mL,加入1%淀粉溶液l mL于40℃水浴預熱5 min,加入DNS 2 mL,在沸水浴中加熱5 min,迅速冷卻后加蒸餾水定容至20 mL,以第一次水浴前加入DNS試劑作為對照,在540 nm處測定AMY的吸光度。根據麥芽糖標準曲線查出相應吸光度的麥芽糖含有量。AMY活力以單位時間內 (1 min)每克樣品催化反應所得1 mg麥芽糖為1個酶活力單位。
2.7 酯酶 (EST)活力測定[8]將0.1moL pH6.5的磷酸緩沖溶液1 mL,酶液1 mL,蒸餾水1 mL混合為 A液。將 1.25 mol/L乙酸-α-萘酯溶液0.1 mL,0.25 mol/L的固藍B鹽溶液0.9 mL混合為B液。將A液與B液分別于40℃恒溫水浴下保溫10 min,取出后即刻混勻,在524 nm處測定EST第0、1、2、3 min時的吸光度。根據α-萘酚標準曲線查出相應吸光度的α-萘酚含有量。EST活力以單位時間 (1 min)內每克樣品與底物反應所得1 μg的α-萘酚為1個酶活力單位。
2.8 酸性磷酸酯酶 (ACP)活力測定[9]取PNPP 0.5 mL,乙酸緩沖液2.3 mL在37℃預熱10 min,加入酶液0.2 mL,37℃準確保溫10 min,加入NaOH 2 mL終止酶反應,以先加入NaOH后再加酶液作為空白,在405 nm處測吸光度。根據對硝基酚標準曲線查出相應吸光度的對硝基酚含有量。ACP活力以單位時間內 (1 min)每克樣品反應產生1 nmol對硝基酚為1個酶活力單位。
2.9 堿性磷酸酯酶 (ALP)活力測定[10]取PNPP 0.5 mL,碳酸緩沖液1.5 mL在37℃預熱10 min,加入酶液0.5 mL,37℃準確保溫5 min,加入NaOH 1 mL終止酶反應,以先加入NaOH后再加酶液作為空白,在405 nm處測吸光度。根據對硝基酚標準曲線查出相應吸光度的對硝基酚含有量。ALP活力以單位時間內 (1 min)每克樣品反應產生1 μmol對硝基酚為1個酶活力單位。
3 結果
實驗結果如表1,可看出4年生人參的8種酶活力均低于5、6、7年生人參。
表1 4、5、6、7年生人參8種酶活力值 (±s,n=3)Tab.1 Eight kinds of enzyme activity in 4,5,6,7 years old ginseng(x ±s,n=3)
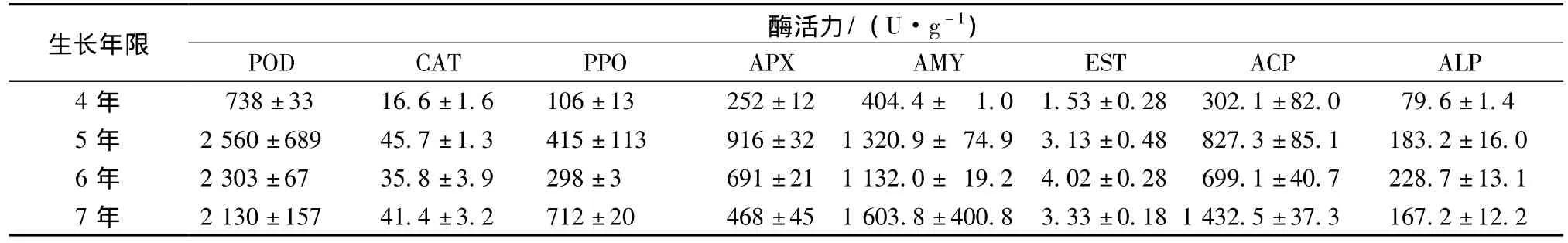
表1 4、5、6、7年生人參8種酶活力值 (±s,n=3)Tab.1 Eight kinds of enzyme activity in 4,5,6,7 years old ginseng(x ±s,n=3)
生長年限酶活力/(U·g-1)POD CAT PPO APX AMY EST ACP ALP 4年 738±33 16.6±1.6 106±13 252±12 404.4± 1.0 1.53±0.28 302.1±82.0 79.6±1.45年 2560±689 45.7±1.3 415±113 916±32 1320.9± 74.9 3.13±0.48 827.3±85.1 183.2±16.06年 2303±67 35.8±3.9 298±3 691±21 1132.0± 19.2 4.02±0.28 699.1±40.7 228.7±13.17年 2130±157 41.4±3.2 712±20 468±45 1603.8±400.8 3.33±0.181432.5±37.3 167.2±12.2
不同年生人參POD、APX活力由大到小為5年﹥6年﹥7年﹥4年 (如圖1);PPO、AMY、ACP活力由大到小為7年﹥5年﹥6年﹥4年 (如圖3、4);CAT、ALP、EST活力大小順序各不相同,如圖2、5、6。

圖1 不同年生POD、APX活力Fig.1 POD and APX activity

圖2 不同年生CAT活力Fig.2 CAT activity
5年生人參以POD、CAT和APX活力最高,分別約是活力最低年生人參的3.47、2.75、3.63倍;6年生人參以ALP、EST活力最高,分別約是活力最低年生人參的2.87、2.63倍;7年生人參以PPO、AMY和ACP活力最高,分別約是活力最低年生人參的6.72、3.97、4.74倍。其中,7年生人參的PPO、ACP活力明顯高于其它年生人參。
4 討論

圖3 不同年生PPO活力Fig.3 PPO activity

圖4 不同年生AMY、ACP活力Fig.4 AMY and ACP activity

圖5 不同年生ALP活力Fig.5 ALP activity
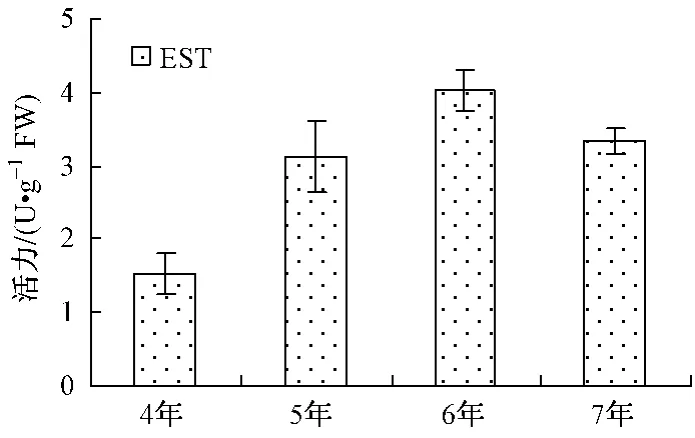
圖6 不同年生EST活力Fig.6 E-ST activity
人參為多年生草本植物,通常3年開花,5~6年結果,不同年生的人參其生長發育規律存在差別。Soldati等[11]對生長在日本和朝鮮的1~6年人參100多個樣品分析,發現人參皂苷的含有量隨生長年限的增長而不斷升高,第5年夏末趨于穩定。肖新月[12]等對不同生長年限的人參中8種主要皂苷成分的分析研究表明,隨著生長年限增加,2~6年的全須參 (園參)中 Rg、Re、Rb、Rf、Rh、Rc含有量有所增加,可將5年生長期看作是園參有效物質積累到高限的轉折點。
本實驗從酶學角度觀察了人參生長發育的特點,發現4年生人參中8種酶活力均小于5、6、7年生人參,說明4年生人參的總體代謝水平低于5、6、7年生人參,處于形態建成快速生長期,從5年開始,生長規律發生變化,人參中代謝水平趨于穩定,可將5年生長期看作是人參生長的轉折點。這與其它研究的觀點相符合,也說明人參采收以5、6年生人參為主是有一定科學依據的。
POD、CAT和APX都是植物抗氧化系統的關鍵酶,參與植物的活性氧代謝,在對維護植物活性氧代謝平衡,保護其免受氧化毒害方面起到重要作用。5年生人參中該3種酶活力高,說明其活性氧代謝水平高,植物呼吸作用強,也說明5年生人參處于同化作用的高峰期。7年生人參中PPO活力較6年生人參活力顯著升高,可能與底物濃度變化有關。ACP與ALP是非特異性磷酸水解酶,可作用于多種底物,與植物中磷的代謝密切相關。7年生人參ACP活力的顯著升高和ALP活力的顯著下降說明磷代謝途徑發生變化。EST是催化酯類化合物水解的酶系,可以在水分子的參與下,將脂肪酸酯切割成酸類與醇類,從而為植物合成其它營養物質提供中間產物。6年生人參的EST酶活力高于4、5、7年生人參,說明它的酯類化合物分解代謝快,也就是說明6年生人參的營養儲存形式發生了變化。
[1]幺寶金,趙 雨,楊世慧,等.人參總蛋白的提取工藝研究[J].中藥材,2009,32(2):293-295.
[2]彭明勇,李 艷.人參不同生長年限的藥理作用的比較[J].中外醫療,2008,28:72,78.
[3]彭世清.植物多酚氧化酶的研究進展[J].熱帶農業科學,2000,85(3):61-65.
[4] 張志安.植物生理學實驗指導[M].北京:中國農業科學技術出版社,2004.143-145.
[5]楊蘭芳,龐 靜,彭小蘭,等.紫外分光光度法測定植物過氧化氫酶活性[J].現代農業科技,2009,20:364-366.
[6] 范淑琴,梁淑文.現代植物生理學實驗指南[M].北京:科學出版社,1999.316-318.
[7] 郝建軍,康宗利,于 洋.植物生理學實驗技術[M].北京:化學工業出版社,2007:104-106.
[8]侯明迪.植物酯酶法快速測定有機磷農藥殘留的研究[J].食品科學,2002,23(7):111-115.
[9] 王 琰.生物化學和臨床生物化學檢驗[M].北京:清華大學出版社,2005:151-153.
[10]俞建英.生物化學實驗技術[M].北京:化學工業出版社,2005:255-258.
[11]Soldati F,Tanaka O.Panax ginseng:relation between age of plant and content of ginsenosides[J].J Planta Med,1984,51(4):35l
[12]肖新月,尹繼飛,張南平.不同生長年限的人參中8種主要皂苷成分的分析研究[J].藥物分析雜志,2004,24(3):238-244.

