以葡萄糖和木糖為雙底物生物合成乙偶姻的條件優化
張燎原,洪欲強,陳 雙,胡開輝
(福建農林大學生命科學學院,福建 福州 350002)
乙偶姻(Acetoin, AC)又名3-羥基丁酮,廣泛存在于玉米、葡萄、可可、蘋果、香蕉、麥芽、動物組織中,也是多種微生物糖代謝的中間產物[1]。因其具有令人愉快的奶油香味,主要用于奶油、乳品、酸奶和草莓型等香料的生產,我國GB 2760-1986規定允許食用[2]。此外,乙偶姻還可以作為一種C4平臺化合物,廣泛應用于眾多行業,2004年美國能源部將其列為30種優先開發利用的平臺化合物之一[3]。
乙偶姻的合成方法有微生物法和化學法,與化學法相比,微生物法因原料可再生、反應條件溫和、環境友好等優點而備受關注[4,5]。自然界中有許多微生物能夠合成乙偶姻,主要包括克雷伯氏菌屬(Klebsiella)、腸桿菌屬(Enterobacter)、芽孢桿菌屬(Bacillus)、沙雷氏菌屬(Serratia)以及乳球菌屬(Lactococcus)等[6~9]。其中芽孢桿菌屬因安全及產量高被學者們廣泛研究,如Bacillussubtilis、Bacilluslicheniformis、Paenibacilluspolymyxa等[10~12],這些菌株雖然在產量上已獲得提高,但因成本高仍然難以實現工業化生產。目前報道的乙偶姻生產菌基本都是以葡萄糖為碳源,因此,尋找更廉價的生產原料及篩選能高效利用這些廉價原料的菌株具有重要意義。
作者在此篩選到一株能利用木糖和葡萄糖作為雙底物產乙偶姻的多粘芽孢桿菌,并對該菌株產乙偶姻的培養條件和培養基組分進行了優化,以期獲得高產量的乙偶姻。
1 實驗
1.1 培養基
篩選培養基(g·L-1):木糖 20,NaCl 0.5,MgSO40.5,(NH4)2SO42,KH2PO40.5,瓊脂粉20,pH 值7.0。
LB培養基(g·L-1):蛋白胨 10,酵母粉 5,NaCl 10,pH 值7.0。
種子培養基(g·L-1):葡萄糖10,酵母粉1,蛋白胨2,(NH4)2SO46,KH2PO410,NaCl 0.5,MgSO40.5,pH 值7.0。
初始發酵培養基(g·L-1):葡萄糖40,木糖20,蛋白胨5,酵母粉10,KH2PO40.5,pH 值7.2。
1.2 菌株篩選
采集福建農林大學中華植物園土壤。稱取1 g土壤溶于50 mL無菌水中,漩渦振蕩5 min,80 ℃水浴中靜置30 min以獲得菌株,梯度稀釋,涂布到固體篩選培養基中37 ℃培養48 h,挑單菌落于種子培養基中37 ℃培養12 h。保藏菌種,同時分別轉接至裝有20 mL初始發酵培養基的250 mL三角瓶中,37 ℃、150 r·min-1下發酵24 h,取樣,通過VP(Voges-Proskauer)實驗定性分析單菌落是否產乙偶姻,對產乙偶姻的樣品采用氣相色譜進行定量分析,確定乙偶姻產量最高的菌株。
1.3 菌株16S rDNA鑒定
將乙偶姻產量最高的菌株接種至LB液體培養基中,于37 ℃搖床培養12 h,離心收集菌體,采用基因組提取試劑盒(百泰克生物技術有限公司)提取基因組DNA。
以基因組DNA為模板,采用通用引物(16S1:AGAGTTTGATCCTGGCTCAG和16S2:AAGGAGGTGATCCAGCCGCA)進行PCR擴增反應,反應體系為:模板DNA 2.0 μL,10×PCR buffer (含20 mmol·L-1MgCl2) 5 μL,DNA聚合酶(5 U·μL-1) 1.0 μL,dNTPs(10 mmol·L-1) 1.0 μL,引物(10 mmol·L-1)各2 μL,ddH2O 37.0 μL,總體積為50 μL。反應條件為:94 ℃預變性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1.5 min,30個循環;72 ℃ 10 min。
PCR產物經回收后進行商業測序,測序結果在NCBI數據庫中進行Blast比對,并結合生理生化特征鑒定菌株。
1.4 培養條件優化
以初始發酵培養基為基礎發酵培養基,在轉速為150 r·min-1的條件下,分別對培養溫度、pH值、裝液量和接種量(體積比,下同)進行優化(培養溫度分別控制在28 ℃、30 ℃、34 ℃、37 ℃、40 ℃;培養基pH值分別控制在5.0、6.0、7.0、8.0、9.0;裝液量分別為在250 mL三角瓶中裝10 mL、15 mL、20 mL、25 mL、30 mL;接種量分別控制在1%、3%、5%、7%、9%),發酵時間為24 h,取樣離心,取上清液-20 ℃保存待測。
1.5 培養基組分優化
綜合已報道對乙偶姻生物合成影響較大的培養基組分,選擇葡萄糖-木糖(2∶1,質量比)、蛋白胨、酵母粉、MnSO4、FeSO4、KH2PO4和乙酸鈉等7個組分進行PB(Plackett-Burman)實驗,從中篩選對乙偶姻合成具有顯著影響的組分,在此基礎上,采用響應面法(RSM)確定具有顯著影響組分的最佳濃度,培養基組分優化發酵時間為48 h。
1.6 分析與檢測
菌體濃度:以發酵液在600 nm波長下的吸光度OD600來表征。
發酵液中葡萄糖和木糖濃度:取上清液適度稀釋,采用葡萄糖檢測試劑盒(上海捷門生物技術公司)檢測葡萄糖濃度,采用地衣酚法測定木糖濃度[13]。
乙偶姻濃度:采用Aglient GC9860型氣相色譜儀測定。色譜柱采用毛細管柱DB-5,采用FID氫火焰檢測器,氮氣作為載氣,流速為1 mL·min-1,柱溫為50 ℃保留1.5 min,然后25 ℃·min-1程序升溫到180 ℃保留10 min,進樣口溫度為215 ℃,檢測器溫度為245 ℃。上清液用乙酸乙酯萃取,進樣,最后根據標準曲線計算乙偶姻濃度[14]。
2 結果與討論
2.1 菌株篩選
固體篩選培養基平板中長出15個單菌落,挑取單菌落接種至初始發酵培養基中培養后,經VP實驗驗證共有10株菌呈陽性,表明從土壤中篩選到10株產乙偶姻的菌株。采用氣相色譜對10株乙偶姻產生菌進行定量分析,結果如圖1所示。
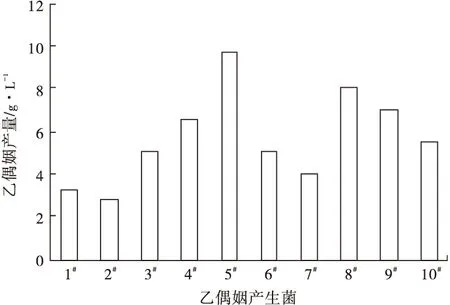
圖1 乙偶姻產生菌產乙偶姻比較
從圖1可以看出,菌株5#乙偶姻產量最高,為9.69 g·L-1。因此,采用該菌株進行后續的培養條件和培養基組分優化研究。
2.2 16S rDNA分子鑒定(圖2)
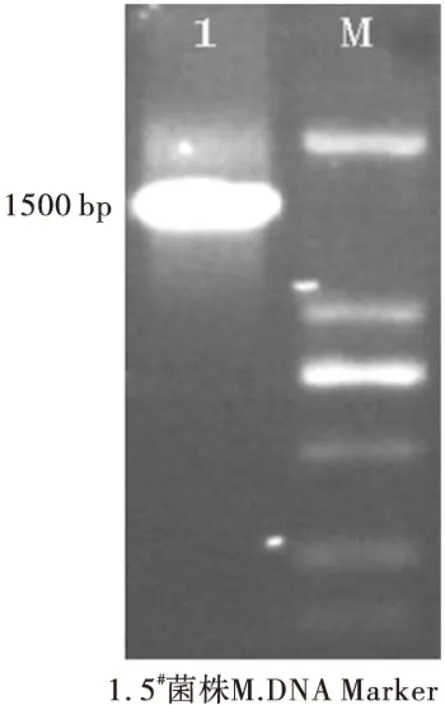
圖2 5#菌株的16S rDNA分子鑒定
從圖2可以看出,5#菌株經通用引物擴增和瓊脂糖凝膠電泳,在約1500 bp的位置出現了清晰的條帶。切膠回收進行商業測序,測序結果顯示該條帶大小為1461 bp,提交NCBI數據庫進行Blast序列比對,與多粘芽孢桿菌同源性為99%,結合菌落形態和生理生化特征鑒定,確定5#菌株為多粘芽孢桿菌(Paenibacilluspolymyxa),命名為LY107。
2.3 發酵條件的優化
通過單因素實驗分別考察培養溫度、pH值、裝液量和接種量對LY107產乙偶姻的影響,結果如圖3所示。

圖3 LY107發酵條件單因素實驗優化
從圖3可以看出,培養溫度和pH值對菌株LY107產乙偶姻有顯著的影響,培養溫度為37 ℃、pH值為7.0時的乙偶姻產量最高,因此確定LY107產乙偶姻的最適培養溫度和pH值分別為37 ℃和7.0;裝液量和接種量對LY107產乙偶姻的影響相對較小,其中裝液量的影響主要在于影響氧氣的供應,氧氣供應過多將導致糖酵解產生的丙酮酸流向TCA循環,而氧氣供應不足會使產生的乙偶姻進一步轉化為2,3-丁二醇,裝液量為15 mL時的乙偶姻產量最高,因此,確定最適裝液量為250 mL三角瓶中裝液15 mL;乙偶姻產量隨著接種量的增大而增加,但接種量達到5%后,乙偶姻的產量變化不大,因此,確定最適接種量為5%。
2.4 發酵培養基的優化
PB實驗被用于篩選對乙偶姻產量具有顯著影響的因子,PB實驗設計見表1,結果見表2。
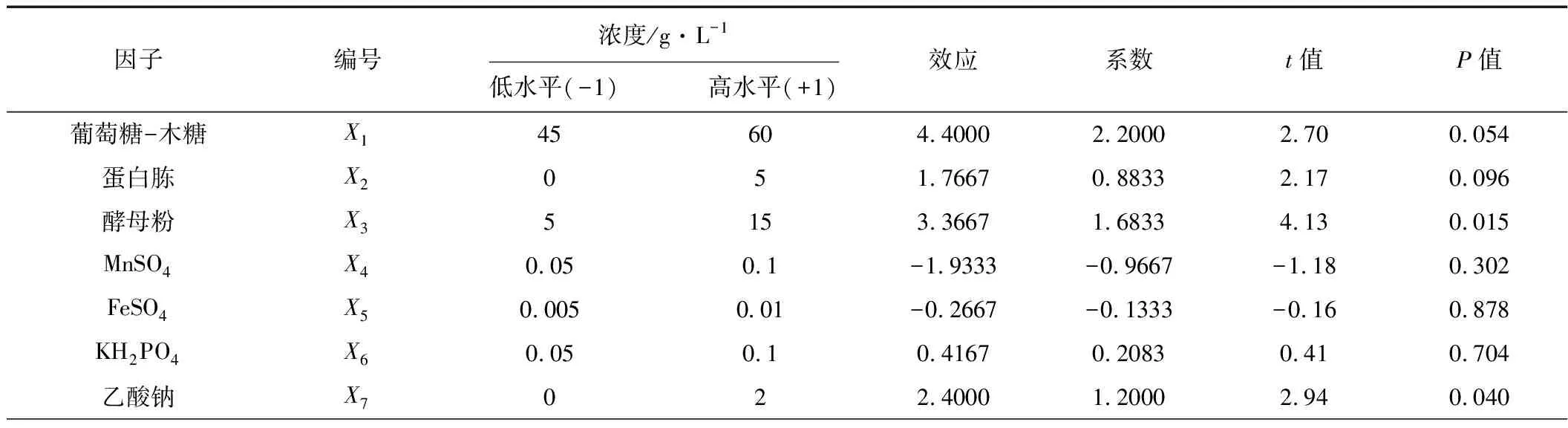
表1 PB設計篩選培養基組分
注:R2=90.75%
從表1的P值(P<0.05)可知,酵母粉和乙酸鈉對乙偶姻的合成具有顯著影響,酵母粉在氮源和微量元素的提供上有利于乙偶姻的合成,乙酸鈉被認為是乙偶姻操縱子轉錄表達的誘導劑;其次是碳源葡萄糖-木糖和蛋白胨;而從t值可知,MnSO4和FeSO4呈負效應,其余組分都是正效應,即促進乙偶姻生成,因此,最終確定葡萄糖-木糖、蛋白胨和KH2PO4取高水平,MnSO4和FeSO4取低水平,而酵母粉和乙酸鈉的濃度則需要通過RSM進一步確定。

表2 PB設計實驗結果
從表2可以看出,不同組分濃度的組合導致乙偶姻產量從9.4 g·L-1至19.1 g·L-1顯著變化,說明培養基組分對乙偶姻的合成有較大的影響。
根據PB設計分析結果,影響乙偶姻產量的2個重要影響因素為酵母粉和乙酸鈉。采用MINITAB15.0軟件中心復合方法,酵母粉和乙酸鈉(分別編號為X3、X7)的中心點分別取15 g·L-1和2 g·L-1,設計2因素5水平響應面實驗,其余培養基組分(g·L-1)為:葡萄糖-木糖(2∶1)60,蛋白胨5,MnSO40.05,FeSO40.005 ,KH2PO40.1,實驗設計及結果見表3,響應面模型分析見表4。

根據回歸方程,利用MINITAB15.0軟件繪制響應面及其等高線,如圖4所示。
從圖4可以看出,兩因素之間交互作用不顯著,最佳點落在實驗考察的區域內。
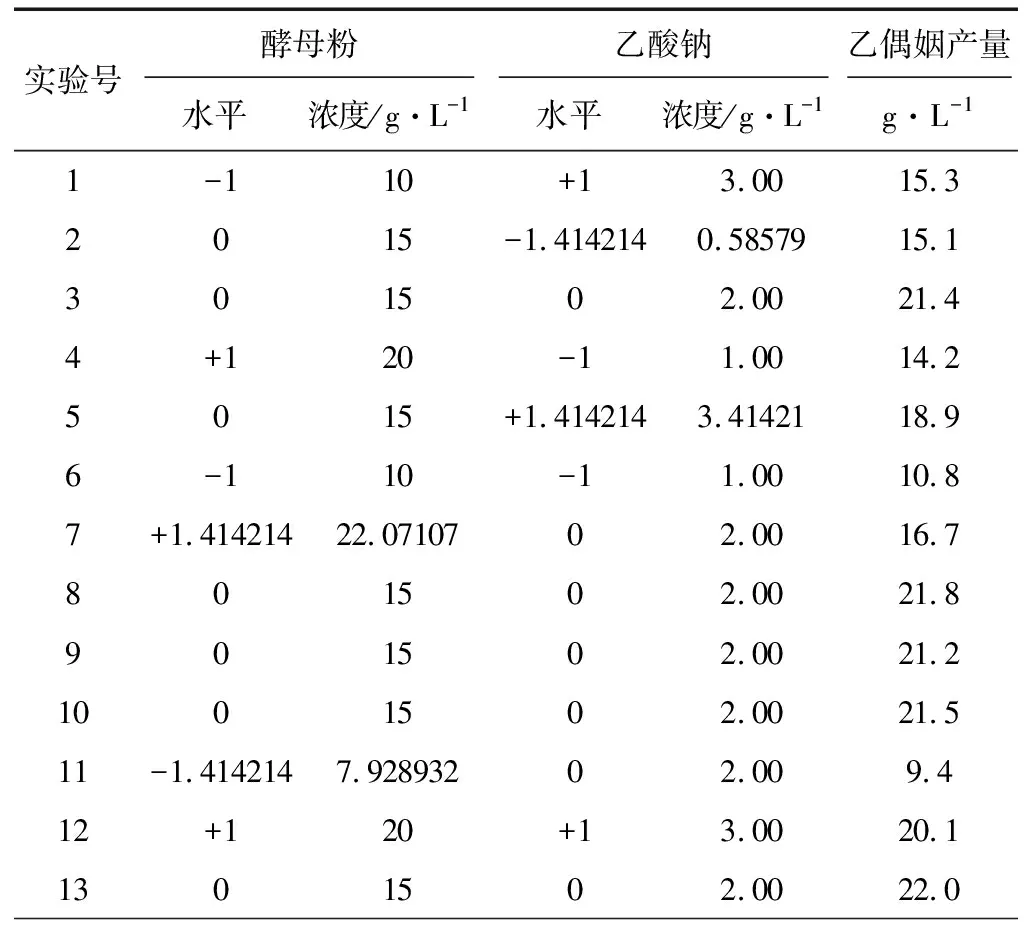
表3 中心復合實驗設計及實驗結果
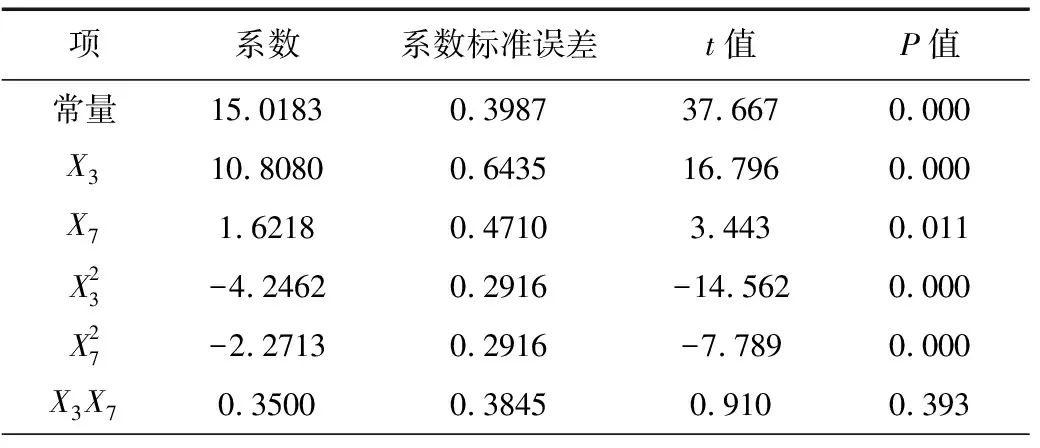
表4 響應面模型分析
通過MINITAB15.0軟件中“響應優化器”進行尋優,得到優化結果為:酵母粉16.5 g·L-1、乙酸鈉2.47 g·L-1,乙偶姻的預測值為22.38 g·L-1。最終確定優化培養基組分(g·L-1)為:葡萄糖-木糖60,蛋白胨5,酵母粉16.5,MnSO40.05,FeSO40.005,KH2PO40.1,乙酸鈉2.47。
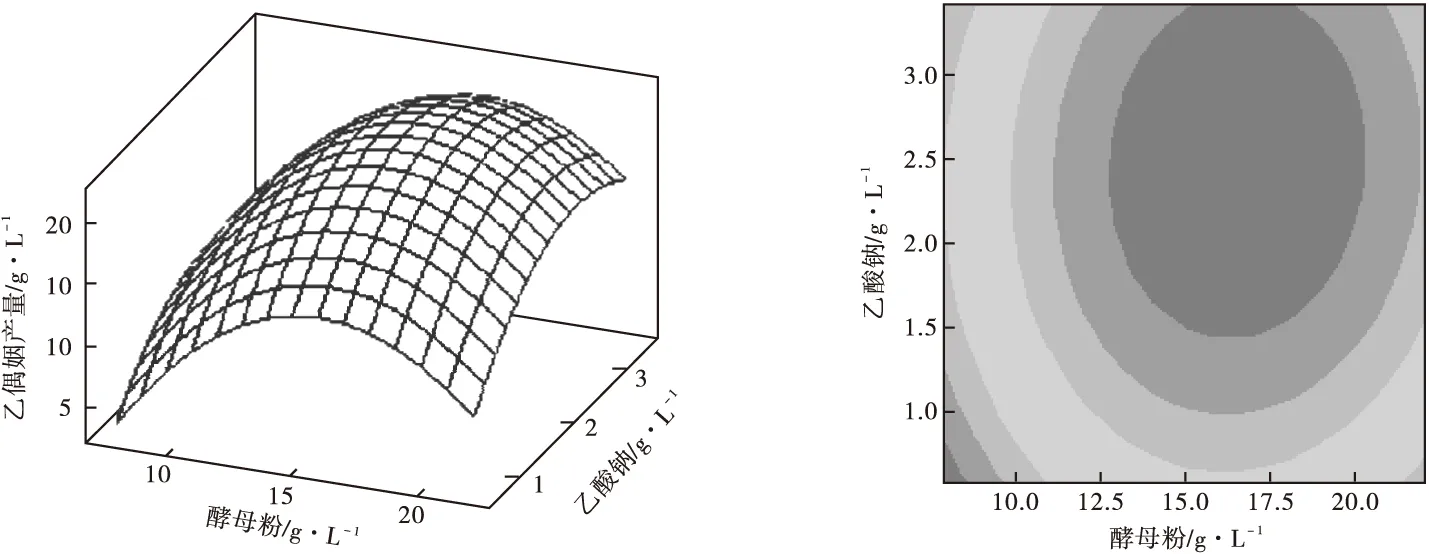
圖4 響應面曲面圖和等值線圖分析
2.5 驗證實驗
采用優化后的發酵條件和發酵培養基組分在搖瓶中進行驗證實驗,結果如圖5所示。

圖5 多粘芽孢桿菌LY107產乙偶姻過程
從圖5可以看出,從生長來看,發酵過程中細胞經歷短暫的延滯期后快速進入對數期,24 h后菌體密度(OD600)達到最大值15.66;糖耗曲線表明多粘芽孢桿菌LY107首先利用速效碳源葡萄糖,在18 h葡萄糖快利用完時才開始利用木糖,說明發酵過程中存在葡萄糖效應;采用優化發酵條件和發酵培養基的乙偶姻最高產量為23.9 g·L-1,與預測值22.38 g·L-1接近,葡萄糖-木糖轉化率為79.9%,基本驗證了模型的可靠性。
3 結論
篩選到一株可以利用木糖產乙偶姻的菌株,經16S rDNA和生理生化鑒定為多粘芽孢桿菌,命名為LY107。以葡萄糖-木糖(2∶1,質量比)為碳源模擬木質纖維素水解液發酵產乙偶姻,經單因素實驗優化培養條件為:培養溫度37 ℃、pH值7.0、裝液量為15 mL/250 mL、接種量5%(體積比)。經Plackett-Burman實驗和RSM優化培養基組分(g·L-1)為:葡萄糖-木糖60,蛋白胨5,酵母粉16.5,MnSO40.05,FeSO40.005,KH2PO40.1,乙酸鈉2.47。在優化培養條件和培養基組分下,乙偶姻的最高產量為23.9 g·L-1、葡萄糖-木糖轉化率為79.9%。
[1] 任瀟,馬小琛,聶志奎,等.枯草芽孢桿菌發酵產3-羥基丁酮的條件優化[J].食品科技,2010,35(8):13-17.
[2] 韓麗,趙祥穎,劉建軍.3-羥基丁酮的研究概況及進展[J].山東食品發酵,2006,(3):34-37.
[3] 紀曉俊,黃和,杜軍.3-羥基丁酮的合成以及應用進展[J].現代化工,2008,28(4):18-22.
[4] 任瀟,紀曉俊,孫世聞,等.肌酸比色法快速測定發酵液中3-羥基丁酮的含量[J].食品科技,2009,34(8):260-263.
[5] Zhang X, Yang T W, Lin Q, et al. Isolation and identification of an acetoin high production bacterium that can reverse transform 2,3-butanediol to acetoin at the decline phase of fermentation[J].World J Microbiol Biotechnol, doi:10.1007/s11274-011-0754-y.
[6] Yu E K , Saddler J N. Fed-batch approach to production of 2,3-butanediol byKlebsiellapneumoniaegrown on high substrate concentration[J].Appl Environ Microbial,1983,46(3):630-635.
[7] Zeng A P, Biebl H, Deckwer W D. Production of 2,3-butanediol in a membrane bioreactor with cell recycle[J].Appl Microbial Biotechnol,1991,34(4):463-468.
[8] Dettwiler B, Dunn I J, Heinzle E, et al. A simulation model for the continuous production of acetoin and butanediol usingBacillussubtiliswith integrated pervaporation separation[J].Biotechnol Bioeng,1993,41(8):791-800.
[9] Bassit N, Boquien C Y, Picque D, et al. Effect of initial oxygen concentration on diacetyl and acetoin production byLactococcuslactissubsp.Lactisbiovar diacetylactis[J].Appl Environ Microbiol,1993,59(6):1893-1897.
[10] Xiao Z J, Liu P H, Qin J Y, et al. Statistical optimization of medium components for enhanced acetoin production from molasses and soybean meal hydrolysate[J].Appl Microbiol Biotechnol,2007,74(1):61-68.
[11] Nakashimada Y, Kanai K, Nishio N. Optimization of dilution rate pH and oxygen supply on optical purity of 2,3-butanediol produced byPaenibacilluspolymyxain chemostat culture[J].Biotechnol Lett,1998,20(12):1133-1138.
[12] Liu Y F, Zhang S L, Yong Y C, et al. Efficient production of acetoin by the newly isolatedBacilluslicheniformisstrain MEL09[J].Process Biochem,2011,46(1):390-394.
[13] 張翠英,肖冬光,韓寧寧,等.木糖發酵高產2,3-丁二醇菌株的選育[J].食品研究與開發,2011,32(9):168-170.
[14] Zhang L Y, Shen Y L, Wei D Z, et al. Microbial production of 2,3-butanediol by a mutagenized strain ofSerratiamarcescensH30[J].Bioresource Technol,2010,101(6):1961-1967.

