4T42肽腺病毒載體的構建包裝及抗SKBR3乳腺癌細胞的效果
祁冬冬 陳英利 郭建壯 朱貴明 張 濤 姜 爽 王宇卓
(佳木斯大學基礎醫學院生化與分子生物教研室,黑龍江 佳木斯 154000)
與傳統的腫瘤治療方法相比,抑制新生血管生成療法作用于遺傳穩定不易變異的血管內皮細胞,不易產生耐藥性;而且內源性血管生成抑制因子具有抑制瘤床內皮細胞增殖的高度選擇性〔1〕,因而成為腫瘤治療的一個新策略。腫瘤抑素(Tumstatin)是近年發現的一種活性最強的內源性腫瘤血管生成抑制因子,可抑制血管內皮細胞蛋白的合成,誘導內皮細胞凋亡,進而抑制血管生成;同時還可以抑制腫瘤細胞增殖并促進其凋亡,從而抑制腫瘤生長,但不影響生理性血管的生成〔2〕。腫瘤抑素相關活性肽T42肽具有顯著的抗腫瘤細胞活性,可明顯抑制人肝癌細胞HepG2的生長增殖,并促進其凋亡〔3〕。本實驗通過人工合成T42肽基因,構建pAd-EGFP-T42腺病毒表達載體,并轉染Hek293細胞,觀察其對MCF-7乳腺癌細胞的凋亡和生長的影響。
1 材料與方法
1.1 細胞和主要試劑 Hek293細胞、pEC3.1(+)-EGFP質粒、DH5a 大腸桿菌;pAd-BL-Dest菌液、LR Clonase Ⅱ、Lipofectamin 2000試劑盒、氨芐青霉素、卡那霉素及蛋白酶K(Invitrogen公司);Pac I等限制性內切酶(Neb公司)、質粒中提試劑盒和DNA回收凝膠試劑盒(長沙愛科博生物科技有限公司);細胞培養用的 DMEM、胰酶、胎牛血清、細胞培養板等(Gibco 公 司)。T42 引 物:前 向:5′-ATGCCGTTCTTATTCTGCAATG-3′;反向:5′-GGAGTTTGAGTAGTAGTTGCAC -3′。EGFP引物:前向:5′-TTTGAATTCATGGTGAGCAAGGGC-3′;反向:5′-TGGCTCGAGTTACTTGTACAGCTC-3′。引物由上海 Invitrogen公司合成。
1.2 方法
1.2.1 T42基因的獲得及四倍體T42肽(4T42)的構建 人工合成 T42肽基因(序列參考文獻〔4〕),5′端加上 BamH I酶切位點,3′端加上Bgl II-EcoR I酶切位點,由南京金斯瑞生物科技有限公司完成并克隆到pUC57載體(命名為pUC57-T42)。之后分別對pUC57-T42用BamH I/EcoR I雙酶切回收T42片段和BglⅡ/EcoR I雙酶切回收載體。用T4連接酶對T42片段和載體片段進行連接,鑒定陽性克隆后重復酶切連接一次,鑒定陽性的克隆就為 pUC57-4T42。
1.2.2 pEC3.1(+)-4T42重組質粒的構建 用 BamH I和EcoR I分別雙酶切pUC57-4T42 PCR產物和pEC3.1(+)載體,回收T42片段和pEC3.1(+)載體片段,用T4 Ligase 16℃過夜連接。次日將連接產物轉化DH5-alpha感受態,挑取單菌落搖菌,提取質粒,進行雙酶切鑒定。
1.2.3 pEC3.1(+)-EGFP-4T42重組質粒的構建 通過PCR擴增EGFP片段,EcoR I和Xho I分別雙酶切 PCR產物和pEC3.1(+)-EGFP-4T42 質粒,回收后用 T4 Ligase 16℃ 過夜連接。次日將連接產物轉化DH5-alpha感受態,挑取單菌落,搖菌,提取質粒,進行EcoR I和Xho I雙酶切鑒定。
1.2.4 構建pAd-EGFP-T42質粒 通過LR體外同源重組將EGFP-4T42表達框轉移至 pAd-BL-Dest腺病毒表達載體上構建pAd-EGFP -T42 質粒。pEC3.1(+)-4T42-EGFP 3 μl,pAd-BLDest 1 μl,LR Clonase Ⅱ (Invitrogen)2 μl,補加 pH8.0 的 TE Buffer到總體積10 μl。放置到25℃水浴反應 3 h。加入1 μl蛋白酶K到上步反應體系中,37℃反應15 min。將5 μl上步反應產物轉化DH5а感受態細胞,均勻涂布于含Amp抗性(終濃度為100 μg/ml)的LB平板上,37℃恒溫箱培養過夜。從培養皿上挑取單克隆菌落接種于5 ml含 Amp抗性(終濃度為100 μg/ml)的LB培養液中,37℃,250 r/min培養過夜。用中提試劑盒提取質粒,對提取的pAd-EGFP-4T42質粒進行PCR鑒定:加入 10 倍 PCR Buffer 2.5 μl,rTaq(Takara)0.25 μl,dNTP(2.5 mmol/L)1 μl,T42 F(10 μmol/L)0.25 μl,T42R 0.25 μl,pAd-EGFP-T42 1 μl,補加 ddH2O 到總體積 25 μl。然后通過94℃ 5 min;94℃ 30 s,56℃ 40 s,72℃ 50 s(共 30 個循環);72℃10 min延伸后進行瓊脂糖凝膠電泳鑒定條帶大小。對提取的 pAd-EGFP-4T42 質粒進行酶切鑒定:取 pAd-EGFP-4T42 2 μl,Pac I Buffer 2 μl,Pac I 1 μl,補加水到 20 μl;放置到 37℃水浴3 h進行反應后,進行瓊脂糖凝膠電泳鑒定。
1.2.5 pAd-EGFP-4T42轉染Hek293細胞 用含10%胎牛血清、10 U/ml氨卞青霉素和10 U/ml鏈霉素的DMEM培養基,6 cm細胞培養板,將細胞培養至密度為約50% ~70%,更換新鮮的不含血清的DMEM培養基;取4 μg重組鑒定正確的pAd-EGFP-4T42質粒用 Pac I單酶切線性化后,加入培養基至250 μl,混勻為 A;將12 μl Lipo 2000 脂質體加入238 μl培養基中,混勻為B;室溫5 min后,將A緩慢加入B中,室溫避光靜置20 min為C;慢慢將C加入細胞密度50% ~70%的Hek 293細胞培養皿中,37℃,5%CO2培養24 h后,熒光顯微鏡下觀察綠色熒光信號判斷rAd-EGFP-4T42是否包裝成功。
1.2.6 rAd-EGFP-4T42腺病毒的收集和擴增 繼續培養上步轉染成功的Hek293細胞,待出現明顯CPE,且有>50%細胞脫壁時,即可收集細胞,離心加1 ml PBS并在-80℃和37℃水浴中反復凍融3次,每次凍融后,旋轉離心管1次,以使細胞懸液充分凍融,室溫下,12 000×g離心10 min,沉淀細胞碎屑,將上清液(主要成分為病毒原液)移入新的離心管中于-80℃。
將Hek23細胞接種于6孔板上,使每孔內細胞數達到約7×105。吸去培養液,然后加入1 ml新鮮培養液,同時加入200 μl病毒原液混勻,37℃孵育2 h,再加入2 ml培養液繼續孵育。每日用熒光顯微鏡觀察情況。當有病毒產生后即按上述方法收集病毒液。
1.2.7 rAd-EGFP-4T42腺病毒的鑒定 采用 RT-PCR方法鑒定。轉染后48 h,用Trizol抽提各孔細胞的總 RNA,以 Oligo(dT)為引物合成cDNA。然后以cDNA為模板,用T42F/R上下游引物行PCR檢測。
1.2.8 rAd-EGFP-4T42病毒滴度測定(熒光顯微鏡計數) 滴度測定前,以0.5×105濃度種細胞Hek293于24孔板,每孔1 ml細胞培養基,過夜(12 h)培養使細胞在板底部形成單層,此時細胞密度大約為1.0×105;取10 μl病毒液 +90 μl培養基,依次稀釋得到10-1~10-5病毒稀釋液。24孔板依次加入梯度稀釋的待測病毒樣品20 μl,留一孔作為對照不加病毒,培養2 d;熒光計數:熒光顯微鏡下計數帶有熒光的細胞數目;計算病毒滴度:熒光細胞數目×稀釋倍數(10,102…105)/接種病毒量。
1.2.9 重組rAd-EGFP-4T42質粒轉染MCF-7乳腺癌細胞及其MTT 分析 實驗共設3 組:重組 rAd-EGFP-4T42 質粒組、rAd-EGFP對照質粒組、空白對照組。轉染前24 h取指數生長期的MCF-7乳腺癌細胞以4×105個細胞/孔分別接種到6孔板中。次日棄去原培養基,用PBS輕輕洗2遍,加入1 ml 2%FBS的培養基,并用Lipo2000轉染各組質粒到細胞中,6 h后換液并置于37℃、5%CO2培養箱中培養18 h,熒光顯微鏡下觀察轉染效果,并分別取各組細胞2×104個/孔到96孔板中。分別于12、24、36、48 h對各組細胞進行MTT實驗。并計算各時間點質粒轉染組相對于對照組的生長抑制率。
1.2.10 重組rAd-EGFP-4T42腺病毒感染SKBR3乳腺癌細胞及其流式細胞儀分析 實驗共設3組:重組腺病毒rAd-EGFP-4T42感染組、rAd-EGFP對照腺病毒感染組、空白對照組。根據文獻〔5〕的方法確定 MOI的值,將重組腺病毒 rAd-EGFP-4T42的最適MOI定為100。感染前24 h取指數生長期的SKBR3乳腺癌細胞細胞以4×105個細胞/孔,分別接種到各組的6孔板中。次日棄去原培養基,用PBS輕輕洗2遍,加入1 ml 2%FBS的培養基,并加入100 MOI重組腺病毒或rAd-EGFP對照腺病毒,置于37℃、5%CO2培養箱中培養4 h,更換為新鮮完全培養基,培養48 h后胰酶消化收集各孔細胞。
在雙變量流式細胞儀分析各組細胞,結果判斷方法如下:左下象限顯示活細胞,為(FITC-/PI-);右上象限是晚期凋亡細胞和壞死細胞,為(FITC+/PI+);而右下象限為早期凋亡細胞,呈現(FITC+/PI-),左上象限代表細胞收集過程中出現的損傷細胞(FITC-/PI+)。
1.3 統計學方法 組間比較行χ2檢驗。
2 結果
2.1 pUC57-4T42四倍體的瓊脂糖凝膠電泳結果 將提取的pUC57-2T42、pUC57-4T42 質粒用 BamH I/EcoR I雙酶切鑒定,得到大小分別為3 000、256、3 000、512 bp的片段,分別與載體和2T42(4T42)的大小相符。
2.2 pEC3.1(+)-EGFP-4T42雙酶切結果 將提取的pEC3.1(+)-EGFP-4T42 質粒用 EcoR I/Xho I雙酶切鑒定,得到大小為5 046 bp和820 bp的片段,分別與pEC3.1(+)-4T42和EGFP的大小相符,說明結果正確。
2.3 pAd-EGFP-4T42 雙酶切鑒定結果 提取 pAd-EGFP-4T42質粒用Pac I單酶切,得到大小約3 000 bp和大于15 kb的片段,說明質粒為 pAd-BL-dest,即 pAd-EGFP-4T42 完全正確。
2.4 轉染rAd-EGFP-4T42的Hek293細胞熒光顯微鏡觀察結果 通過Lipo2000介導轉染rAd-EGFP-4T42的Hek293細胞轉染24 h后,在倒置熒光顯微鏡下觀察的結果見圖1,說明轉染成功。
2.5 Hek293細胞中RT-PCR結果 瓊脂糖凝膠電泳結果顯示在128 bp處有清晰條帶。
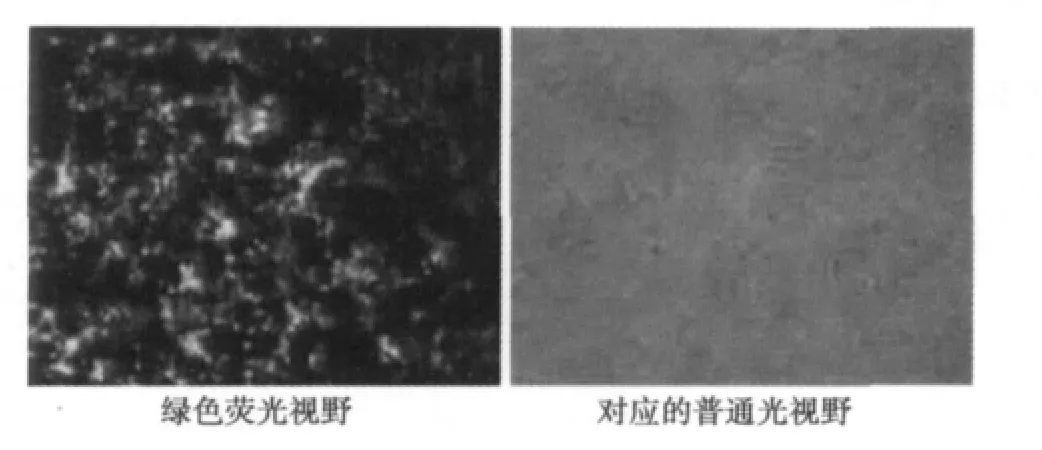
圖1 質粒rAd-EGFP-4T42轉染Hek293細胞的結果
2.6 Hek293細胞中的病毒物理滴度檢測結果 Hek293細胞中的病毒物理滴度檢測,以稀釋5次方的孔計算,每孔GFP陽性細胞共為82,則病毒滴度=4×108DRP/ml。
2.7 質粒轉染組和對照組腫瘤細胞的MTT實驗結果 見圖2。rAd-EGFP-4T42質粒轉染組與對照組相比差異顯著(P<0.05),而rAd-EGFP質粒轉染組與對照組相比差異不顯著。
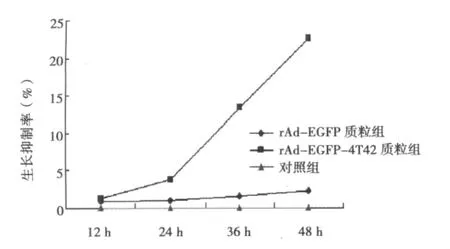
圖2 質粒轉染組與對照組相比的生長抑制率
2.8 流式細胞儀檢測SKBR3乳腺癌細胞凋亡率 空白對照組、對照腺病毒 rAd-EGFP感染組和重組腺病毒 rAd-EGFP-4T42感染組的凋亡率分別為11.6% ±2.2%、15.5% ±4.3%和38.9% ±4.4%。感染重組腺病毒rAd-EGFP-4T42的T24細胞較對照腺病毒感染細胞和未轉染空白組細胞凋亡率高,其差異有統計學意義(P<0.05)。
3 討論
從肺-腎出血綜合征(Goodpasture)自身抗原發現Tumstatin有兩個功能位點:一個是C-末端的185~203位氨基酸組成的19肽,具有直接抑制腫瘤細胞增殖〔6〕,促進腫瘤細胞凋亡的作用〔7,8〕;另一個是接近N端的54~132位氨基酸組成的78肽,即tum-5片段,具有抗血管生成作用〔9〕。進一步研究證明,抗腫瘤血管生成活性區定位于74~98位氨基酸〔10〕,被稱為T7片段。目前利用-GG-柔性Linker將19肽和T7片段這兩個最小活性片段連接重組為T42肽,使其具有抗血管活性和抗腫瘤活性雙重作用的腫瘤抑素活性肽〔3〕。本文在構建含4T42基因的腺病毒過程中,在熒光蛋白的指示下,能充分觀察到含目的基因的腺病毒基因組轉染 Hek293細胞的情況,在第7天觀察到大量Hek293細胞脫落、崩解,與文獻報道的一致〔11〕。與沒有熒光蛋白指示的轉染靠主觀判斷來決定病毒產生時間相比,充分保證了最高滴度病毒的獲取。熒光顯微鏡觀察具有綠色熒光說明EGFP片段進入Hek293細胞,RT-PCR結果說明了有4T42質粒進入Hek293細胞,培養后檢測結果顯示具有熒光說明成功包裝出腺病毒,且該腺病毒具有感染能力。rAd-EGFP-4T42腺病毒的成功構建和包裝以及功能研究的初步結果顯示,該腺病毒具有促進癌細胞凋亡的功能,且作用效果明顯。但其作用機制尚待進一步研究。
1 賀 欣,趙啟仁.腫瘤抑素T7肽及其衍生物T7-NGR載體構建及表達〔J〕. 生物醫學工程與臨床,2008;12(3):240-4.
2 Hamano Y,Zeisberg M,Sugimoto H,et al.Physiological levels of tumstatin,a fragment of collagen,alpha 3 chain,are generated by MMP-9 proteolysis and suppress angiogenesis via alpha V beta 3 integrin〔J〕.Cancer Cell,2003;3(6):589-601.
3 蘇曉杰,武風君,袁麗杰,林雪松.腫瘤抑素相關肽T42肽的純化及抗肝癌細胞Hepg2活性的測定〔J〕.吉林大學學報(醫學版),2010;36(1):86-9.
4 Li Y,Liu XH,Lin XS,et al.Inhibitory effect of tumstatin related peptide T42 on human umbilical ein endothelial cells and human gastric adenocarcinoma〔J〕.Clin Rehab Tissue Engineer Res,2007;11(10):1837-40.
5 Maeshima Y,Colorado PC,Torre A,et al.Distinct antitumor properties of type Ⅳ collagen domain derived from basement membrane〔J〕.Biol Chem,2000;275(28):21340-8.
6 Maeshima Y,Yerramalla UL,Dhanabal M,et al.Extracellular matrix derived peptide binds to alpha(v)beta(3integrin and inhibits angiogenesis〔J〕.Biol Chem,2001;276(34):31959-68.
7 Hamano Y,Kalluri R.Tumstatin the NC1 domain of alpha3 chain of typ IV collagen is an endogenous inhibit of pathological angiogenesis and sup presses tumor growth〔J〕.Biochem Biophys Res Commun,2005;333(2):292-8.
8 袁麗杰,趙恒宇,蘇曉杰.小分子肽-腫瘤抑素19肽純化及抗腫瘤活性研究〔J〕. 現代生物醫學進展,2007;7(5):674-6.
9 Maeshima Y,Sudhakar A,Lively JC,et al.Tumstatin,an endothelial cellspecific inhibitor of protein synthesis〔J〕.Science,2002;295(5552):140-3.
10 付 雪,王淑靜,林雪松.腫瘤抑素抗血管活性相關肽的表達及活性研究〔J〕. 醫學分子生物學雜志,2005;2(3):157-61.
11 He TC,Zhou SB,Luis T,et al.A simplified system for generating recombinant adenoviruses〔J〕.Pro Natl Acad Sci,1998;5(4):2509-14.

