Ki-67、P53及PCNA對(duì)腦膠質(zhì)瘤預(yù)后的影響
顧文棟 裴紅蕾
腦膠質(zhì)瘤,特別是惡性膠質(zhì)瘤(包括惡性星形細(xì)胞瘤和膠質(zhì)母細(xì)胞瘤)是成人最常見(jiàn)的原發(fā)性中樞神經(jīng)系統(tǒng)腫瘤。其預(yù)后與多種因素有關(guān),這些因素包括組織類型,病理分級(jí),發(fā)病時(shí)臨床因素(年齡、KPS評(píng)分等)以及免疫組化檢測(cè)結(jié)果等等[1]。本文回顧性分析了在我院治療的51例腦膠質(zhì)瘤患者的免疫組化檢測(cè)結(jié)果,以探討Ki-67、P53和PCNA(增殖細(xì)胞核抗原)與病理分級(jí)的關(guān)系,以及它們對(duì)腦膠質(zhì)瘤預(yù)后的影響。
1 資料與方法
1.1 一般資料 2004年3月1日至2010年3月31日在我院行手術(shù)+術(shù)后輔助性放射治療并有完整資料的腦膠質(zhì)瘤患者(有免疫組化檢測(cè)結(jié)果)共有51例,其中男28例,女23例;中位年齡46歲(17~70歲),術(shù)后病理為星形膠質(zhì)細(xì)胞瘤31例,少突膠質(zhì)細(xì)胞瘤11例,混合型少突-星形膠質(zhì)細(xì)胞瘤9例;病理分級(jí):WHOⅡ級(jí)15例,Ⅲ級(jí)18例,Ⅳ級(jí)18例,將其分成2組,低級(jí)別膠質(zhì)瘤(Ⅱ級(jí))和高級(jí)別膠質(zhì)瘤(Ⅲ+Ⅳ)。51例患者均在我院手術(shù),術(shù)后行輔助性三維適形放射治療,其中有12例患者放射治療期間同步口服替莫唑胺。
1.2 免疫組化結(jié)果判斷 免疫組化結(jié)果判斷由本院病理科醫(yī)生完成,每例患者均于400倍高倍鏡下隨機(jī)取5個(gè)視野計(jì)數(shù)500個(gè)腫瘤細(xì)胞的染色情況。①Ki-67:陽(yáng)性細(xì)胞多數(shù)為核著色,呈棕黃色。計(jì)算各高倍鏡視野內(nèi)陽(yáng)性細(xì)胞占總觀察腫瘤細(xì)胞的百分?jǐn)?shù),并取其平均值定義為該腫瘤的陽(yáng)性細(xì)胞百分比。根據(jù)陽(yáng)性細(xì)胞占全部細(xì)胞的比例將其分為:陽(yáng)性細(xì)胞數(shù)<10%為陰性(-),陽(yáng)性細(xì)胞數(shù)>10%為陽(yáng)性(+)[2]。②P53:染色亦位于腫瘤細(xì)胞核,呈棕色,凡顯色均為陽(yáng)性,不論染色強(qiáng)度。③PCNA:胞核染成棕黃色或者棕褐色的為陽(yáng)性細(xì)胞,按陽(yáng)性率分為3級(jí),弱陽(yáng)性(+):0~25%,陽(yáng)性(++):26% ~50%,強(qiáng)陽(yáng)性(+++):>50%。
1.3 統(tǒng)計(jì)學(xué)方法 采用SPSS 18.0統(tǒng)計(jì)軟件包,相關(guān)性分析采用卡方檢驗(yàn)(Fisher精確檢驗(yàn)法),生存率計(jì)算采用Kaplan-Meier法,生存率比較應(yīng)用log-rank檢驗(yàn)。
2 結(jié)果
2.1 隨訪及總體生存情況 以2011年4月1日為隨訪截止日,所有51例患者中共有1例失訪,隨訪率為98%,失訪患者以最后一次隨訪之日起按死亡計(jì)算。全組患者共有26例死亡;全組患者1、3和5年生存率分別為66.7%,50%和42.9%,中位生存時(shí)間19個(gè)月(2~77個(gè)月)。
2.2 免疫組化結(jié)果 51例患者中有34例行Ki-67檢測(cè),其中陰性12例,陽(yáng)性22例;有30例行P53檢測(cè),其中陰性13例,陽(yáng)性17例;24例行PCNA檢測(cè),其中弱陽(yáng)性9例,陽(yáng)性10例,強(qiáng)陽(yáng)性5例。
2.3 Ki-67、P53和PCNA與腫瘤病理分級(jí)的關(guān)系 由表1可見(jiàn):22例Ki-67陽(yáng)性的病例中有18例為高級(jí)別膠質(zhì)瘤,只有4例為低級(jí)別膠質(zhì)瘤,差異有統(tǒng)計(jì)學(xué)意義(P=0.008);17例P53陽(yáng)性的病例中有11例為高級(jí)別膠質(zhì)瘤,有6例為低級(jí)別膠質(zhì)瘤,差異無(wú)統(tǒng)計(jì)學(xué)意義(P=0.104);而15例PCNA陽(yáng)性(+)和強(qiáng)陽(yáng)性(++)的病例中有13例為高級(jí)別膠質(zhì)瘤,低級(jí)別膠質(zhì)瘤只占2例,但差異無(wú)統(tǒng)計(jì)學(xué)意義(P=0.061)。

表1 Ki-67、P53 和 PCNA 與腫瘤病理分級(jí)的關(guān)系
2.4 Ki-67對(duì)生存率的影響 由圖1可見(jiàn):Ki-67陰性和陽(yáng)性的患者3年生存率分別為83.3%和38.6%,差異有統(tǒng)計(jì)學(xué)意義(χ2=4.486,P=0.034)。
2.5 P53對(duì)生存率的影響 由圖2可見(jiàn):P53陰性和陽(yáng)性的患者3年生存率分別為25.6%和56.3%,差異有統(tǒng)計(jì)學(xué)意義(χ2=3.961,P=0.047)。
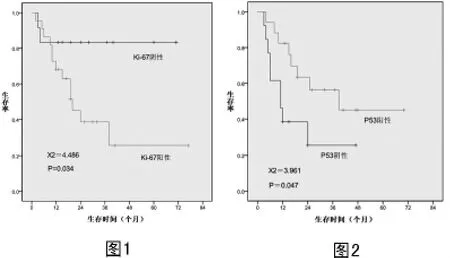
圖1 Ki-67對(duì)腦膠質(zhì)瘤生存率的影響圖2 P53對(duì)腦膠質(zhì)瘤生存率的影響
2.6 PCNA對(duì)生存率的影響 由圖3可見(jiàn):PCNA弱陽(yáng)性、陽(yáng)性和強(qiáng)陽(yáng)性組患者的3年生存率分別為77.8%、40.0%和20.0%,差異無(wú)統(tǒng)計(jì)學(xué)意義(χ2=4.54,P=0.103),但是圖3顯示PCNA陽(yáng)性組和強(qiáng)陽(yáng)性組生存率差異不大,而弱陽(yáng)性組的生存率明顯為高,且差異有統(tǒng)計(jì)學(xué)意義(圖4,χ2=4.337,P=0.0.37)。
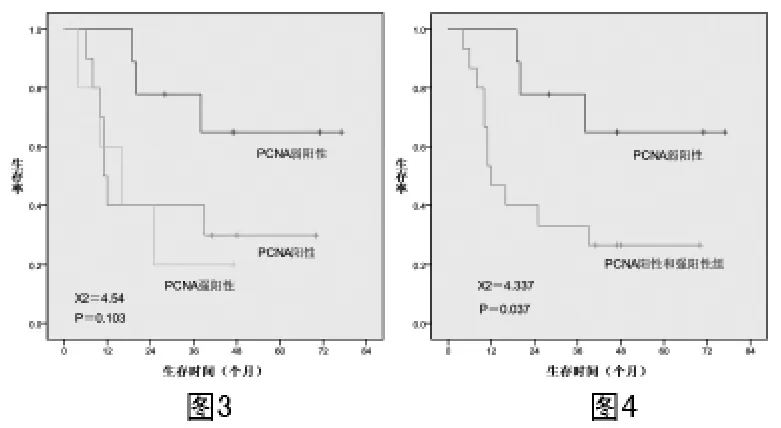
圖3 PCNA對(duì)腦膠質(zhì)瘤生存率的影響圖4 PCNA對(duì)腦膠質(zhì)瘤生存率的影響
3 討論
Ki-67是一種存在于增殖細(xì)胞中的核抗原,其免疫反應(yīng)與細(xì)胞周期密切相關(guān),在G1、S、G2、M期均有表達(dá),但G0期無(wú)表達(dá),它是目前應(yīng)用最廣泛也是檢測(cè)腫瘤細(xì)胞增殖活性最可靠的指標(biāo)之一。Ki-67是腫瘤細(xì)胞生長(zhǎng)活躍程度的標(biāo)志,也就是說(shuō)Ki-67表達(dá)越高,腫瘤細(xì)胞生長(zhǎng)越活躍,惡性程度越高。本研究結(jié)果顯示Ki-67的表達(dá)程度與膠質(zhì)瘤的分級(jí)顯著相關(guān),Rodriguez-Pereira等[3]研究亦證實(shí)了Ki-67的表達(dá)與膠質(zhì)瘤的惡性進(jìn)展密切相關(guān),可以作為反映腦膠質(zhì)瘤惡性程度的指標(biāo)。但是對(duì)于Ki-67能否作為膠質(zhì)瘤的預(yù)后指標(biāo)目前尚存在著較多的爭(zhēng)議[2]。因?yàn)镵i-67的表達(dá)程度與病理分級(jí)顯著相關(guān),而后者是膠質(zhì)瘤強(qiáng)烈的獨(dú)立預(yù)后因素,因而其可能混淆了Ki-67的影響因素。McKeever等[4]研究顯示Ki-67在單因素分析中是一項(xiàng)顯著的預(yù)后因素,但是在分層分析時(shí)發(fā)現(xiàn)低級(jí)別膠質(zhì)瘤中Ki-67的表達(dá)程度與生存率呈負(fù)相關(guān),而在高級(jí)別膠質(zhì)瘤中則不再是一個(gè)獨(dú)立的預(yù)后因素。而袁慶國(guó)等[5]分析了39例膠質(zhì)母細(xì)胞瘤患者,結(jié)果表明Ki-67陽(yáng)性率與生存時(shí)間無(wú)顯著相關(guān)性。但是無(wú)論如何Ki-67總是一個(gè)顯示腫瘤中增殖細(xì)胞所占比例的指標(biāo),Ki-67比例高,說(shuō)明腫瘤增殖迅速,手術(shù)后無(wú)進(jìn)展間隔時(shí)間較短。而眾所周知增殖迅速的腫瘤有較高的放射敏感性(雖然并不一定有較高的放射治愈性),因此對(duì)于Ki-67表達(dá)高的膠質(zhì)瘤,特別是低級(jí)別膠質(zhì)瘤,我們是否可以認(rèn)為它們可能更多從術(shù)后放療中受益[6]。
P53是一種腫瘤抑制基因,位于17p13,經(jīng)常發(fā)生點(diǎn)突變或缺失,在星形細(xì)胞瘤中的發(fā)生率為30~50%。本研究結(jié)果顯示P53陽(yáng)性率與病理分級(jí)無(wú)關(guān),說(shuō)明P53突變?cè)谀X膠質(zhì)瘤的發(fā)生發(fā)展過(guò)程中只是一種早期事件,其陽(yáng)性率并不隨病理分級(jí)的增高而增加。另外體外試驗(yàn)表明膠質(zhì)母細(xì)胞瘤中由于缺乏野生型的P53基因而對(duì)單次或分次照射呈現(xiàn)了抗拒性,從而可能導(dǎo)致放射治療的失敗而使得腫瘤復(fù)發(fā),從實(shí)驗(yàn)室角度闡述了 P53基因?qū)δz質(zhì)瘤預(yù)后的影響[7]。岳偉英等[8]研究表明P53蛋白質(zhì)分子的過(guò)表達(dá)對(duì)于腦膠質(zhì)瘤患者5年內(nèi)復(fù)發(fā)及惡性進(jìn)展有預(yù)報(bào)作用。但是Nieder等[9]綜述了28篇關(guān)于腦膠質(zhì)瘤P53基因的文獻(xiàn)報(bào)道,結(jié)果顯示有超過(guò)50%的星形膠質(zhì)細(xì)胞瘤的病理標(biāo)本免疫組化染色顯示P53陽(yáng)性,其陽(yáng)性率與組織分級(jí)無(wú)關(guān),而且對(duì)預(yù)后因素影響有限。岳偉英等認(rèn)為P53的預(yù)后指示作用在不同的研究中出入較大的原因可能與樣本中包含的肥胖型星形膠質(zhì)細(xì)胞瘤和少枝星形膠質(zhì)細(xì)胞瘤比例不同有一定關(guān)系。
增殖細(xì)胞核抗原(Proliferating Cell Nuclear Antigen,PCNA)是一種分子量為36KD的酸性非組胺核蛋白,僅在增殖細(xì)胞中合成與表達(dá)。人類PCNA基因位于第20號(hào)染色體,它是DNA復(fù)制和DNA修復(fù)所必需的輔助蛋白。在許多腫瘤中,PCNA的表達(dá)水平直接與腫瘤惡性度相關(guān)[10]。本研究結(jié)果顯示PCNA陽(yáng)性和強(qiáng)陽(yáng)性表達(dá)的大多為高級(jí)別膠質(zhì)瘤,但統(tǒng)計(jì)學(xué)差異不顯著,這可能是因?yàn)楸狙芯坎捎玫脑u(píng)判標(biāo)準(zhǔn)為半定量檢測(cè),對(duì)于PCNA弱陽(yáng)性表達(dá)的定義過(guò)寬(陽(yáng)性率0~25%定義為弱陽(yáng)性)的原因。Kirkegaard等[11]研究顯示了對(duì)于所有的星形膠質(zhì)細(xì)胞瘤來(lái)說(shuō)PCNA的中位陽(yáng)性率為24%,其中低級(jí)別膠質(zhì)瘤PCNA平均陽(yáng)性率為13.11%,間變性星形膠質(zhì)細(xì)胞瘤為29.68%,膠質(zhì)母細(xì)胞瘤為44.11%,由此可見(jiàn)本研究將陽(yáng)性率0~25%定義為弱陽(yáng)性有很大可能混淆了低級(jí)別膠質(zhì)瘤和間變性星形膠質(zhì)細(xì)胞瘤的PCNA表達(dá)。而陸曉旻等[12]研究的評(píng)判標(biāo)準(zhǔn)是只要有胞核呈棕黃色或黃色的陽(yáng)性細(xì)胞即定義為陽(yáng)性,其結(jié)果顯示無(wú)論是膠質(zhì)瘤復(fù)發(fā)組還是未復(fù)發(fā)組,PCNA的表達(dá)強(qiáng)度均隨著腫瘤級(jí)別升高不斷增加。另外本研究結(jié)果顯示腦膠質(zhì)瘤中PCNA的表達(dá)水平與患者術(shù)后生存時(shí)間呈負(fù)相關(guān),但由于病理分級(jí)是腦膠質(zhì)瘤獨(dú)立的預(yù)后因素之一,而PCNA在高級(jí)別膠質(zhì)瘤中顯著高表達(dá),這種相關(guān)性有可能在很大程度上影響了結(jié)果的判斷[13]。
綜上所述,Ki-67和PCNA的陽(yáng)性率與腦膠質(zhì)瘤的病理分級(jí)相關(guān),而P53則無(wú)確定性關(guān)系。而三者是否為腦膠質(zhì)瘤的獨(dú)立預(yù)后因素尚需大量多因素分析結(jié)果證實(shí)。
[1]Bauman G,Lote K,Larson D,et al.Pretreatment factors predict overall survival for patients with low-grade glioma:a recursive partitioning analysis.Int J Radiat Oncol Biol Phys,1999,45(4):923-929.
[2]Kogiku M,Ohsawa I,Matsumoto K,et al.Prognosis of glioma patients by combined immunostaining for survivin,Ki-67 and epidermal growth factor receptor.J Clin Neurosci,2008,15(11):1198-203.
[3]Rodriguez-Pereira C,Suarez-Penaranda JM,Vazquez-Salvado M,et al.Value of MIB-1 labelling index(LI)in gliomas and its correlation with other prognostic factors.A clinicopathologic study.J Neurosurg Sci,2000,44(4):203-9;discussion 209-10.
[4]McKeever PE.Insights about brain tumors gained through immunohistochemistry and in situ hybridization of nuclear and phenotypic markers.J Histochem Cytochem,1998,46(5):585-594.
[5]袁慶國(guó),松本健一,巖城澈.MGMT和Ki-67在膠質(zhì)母細(xì)胞瘤中的表達(dá)對(duì)ACNU化療預(yù)后的影響.中國(guó)神經(jīng)腫瘤雜志,2006,4(3):200-204.
[6]Fisher BJ,Naumova E,Leighton CC,et al.Ki-67:a prognostic factor for low-grade glioma?.Int J Radiat Oncol Biol Phys,2002,52(4):996-1001.
[7]Haas-Kogan DA,Kogan SS,Yount G,et al.p53 function influences the effect of fractionated radiotherapy on glioblastoma tumors.Int J Radiat Oncol Biol Phys,1999,43(2):399-403.
[8]岳偉英,俞蘇寰,李志強(qiáng),等.TP53突變與膠質(zhì)瘤惡性進(jìn)展.中國(guó)神經(jīng)腫瘤雜志,2008,6(2):85-90.
[9]Nieder C,Petersen S,Petersen C,et al.The challenge of p53 as prognostic and predictive factor in gliomas.Cancer Treat Rev,2000,26(1):67-73.
[10]Kontopidis G,Wu SY,Zheleva DI,et al.Structural and biochemical studies of human proliferating cell nuclear antigen complexes provide a rationale for cyclin association and inhibitor design.Proc Natl Acad Sci U S A,2005,102(6):1871-1876.
[11]Kirkegaard LJ,DeRose PB,Yao B,et al.Image cytometric measurement of nuclear proliferation markers(MIB-1,PCNA)in astrocytomas.Prognostic significance.Am J Clin Pathol,1998,109(1):69-74.
[12]陸曉旻,彭春,呂祥瑞.PCNA表達(dá)與腦膠質(zhì)瘤復(fù)發(fā)的相關(guān)性分析.實(shí)用癌癥雜志,2009,24(5):455-456.
[13]Zhao H,Yu H,Liu Y,et al.DNA topoisomerase II-alpha as a proliferation marker in human gliomas:correlation with PCNA expression and patient survival.Clin Neuropathol,2008,27(2):83-90.

