誘導血紅素加氧酶-1對肝硬化大鼠腸黏膜屏障的保護作用
王珅 方志強
肝硬化(hepatic cirrhosis,HC)發展過程中常伴隨腸黏膜屏障的損傷[1],腸道內大量細菌向腸腔外移位,可引起全身炎性反應綜合征和多器官功能衰竭[2]。因此,重建腸道屏障的完整性在肝硬化治療中顯得尤為重要。血紅素加氧酶-1(heme oxygenase-1,HO-1)是血紅素代謝中的限速酶,炎癥等刺激可誘導其表達,具有細胞保護作用[3]。本實驗通過建立四氯化碳(carbon tetrachloride,CCl4)致大鼠肝硬化動物模型,觀察HO-1誘導對腸黏膜屏障的保護作用。
1 材料與方法
1.1 試劑 FITC-葡聚糖、鈷原卟啉(cobalt protoporphyrin,CoPP)(Sigma公司);小鼠抗大鼠Bcl-2一抗及山羊抗小鼠二抗(Santa Cruz公司);小鼠抗大鼠β-actin單克隆抗體(Cell Signaling Technology公司);ELISA試劑盒(BioSource公司);BCA蛋白濃度測定試劑盒、脂質氧化(MDA)檢測試劑盒及TUNEL試劑盒(碧云天公司)。
1.2 肝硬化動物模型的建立 建立肝硬化動物模型的方法參照文獻[4],簡述如下:選取健康雄性 Wistar大鼠40只(山西醫科大學實驗動物中心提供),體重210~240 g,隨機分為2組:control組(n=8):以正常飲食喂養;HC組(n=32):建模第一天,大鼠背部皮下注射CCl4原液(5 ml/kg)。以后每隔3日,皮下注射40%的CCl4橄欖油溶液(3 ml/kg)。飼料前兩周為79.5%玉米面、20%豬油及0.5%膽固醇,從第三周起為99.5%玉米面與0.5%膽固醇,10~30%飲用酒為其唯一飲用水。六周末可形成HC。建模中HC組病死率為34.4%(11/32),對照組無死亡。
1.3 誘導HO-1表達 在HC組中隨機選取10只大鼠誘導HO-1表達,為HC+HO組。實驗方法參照文獻[5],簡述如下:HC+HO組大鼠每周兩次皮下注射CoPP(1.5 mg/kg),共兩周。作為對照,control組與HC組均注射NaOH溶液(0.1 mol/L,pH 8.3)。
1.4 腸黏膜通透性檢測 將大鼠麻醉后開腹手術,仔細分離出距回盲瓣5 cm處的下段回腸10 cm,兩端以棉線扎緊。將濃度為2 g/L的FITC-葡聚糖注入該腸段至充盈。30 min后取門靜脈血1 mL、分離血漿。多功能酶標儀檢測血漿中的熒光強度(激發光488 nm,發射光525 nm)。如測定值超過檢測上限,可同比例稀釋樣本。以各組測定值與control組的平均熒光強度之比作為反映腸黏膜通透性的相對指標。
1.5 血漿及腸組織勻漿生化指標的檢測 經腹主動脈取血,分離、分裝血漿并凍存于-80℃待檢。同時取一段回腸組織制備組織勻漿,4℃ 12500 g超速離心10 min后收集上清液。檢測上清液中回腸組織蛋白濃度(BCA法)。ELISA法檢測血漿腫瘤壞死因子(tumour necrosis factor α,TNF-α)及白介素-6(interleukin-6,IL-6)含量。脂質氧化檢測試劑盒檢測腸組織勻漿丙二醛(malondialdehyde,MDA)含量。
1.6 回腸組織HO活性的測定 以膽紅素生成量反映大鼠回腸組織HO的活性,方法參照文獻[6],并略作修改。將一定蛋白含量的回腸組織勻漿上清液加入體積為1.2 mL的反應體系,其中包含:大鼠肝細胞溶質(2 mg)、NADP(0.8 mmol/L)、6-磷酸葡萄糖(1 mmol/L)和6-磷酸葡萄糖脫氫酶(0.2單位)。最后添加20 μL氯高鐵血紅素(2.5 mmol/L)作為酶反應底物。37℃水浴避光反應20 min,置于冰上終止反應。用多功能酶標儀在于464 nm和530 nm處測定吸光度。膽紅素濃度c=(A464-A530)/εb。式中ε=40(mmol L-1)-1 cm-1,為膽紅素的吸光系數;b為光程長度(cm)。HO活性表示為每mg組織蛋白在1 h內催化生成的膽紅素的量。
1.7 腸黏膜凋亡細胞原位缺口末端標記法(TUNEL)檢測 10%甲醛固定回腸末端組織(應避開做通透性檢測的腸段),石蠟包埋、切片、二甲苯脫蠟、梯度乙醇脫水后,蛋白酶K(20 mg/L)37℃孵育30 min。PBS沖洗2 min ×3次,3%H2O2甲醇室溫封閉30 min。PBS洗片后加入TUNEL反應液50 μL/張切片,37℃避光孵育1 h。PBS洗片2 min ×3次,加入 POD 50 μL,37℃孵育30 min。PBS洗片2 min×3 次,DAB顯色10 min,光學顯微鏡觀察并拍照。實驗重復3次。
1.8 Western blot 將含20 μg蛋白的回腸組織勻漿上清液上樣于15%的SDS-PAGE,電泳分離,之后將蛋白轉移至PVDF膜上。用小鼠抗大鼠Bcl-2單克隆抗體檢測。以β-actin為內參。實驗結果以同一樣本Bcl-2蛋白與β-actin蛋白表達量的比值表示。實驗重復3次。
2 實驗結果
2.1 腸組織HO活性的變化 為確定HC大鼠HO-1的誘導情況,我們檢測了各組大鼠腸組織HO的活性。結果顯示,與control組相比,HC組大鼠腸組織HO活性即顯著升高(P<0.01);經CoPP誘導后,HC+HO組大鼠腸組織HO活性顯著高于HC組(P<0.01,圖1)。
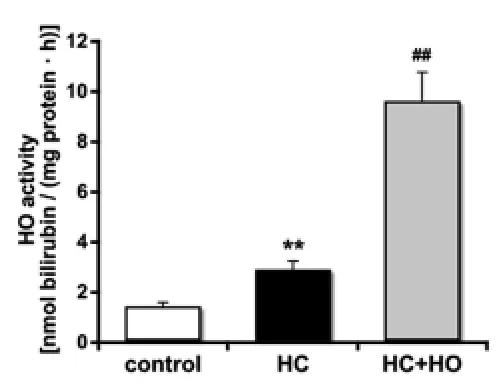
圖1 各組大鼠腸組織HO活性的變化
2.2 誘導HO-1對肝硬化大鼠腸黏膜通透性的影響 如圖2所示,與control組比較,HC組大鼠腸道通透性顯著增高(P<0.01),相對熒光強度達到前者的3倍左右。經HO-1誘導后,HC+HO組大鼠腸道通透性比HC組顯著降低(P<0.05)。
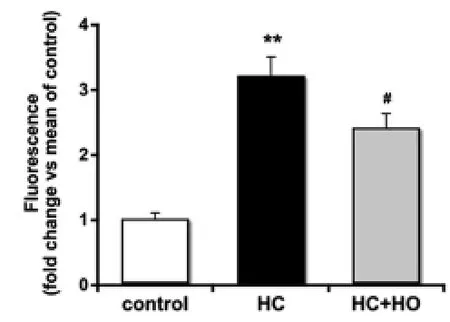
圖2 誘導HO-1對肝硬化大鼠腸道通透性的影響
2.3 各組血漿TNF-α及IL-6與腸組織勻漿MDA含量的變化 血漿 TNF-α水平在 HC組顯著高于control組(P<0.01),而在HC+HO組顯著低于HC組(P<0.05);IL-6水平在HC組顯著高于control組(P<0.01),但在HC與HC+HO兩組間未見顯著性差異。腸組織勻漿MDA含量在HC組顯著高于control組(P<0.01),而在HC+HO組顯著低于HC組(P<0.01),見表1。
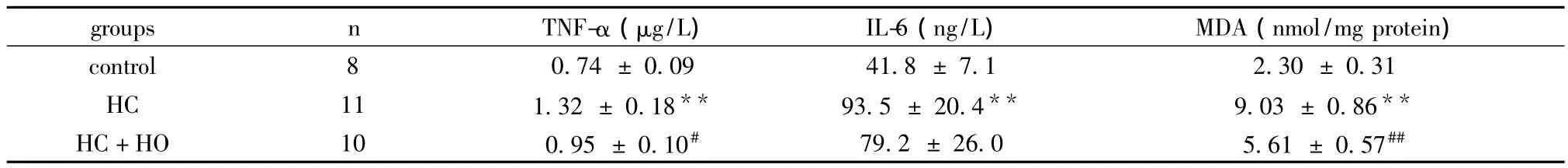
表1 各組血漿TNF-α及IL-6與腸組織勻漿MDA的含量
2.4 誘導HO-1對肝硬化大鼠腸黏膜細胞凋亡的影響Control組大鼠腸黏膜上皮凋亡細胞數量很少(圖3A),而HC組可見大量腸黏膜上皮細胞凋亡,固有層和腺上皮細胞亦可見凋亡,陽性細胞呈棕黃色(圖3B)。誘導大鼠表達HO-1后,腸黏膜凋亡細胞數明顯減少(圖3C)。
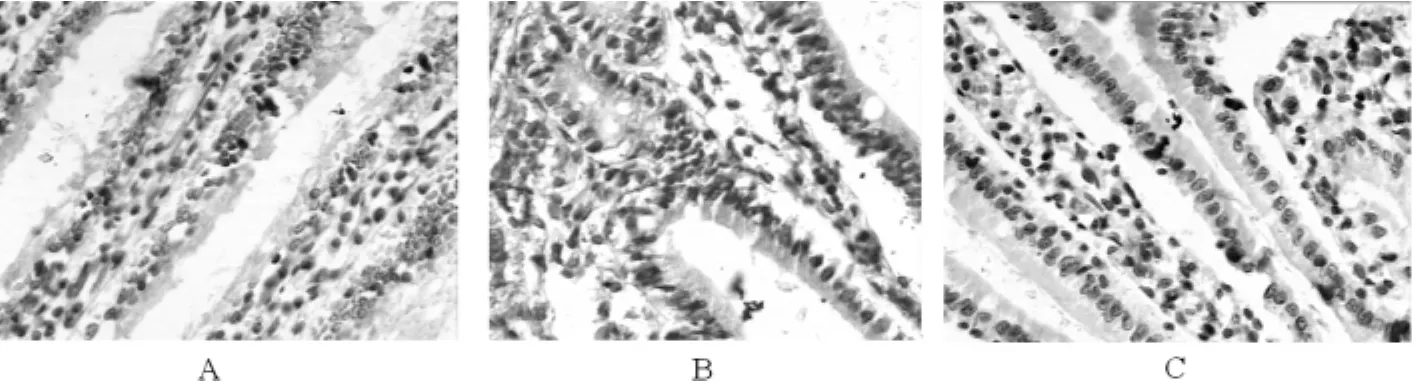
圖3 誘導HO-1減輕肝硬化大鼠腸上皮細胞凋亡
2.5 誘導HO-1對肝硬化大鼠腸組織Bcl-2表達的影響HC組大鼠Bcl-2蛋白表達量為0.05±0.02,顯著低于control組的0.22±0.17(P<0.01)。而誘導HO-1可使肝硬化大鼠回腸Bcl-2蛋白表達量升高至0.58±0.24(P<0.01),已顯著高于control組(P<0.01)(圖4)。
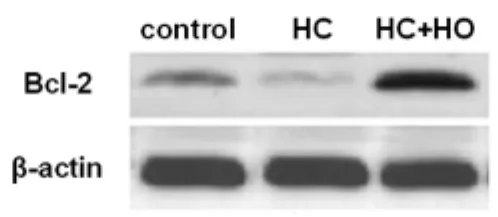
圖4 誘導HO-1上調肝硬化大鼠腸組織Bcl-2表達
3 討論
肝纖維化肝硬化時腸黏膜通透性增加可導致細菌向腸外移位、內毒素血癥形成及自發性腹膜炎的產生[7]。腸源性內毒素血癥的形成可激活Kupffer細胞合成與釋放炎性介質如TNF-α等進一步損傷腸屏障功能[8]。內毒素血癥還對肝臟造成“二次打擊”[9],誘發炎性介質大量釋放,繼而反復、持續地損傷肝細胞。因此,在肝硬化治療中應以重建腸屏障完整性、防止內毒素血癥形成為重要策略。
HO系統具有顯著的抗炎、抗氧化等細胞保護作用[10]。HO是血紅素代謝的關鍵酶,催化其降解產生膽紅素、一氧化碳(carbon monoxide,CO)和鐵。在哺乳動物中存在兩種HO同工酶[5],即 HO-1和 HO-2。HO-1可在氧化應激、輻射、炎癥及低氧等刺激下被誘導表達[11]。本研究以CoPP皮下注射誘導大鼠表達HO-1。有資料表明CoPP不會影響HO-2的表達量[5],故本研究檢測腸組織HO活性即可顯示HO-1表達量的變化。
我們的研究結果顯示,與對照組相比,肝硬化大鼠腸黏膜通透性顯著增高;誘導大鼠表達HO-1可顯著降低肝硬化大鼠腸黏膜的通透性。為探討HO-1對大鼠腸屏障的保護機制,我們首先考慮其抗炎作用是否參與其中。通過對血漿炎癥因子TNF-α及IL-6的檢測,發現在肝硬化大鼠中這兩種細胞因子血漿含量均顯著高于對照組,說明在纖維化形成過程中炎癥介質的釋放可能參與了對肝、腸的損傷。誘導HO-1表達可顯著降低肝硬化大鼠血漿TNF-α水平。同時結合對腸組織勻漿MDA的檢測,發現HO-1誘導可降低肝硬化大鼠腸MDA水平。說明HO-1可使大鼠體內脂質過氧化程度降低,間接反映出其對腸組織損傷的保護作用。
細胞凋亡常常也是導致上皮組織緊密連接破壞、通透性增高的重要原因[12]。本研究發現肝硬化大鼠腸黏膜凋亡細胞數量顯著高于對照組,說明細胞凋亡可能參與了肝硬化大鼠腸黏膜通透性的升高。誘導HO-1表達可降低肝硬化大鼠腸黏膜細胞凋亡。我們還考察了抗凋亡蛋白Bcl-2在各組中的表達情況。肝硬化大鼠腸組織Bcl-2表達低于對照組,但其在HO-1誘導之后表達水平明顯增加,這可能是腸黏膜細胞凋亡減少的關鍵信號。
最近在對小鼠肝臟缺血/再灌注模型的研究中發現[13],誘導HO-1表達可增加信號蛋白STAT3的磷酸化,后者激活PI3K/Akt通路、降低缺血再灌注誘導的細胞凋亡。誘導HO-1保護肝硬化大鼠腸黏膜屏障的分子機制值得在今后的研究中進一步探討。
[1]Palma P,Mihaljevic N,Hasenberg T,et al.Intestinal barrier dysfunction in developing liver cirrhosis:An in vivo analysis of bacterial translocation.Hepatol Res,2007,37(1):6-12.
[2]Shawcross DL,Sharifi Y,Canavan JB,et al.Infection and systemic inflammation,not ammonia,are associated with Grade 3/4 hepatic encephalopathy,but not mortality in cirrhosis .J Hepatol,2011,54(4):640-649.
[3]Piantadosi CA,Withers CM,Bartz RR,et al.Heme oxygenase-1 couples activation of mitochondrial biogenesis to anti-inflammatory cytokine expression . JBiolChem,2011,286(18):16374-16385.
[4]韓德五,馬學惠,趙元昌.肝硬化動物模型的研究 .山西醫藥雜志,1979,8(4):1.
[5]Elmarakby AA,Faulkner J,Posey SP,et al.Induction of hemeoxygenase-1 attenuates the hypertension and renal inflammation in spontaneously hypertensive rats.Pharmacol Res,2010,62(5):400-407.
[6]Morita T,Perrella MA,Lee ME,et al.Smooth muscle cell-derived carbon monoxide is a regulator of vascular cGMP.Proc Natl Acad Sci U S A,1995,92(5):1475-1479.
[7]Lorenzo-Zuniga V,Rodriguez-Ortigosa CM,Bartoli R,et al.Insulin-like growth factor I improves intestinal barrier function in cirrhotic rats .Gut,2006,55(9):1306-1312.
[8]Genesca J,Marti R,Rojo F,et al.Increased tumour necrosis factor alpha production in mesenteric lymph nodes of cirrhotic patients with ascites.Gut,2003,52(7):1054-1059.
[9]Han DW Intestinal endotoxemia as a pathogenetic mechanism in liver failure.World J Gastroenterol,2002,8(6):961-965.
[10]Krause D,Suh HS,Tarassishin L,et al.The tryptophan metabolite 3-hydroxyanthranilic Acid plays anti-inflammatory and neuroprotective roles during inflammation role of hemeoxygenase-1.Am J Pathol,2011,179(3):1360-1372.
[11]Otterbein LE,Hedblom A,Harris C,et al.Heme oxygenase-1 and carbon monoxide modulate DNA repair through ataxia-telangiectasia mutated(ATM)protein.Proc Natl Acad Sci U S A,2011,108(35):14491-14496.
[12]Syrkina O,Jafari B,Hales CA,et al.Oxidant stress mediates inflammation and apoptosis in ventilator-induced lung injury.Respirology,2008,13(3):333-340.
[13]Ke B,Shen XD,Ji H,et al.HO-1-Stat3 axis in mouse liver ischemia/reperfusion injury:regulation of TLR4 innate responses through PI3K/PTEN signaling.J Hepatol,2011.

