蛹蟲草子實體中甘露醇含量的測定
劉艷芳,薛俊杰,2,張勁松,楊 焱,周 帥,馮娜,汪雯翰,吳 迪,張 忠,唐慶九*
1國家食用菌工程技術研究中心上海市農業科學院食用菌研究所,上海 201403;2南京農業大學生命科學學院,江蘇南京 210095
蛹蟲草又名北蟲草、北冬蟲夏草,屬于子囊菌亞門(Ascomycotina),麥角菌科(Clavicipitaceae),蟲草屬(Cordyceps)的模式種,學名為Cordyceps militaris,是一種常見的食藥用真菌[1,2],2008 年被國家衛生部批準為新資源食品后備受關注。甘露醇是其活性成分之一,具有利尿脫水、鎮咳、祛痰、平喘等多種功效[3]。甘露醇含量的高低已成為蟲草產品的質控指標之一。
目前用于甘露醇測定的方法主要有化學比色法[4]、氣相色譜法[5]、高效液相色譜法[6-7]等,化學比色法易受干擾,測定結果不準確;氣相色譜法需要衍生化,處理復雜。HPLC是目前理想的快速、準確測定甘露醇的方法。但用于測定甘露醇的HPLC分析柱多為氨基柱,由于氨基柱存在氨基基團從硅膠表面緩慢地漂移等問題,使用壽命有限,因此本研究使用一種配位體型分析柱,開發了分析測定甘露醇的新方法,并進行了方法學考察,為蛹蟲草中甘露醇的定量分析提供了保證。
1 材料與方法
1.1 材料
1.1.1 材料來源
蛹蟲草子實體,購自上海百信生物科技有限公司。
1.1.2 試劑
甘露醇標準品購自sigma公司;其他試劑均為國產分析純。
1.1.3 儀器
Waters600型高效液相色譜儀,Waters2414示差折光檢測器;Dionex ICS2500離子色譜分析儀;ELGA超純水制備儀。
1.2 方法
1.2.1 色譜條件的優化
選用Shodex公司SUGAR SP0810柱(300 mm×8 mm)為分析柱,以超純水為流動相洗脫,示差折光檢測器檢測,對流速及柱溫等條件進行優化,確定色譜分析條件。
1.2.2 樣品前處理方法的優化
根據分析柱的特性,對提取溶劑、提取方式、提取時間等條件進行優化,確定樣品前處理方法。
1.2.3 標準曲線的繪制
精密稱取烘至恒重的甘露醇標準品500 mg,置于10 mL容量瓶中,加超純水定容至刻度作儲備液。將儲備液稀釋至不同濃度,進樣分析甘露醇,根據峰面積和甘露醇含量繪制標準曲線。
1.2.4 蛹蟲草子實體中甘露醇含量的計算
根據樣品對應甘露醇的峰面積和標準曲線,計算樣品中甘露醇含量。
1.2.5 不同方法測定蛹蟲草子實體中甘露醇含量的比較
取同一批樣品,分別用化學比色法[4]、離子色譜分析法[8]及本方法測定其甘露醇含量,比較測定結果的準確性。
2 結果與分析
2.1 色譜分析條件
根據SUGAR SP0810分析柱的性能,選用超純水為流動相洗脫,對分離溫度及流速進行了優化,發現柱溫為70~80℃時樣品中甘露醇峰形及分離度較好;另外,隨著洗脫流速的增加,甘露醇保留時間提前,分析時間縮短,因此在保證分離度的前提下選定1.0 mL/min的流速洗脫。標準品圖譜及樣品分析圖譜如圖1所示。

圖1 標準品與樣品高效液相色譜圖Fig.1 HPLC chromatograms of mixed standard and sample
2.2 樣品前處理方法的優化
2.2.1 提取溶劑的比較
精密稱取蛹蟲草子實體粉1 g,分別加入80%乙醇、90%乙醇和無水乙醇各100 mL熱回流提取1 h,過濾去除菌粉沉淀,上清旋轉蒸發儀回收乙醇后加水至50 mL混勻,樣品液經0.45 μm膜過濾后進行HPLC測定,分析提取量,每個處理重復3次(下同)。由表1結果可以看出,隨著乙醇濃度的增加,對甘露醇的提取率降低,無水乙醇對甘露醇的溶出效果較差,80%乙醇與90%乙醇做為提取劑對甘露醇的提取量沒有顯著差異(P<0.05),根據分析柱特性,為了盡量減少溶液中蛋白質對柱子的影響,選擇以90%乙醇做為提取溶劑進行提取。
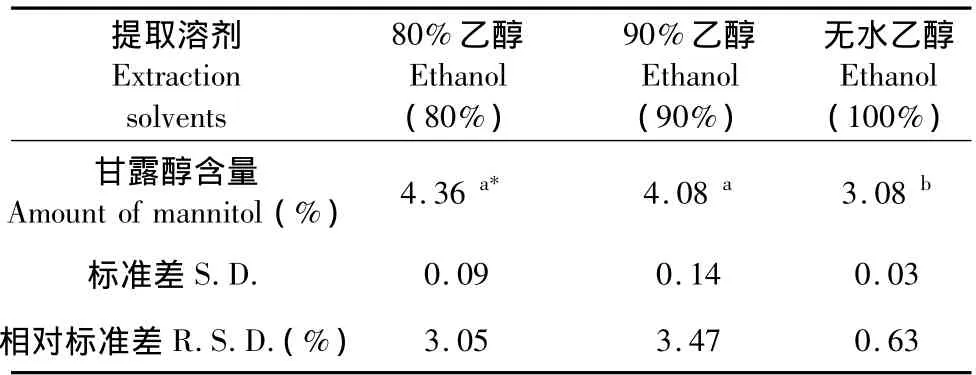
表1 提取溶劑對蛹蟲草子實體甘露醇提取量的影響(n=3)Table 1 Contents of mannitol extracted from fruiting bodies of Cordyceps militaris with different extraction solvents(n=3)
2.2.2 提取溶劑體積的篩選
精密稱取蛹蟲草子實體粉1 g,分別加入90%乙醇50、100、150和200 mL熱回流提取1 h,按上述2.2.1處理方法處理后分析甘露醇提取量。由表2結果可知,提取溶劑增加到150 mL時,提取所得甘露醇含量最高,增加到200 mL時,甘露醇含量沒有顯著變化,因此選擇在1 g子實體中加入150 mL的90%乙醇提取。

表2 提取溶劑體積對甘露醇提取量的影響(n=3)Table 2 Contents of mannitol extracted with different volume of extraction solvents(n=3)
2.2.3 提取方式的優化
精密稱取蛹蟲草子實體粉1 g,加入90%乙醇150 mL后分別進行熱回流提取和超聲波提取1 h,按2.2.1處理方法處理后分析甘露醇提取量。表3結果顯示,不同提取方式對甘露醇的提取效果差異較大,熱回流方式對甘露醇的提取較為充分,提取率明顯優于超聲波提取,因此選用熱回流方式進行樣品前處理。

表3 提取方式對甘露醇提取量的影響(n=3)Table 3 Effects of extracting modes on the contents of mannitol(n=3)
2.2.4 提取時間的優化
精密稱取蛹蟲草子實體粉1 g,加入90%乙醇150 mL 后分別熱回流提取 0.5、1、1.5 和 3h,按2.2.1處理方法處理后分析甘露醇提取量。表4結果顯示,熱回流提取超過1 h后,不同提取時間所得甘露醇含量無顯著性差異,因此選擇熱回流提取1 h進行處理。

表4 提取時間對甘露醇提取量的影響(n=3)Table 4 Effects of extraction time on contents of mannitol(n=3)
2.3 方法學考察
2.3.1 標準曲線的繪制
精密吸取甘露醇標準品儲備液適量,用超純水稀釋成一系列濃度,測定對應濃度下甘露醇的峰面積,以甘露醇濃度(X,mg/mL)對色譜峰面積(Y)繪制標準曲線,得回歸方程,y=103860x+2183.9,r=0.9999,線性范圍為 0.04 ~9.9 mg/mL。
2.3.2 精密度
取一份樣品連續進樣5次,計算精密度。結果表明,甘露醇含量的 R.S.D.值為0.54%,精密度良好。
2.3.3 重復性
取同一批樣品,按優化后的方法平行制備供試液5份進行測定,考察重復性。結果表明,甘露醇含量的 R.S.D.值為3.76%,重復性良好。
2.3.4 穩定性
取一份樣品液分別在 0、5、10、15、20 h進樣測定,考察樣品穩定性。結果表明,各時間點測定所得甘露醇含量的R.S.D.值為2.71%,因此,樣品在20 h內都較為穩定。
2.3.5 標樣回收率的測定
分別按照樣品所含甘露醇量的50%、100%、150%加入甘露醇標準品進行提取,每組試驗重復3次,取樣測定甘露醇含量并計算標準品回收率。試驗結果(見表5)表明,標樣回收率在103.11% ~107.42%之間,平均回收率為 104.27%,R.S.D.值為2.19%,說明該方法對甘露醇標準品的檢測特異性良好。

表5 標樣回收率的測定Table 5 Determination on recoveries of mannitol from samples

50.45 20 71.06 103.05 50.45 20 71.82 106.85 50.45 40 91.82 103.43 50.45 40 91.85 103.50 50.45 40 90.30 99.63 50.45 60 114.76 107.18 50.45 60 113.91 105.77 50.45 60 113.31 104.77
2.4 不同方法測得蛹蟲草子實體甘露醇含量的比較
取同一份子實體材料,分別采用本方法、離子色譜分析法及文獻常用的化學比色法對其甘露醇含量進行測定,結果見表6。經比較發現,化學比色法測得的甘露醇含量達8.97%,高效液相色譜法和離子色譜分析法所測結果相近,沒有顯著性差異。

表6 不同方法測得蛹蟲草子實體甘露醇含量的比較(n=3)Table 6 Comparison of mannitol contents in fruiting bodies of Cordyceps militaris determined by different methods(n=3)
3 討論
本研究選用Shodex公司SUGAR SP0810柱對蛹蟲草子實體中甘露醇進行定量分析,對樣品前處理方法進行了優化,為避免提取物中含有大量蛋白,對分析柱造成損傷,在保證提取效果的前提下選用90%乙醇做為提取溶劑減少蛋白質的影響。與氨基柱相比,本研究所用流動相僅為超純水,且分析柱壽命長,對甘露醇分離效果好,是一種分析甘露醇的較好的方法。
三種不同方法測定蛹蟲草子實體中甘露醇含量的結果表明,化學比色法所測含量明顯偏高,可能有雜質干擾,因此化學比色法僅適用于測定具有一定純度的甘露醇制品,不太適用于蛹蟲草子實體中甘露醇含量的測定。而高效液相色譜法和離子色譜法都能對蛹蟲草中甘露醇的含量進行較為準確的分析,相比較而言,離子色譜儀普及度不高,試劑成本較高,所以高效液相色譜法更適于在多數實驗室進行。本方法的建立為蟲草產品的質量控制提供了較好的依據。
1 Dai YC(戴玉成),Yang ZL(楊祝良).A revised checklist of medicinal fungi in China.Mycosystema,2008,27:801-824.
2 Dai YC(戴玉成),Zhou LW(周麗偉),Yang ZL(楊祝良),et al.A revised checklist of edible fungi in China.Mycosystema,2010,29:1-21.
3 Yilmaz N,Dulger H,Kiymaz N,et al.Activity of mannitol and hypertonic saline therapy on the oxidant and antioxidant system during the acute term after traumatic brain injury in the rats.Brain Res,2007,164:132-135.
4 Li Y(李顏),Shi WN(史薇娜),Tang QJ(唐慶九),et al.Determination of polysaccharides and mannitol in cordyceps sinensis and cordyceps militaris using colorimetric methods.Acta Fdulis Fungi(食用菌學報),2007,14(3):53-57.
5 Wang B(王波),Xu Z(徐哲),Jin SJ(金順姬),et al.Determination of D-mannitol in cordyceps militaris by Gas Chromatography.Acad Period Changchun Coll Trad Chin Med(長春中醫學院學報),2005,21(2):37-44.
6 Huang SJ,Tsai SY,Lee YL,et al.Nonvolatile taste components of fruit bodies and mycelia of cordyceps militaris.LWTFood Sci Technol,2006,39:577-583.
7 Maua JL,Lin HC,Chen CC.Non-volatile components of several medicinal mushrooms.Food Res Intern,2001,34:521-526.
8 Zhou S(周帥),Xue JJ(薛俊杰),Liu YF(劉艷芳),et al.Determination of arabitol,trehalose and mannitol in the fruit bodies of edible fungi using high performance anion chromatography-pulsed amperometric detection(HPAEC-PAD).Acta Fdulis Fungi(食用菌學報),2011,18:49-52.

