尋常型銀屑病患者皮損中HBD-2和TNF-α的表達及意義①
王 琳 甄 莉 (山西醫科大學第一醫院皮膚科,太原030001)
銀屑病是一種常見且易復發的慢性炎性皮膚病,其病因及發病機制尚未完全清楚。近期的研究越來越關注抗微生物肽表達失調在銀屑病發病機制中的作用[1]。HBD是抗微生物肽家族成員之一,不僅具有抗細菌、抗病毒、抗真菌等生物活性還是連接天然免疫和獲得性免疫的橋梁[2]。適量表達有抗微生物作用,過量表達意義尚不清楚。TNF-α作為促炎癥因子,在銀屑病的發生、發展中起著重要作用,且大量研究表明,在體外實驗中TNF-α能促進HBD-2產生[3]。本實驗采用實時熒光 PCR(RTPCR)檢測尋常型銀屑病皮損處HBD-2及TNF-α mRNA的表達,進一步揭示二者之間的關系和在銀屑病發病中的作用。
1 材料與方法
1.1 對象 進行期尋常型銀屑病患者45例,男25例,女20例;年齡在18~65歲,平均年齡31.8歲。問診排除取材前3個月內系統使用過糖皮質激素、維A酸、免疫抑制劑等藥物、光療,2周內使用過外用藥物,以及合并其他內臟疾病者。45例患者的銀屑病皮疹面積和嚴重程度指數(PASI評分)為6.9~55.2,按評分再將患者分為三組:<24 為輕度組,25例;24~48為中度組,12例;>48為重度組,8例。皮損標本均取自軀干或四肢的典型皮損,在距離皮損>1 cm處切取外觀正常的皮膚作為非皮損。正常對照組皮膚來自我院整形科手術切除的正常皮膚組織。標本取下后,均立即液氮冷凍,-70℃冰箱保存。
1.2 實驗材料
1.2.1 主要儀器與設備 TL988型實時熒光定量PCR儀(西安天隆科技有限公司);Y200C型電泳儀及JY-SCZ型電泳槽(北京君意東方電泳設備有限公司)。
1.2.2 實驗試劑 Transzol溶液、DNA marker由北京全式金生物技術有限公司生產;PrimeScript?RT試劑盒及SYBR?Premix Ex TaqTMII試劑盒購于寶生物工程(大連)有限公司。
1.2.3 引物設計及合成 引物設計參照GenBank序列,應用Primer Premier 5.0軟件設計,確定序列后由上海生工生物工程技術服務有限公司合成。設β-actin為內參照基因,其上游引物:5'-AGAGCTACGAGCTGCCTGAC-3',下游引物:5'-AGCACTGTGTTGGCGTACAG-3',預期擴增片段184 bp。HBD-2上游引物:5'-ATTCCTGATGCCTCTTCC-3',下游引物:5'-GTGCCAATTTGTTTATACCTTC-3',預期擴增片段 117 bp。TNF-α上游引物:5'-TCCTTCAGACACCCTCAACC-3',下游引物:5'-AGGCCCCAGTTTGAATCCTT-3',預期擴增片段173 bp。
1.3 方法
1.3.1 提取總RNA 嚴格按照Transzol溶液試劑盒說明書進行操作提取,提出的RNA用紫外分光光度計測定其純度濃度,保存樣品于-70℃備用。
1.3.2 逆轉錄合成 cDNA 反應體系10 μl:5×PrimeScript? Buffer 2 μl,Prime Script? RT Enzyme Mix I 0.5 μl,Oligo dT Primer 0.5 μl,Random 6 mers 0.5 μl,Total RNA 2 μl ,RNase Freed H2O 4.5 μl。反應條件:37℃15分鐘 ,85℃5秒。
1.3.3 RT-PCR步驟 按照逆轉錄試劑盒說明書進行RT反應,25 μl反應體系:SYBR? Premix Ex TaqTMⅡ 12.5 μl ,PCR Forward Primer 1 μl,PCR Reverse Primer 1 μl,DNA 模板 2 μl,滅菌蒸餾水 8.5 μl。預變性:95℃ 30秒1個循環。PCR反應:95℃5秒,55℃ 30秒,72℃ 30秒,40個循環。反應結束后,讀取Ct值。
1.3.4 PCR產物電泳和相對定量分析 取PCR擴增產物5 μl于瓊脂糖凝膠中電泳,以5 V/cm電泳20分鐘,紫外燈下觀察結果并攝影。結果顯示各組均有預期的陽性片段。經測定目標基因和內標基因的擴增效率相同,通過△△CT值法計算其相對表達量。
1.4 統計學分析 統計學處理結果使用SPSS17.0統計軟件進行統計分析,所得數據以x±s表示,相關性采用pearson或spearman相關分析;多組比較采用Kruskal-Wallis秩和檢驗;P<0.05為差異有統計學意義;組間兩兩比較采用Bonferroni法,校正檢驗水準后 α'=0.017,P <0.017 為差異有統計學意義。
2 結果
2.1 HBD-2 mRNA和TNF-α mRNA的表達在尋常型銀屑病皮損組顯著高于非皮損組和正常對照組(P <0.01);非皮損組高于正常對照組(P <0.01)。見表1。
2.2 在銀屑病皮損中HBD-2 mRNA與TNF-α mRNA的表達均成正相關,相關系數為r=0.81;P<0.01。
2.3 HBD-2 mRNA和TNF-α mRNA的表達在銀屑病患者重度組顯著高于中度和輕度組(P<0.01);中度組高于輕度組(P<0.01)。見表2。
2.4 在銀屑病皮損中HBD-2 mRNA及TNF-α mRNA的表達均與患者的PASI評分成正相關,相關系數分別為 r=0.89、r=0.79;P 值均 <0.01。
3 討論
銀屑病的發病機制目前尚不清楚,近年來多認為銀屑病是免疫介導的疾病,促炎因子如TNF-α、IL-1等在銀屑病的發病中扮演著重要的角色。Grone等[4]研究發現 TNF-α 刺激角質形成細胞增殖;并誘導角質形成細胞和血管內皮細胞表達細胞間粘附分子(ICAM-1),為中性粒細胞與淋巴細胞提供粘附位點,活化中性粒細胞與血管內皮細胞,釋放炎性介質,加劇局部的炎癥反應,產生典型銀屑病皮損[5]。

表1 對照組、非皮損組及皮損組HBD-2、TNF-α mRNA表達(x±s)Tab.1 The mRNA expression of HBD-2 and TNF-α in lesional skin,noninvolved skin and normal controls(x±s)
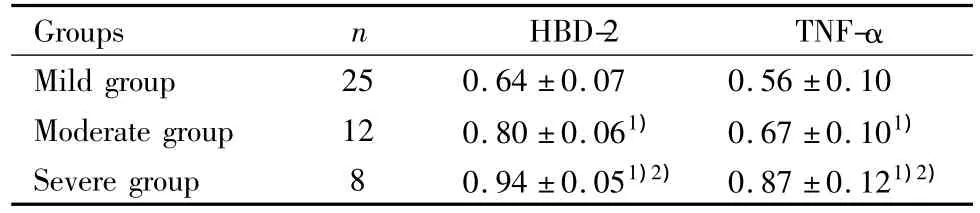
表2 輕度組、中度組及重度組HBD-2、TNF-α mRNA表達(x±s)Tab.2 The mRNA expression of HBD-2 and TNF-α in mild group,moderate group and severe group(x±s)
銀屑病患者皮膚屏障功能嚴重受損但卻很少發生感染,其原因之一就是Schroder等[6]在銀屑病皮損中發現的HBD-2的高表達。HBD的高表達不僅可以預防感染,可能和銀屑病的發病也存在著某種密切的關系,Hollox等[7]對銀屑病患者和正常對照的8號染色體的HBD區域進行基因多態性分析,發現HBD-2基因的拷貝數與銀屑病的發生呈正相關。
HBD-2可被多種細胞因子誘導產生。Joly等[8]用 IL-1β、IL-2、IL-6、IL-8、IL-12、TNF-α、IFN-γ 和LPS刺激牙齦角質形成細胞,對其表達的HBD-2進行定量分析,發現其中TNF-α和IL-1β是導致HBD-2的表達最主要原因。Gambichler等[1]發現銀屑病患者經依那西普(TNF-α受體阻滯劑)治療后PASI評分及皮損中HBD-2較治療前明顯下降,認為依那西普誘導的銀屑病病變的改善與HBD-2等表達明顯下降有關。而研究表明HBD-2又可反過來刺激TNF-α的產生。Kanda等[9]研究發現 HBD-2可作為刺激因子,通過JNK等途徑促進TNF-α等細胞因子的產生。本研究表明:HBD-2和TNF-α在尋常型銀屑病皮損中的表達均升高,且HBD-2和TNF-α存在正相關,并且二者的表達隨銀屑病患者病情嚴重程度的增加而增加,和銀屑病PASI評分成顯著的正相關。常玉英等[10]研究表明 HBD-2的高表達與TNF-α共同作用可加劇炎癥反應,以及本實驗的結果推測:作為固有免疫和獲得性免疫的橋梁的HBD-2和TNF-α之間可能存在著相互作用,相互誘生的關系。HBD-2的高表達是一把雙刃劍在防御感染的同時,也可能擴大炎癥反應,與TNF-α等促炎因子共同參與了銀屑病的發病過程。
1 Gambichler T,Kobus S,Kobus A et al.Expression of antimicrobial peptides and proteins in etanercept-treated psoriasis patients[J].Regul Pept,2011;167(2-3):163-166.
2 Yang D,Chertov O,Bykovskaia S N et al.β-defensins:linking innate and adaptive immunity through dendritic and t cell CCR6[J].Science,1999;286(5439):525-528.
3 Gisondi P,Gubinelli E,Cocuroccia B et al.Targeting tumor necrosis factor-alpha in the therapy of psoriasis[J].Curr Drug Targets Inflamm Allergy,2004;3(2):175-183.
4 Grone A.Keratinocytes and cytokines[J].Vet Immunol Immunopathol,2002;88(1-2):1-12.
5 McKenzie R C,Sabin E.Aberrant signalling and transcription factor activation as an explanation for the defective growth control and differentiation of keratinocytes in psoriasis:A hypothesis[J].Exp Dermatol,2003;12(4):337-345.
6 Schroder J M,Harder J.Human beta-defensin-2[J].Int J Biochem Cell Biol,1999;31(6):645-651.
7 Hollox E J,Huffmeier U,Zeeuwen P L et al.Psoriasis is associated with increased β-defensin genomic copy number[J].Nat Genet,2008;40(1):23-25.
8 Joly S,Organ C C,Johnson G K et al.Correlation between beta-defensin expression and induction profiles in gingival keratinocytes[J].Mol Immunol,2005;42(9):1073-1084.
9 Kanda N,Kamata M,Tada Y et al.Human β-defensin-2 enhances IFN-γ and IL-10 production and suppresses IL-17 production in T cells[J].J Leukoc Biol,2011;89(6):935-944.
10 常玉英,歐陽欽.防御素在小鼠噁唑酮結腸炎粘膜中的表達及意義[J].胃腸病學,2007;12(2):96-100.

