ADAM23在小鼠腦組織的表達①
康 靜 毛會麗 閆 欣 劉 瑞 林俊堂 豐慧根 (新鄉醫學院生命科學技術系,新鄉453003)
ADAM,是一類去整合素和金屬蛋白水解酶家族(A disintegrin and metalloprotease,ADAM)的英文縮寫[1]。ADAM由相互獨立但又互補的功能域所構成,包含8個結構域,自N-端至C-端依次為:信號肽、前體結構域、金屬蛋白酶域、去整合素域、富含Cys結構域、表皮生長因子結合域,跨膜域和胞質域(圖1)[2],它們在脊椎動物發育過程中,特別是中樞神經系統,扮演重要的角色[3-8]。
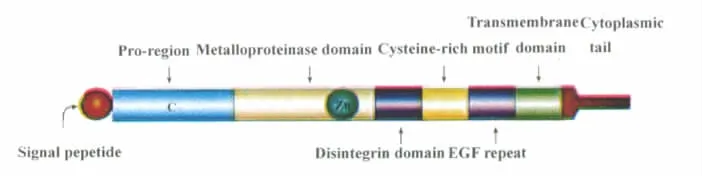
圖1 ADAM功能形態模型Fig.1 The ADAM function model
相對于其它 ADAM家族成員,ADAM11、ADAM22和ADAM23這3個基因序列的同源性更高,并且主要在腦中表達,因而被歸入一個“腦MDC(Metalloprotease/Disintegrin/Cysteine-rich)”亞類[9]。從表達分布來看,ADAM11、ADAM22和ADAM23可能與小腦內運動神經元回路的建立有關[10-12]。ADAM23最初由Sagane等[9]通過基因克隆的方法獲得。Northern blot結果表明:人ADAM23主要在腦組織中表達,在心臟中有弱表達,其它組織中的表達量都低于檢測下限,而且主要由神經細胞表達[12]。Goldsmith[13]運用原位雜交的方法證實了ADAM23在大鼠海馬結構和小腦都有很高的表達量。另外,缺失了ADAM23的幼鼠在出生一周后出現了神經發育缺陷,并在不久后死亡[10]。但是,ADAM23在成年小鼠(Mouse)腦的各個組織的表達情況仍然未知。本實驗應用原位雜交方法系統分析ADAM23在成年小鼠腦內的表達分布情況,為探討ADAM23在脊椎動物中樞神經系統發育過程中的作用提供形態學依據。
1 材料與方法
1.1 材料 實驗動物與分組:健康雄性昆明種小鼠20只,體重18~22克,由新鄉醫學院實驗動物中心提供。其中10只小鼠用于原位雜交檢測,10只用于RT-PCR檢測。
1.2 方法
1.2.1 總RNA的抽提 取10只小鼠斷頭處死,冰盤上快速取腦,用高溫處理過的錫箔紙包裹,液氮中速凍后-80℃冰箱保存待測。小鼠腦組織RNA提取:按 Ishimitsu 等[14]建立的“異硫氰酸胍-酚-氯仿”方法,從小鼠左側額頂葉、海馬、丘腦、側腦室組織提取腦組織總RNA,采用紫外線吸收法進行RNA定量,各組RNA樣品的純度OD 260nm/OD 280nm比值均在1.8 ~2.0 之間。
1.2.2 RT-PCR及探針制備 將 RNA反轉錄為cDNA,以cDNA為模板擴增ADAM。引物序列:Upper primer:5'-CTCCCGGAAAGGCGGAAAGAGCAGA G-3';Lower primer:5'-GTGGCATTCCTCCAGTGCAG ACGATTCA-3');擴增條件:95℃ 5分鐘;95℃ 30秒,62℃ 30秒,72℃ 30秒,30循環;72℃ 5分鐘。擴增產物用瓊脂糖凝膠電泳檢測,回收目的條帶后連接到PCRII-TOPO載體中,DNA測序獲知cDNA插入方向,用于RNA探針制備。根據德國Roche公司地高辛標記RNA探針合成試劑盒說明,參考序列合成結果,限制性剪切酶BamHⅠ消化TOPOII-ADAM23質粒成線性,然后用T7 RNA polymerase合成含有地高辛標記的反義 RNA探針,純化后進行雜交實驗。
1.2.3 原位雜交方法 本實驗采用的原位雜交方法系在Redies[15]的方法定位和相對定量顯示mRNA陽性組織和細胞。
取10只動物開胸經左心室插管至升主動脈,肝素生理鹽水沖洗血液后,用4%的多聚甲醛灌注,斷頭取腦,置于4%的多聚甲醛固定液中固定4小時,后常規冰凍切片,取兩耳及連線前6 mm左右冠狀切面,切片厚20 μm,-80℃冰箱保存備用。
冰凍切片50℃干燥1小時,4% 多聚甲醛4℃固定30分鐘,PBS洗滌2次,每次5分鐘,蛋白酶K消化5分鐘,然后PBS洗滌5分鐘,4%多聚甲醛4℃再次固定30分鐘,用DEPC處理過的去離子水洗滌5分鐘后,再用三乙醇胺-乙酸酐溶液處理20分鐘,PBS洗滌2次后(每次5分鐘)分別加處理過的ADAM23 RNA探針(雜交液A和雜交液B混合),并用硅化干烤過的蓋玻片覆蓋載玻片后放入加有原位雜交平衡液的濕盒中,70℃雜交過夜。
70℃過夜雜交后,在5×SSC中去除蓋玻片,載玻片在5×SSC中室溫放置10分鐘,然后5×SSC 60℃洗滌30分鐘,接著50%(v/v)甲酰胺加2×SSC 60℃洗滌1小時,1×NTE 37℃清洗三次,每次10分鐘,RNA酶溶液37℃消化30分鐘后,1×NTE 37℃洗片10分鐘,再次50%(v/v)甲酰胺加2×SSC 60℃洗滌40分鐘,2×SSC 60℃洗滌30分鐘,0.1×SSC室溫洗滌30分鐘,緊接著PBS洗滌2次,每次5分鐘。使用0.1%(v/v)綿羊血清封閉30分鐘后加1∶2 500堿性磷酸酶標記地高辛抗體4℃過夜孵育。
次日TBS洗滌3次,每次20分鐘,用Tris堿-NaCl緩沖液(pH9.5)洗滌10分鐘,每張載玻片加包含NBT和BCIP的原位雜交顯色液1 ml,室溫或4℃下避光顯色,視信號強弱終止顯色,充分水洗,脫水,透明,封片,顯微鏡觀察。
2 結果
2.1 RT-PCR及探針制備結果 通過RT-PCR,我們獲得了大小為2.4 kb的片段(圖2),膠回收后連接PCRII-TOPO載體中獲得的陽性克隆經測序后與NCBI基因庫進行比對后發現同源性極高。原位雜交結果顯示自制的反義探針信號強,背景低,利于結果分析。
2.2 ADAM23同源性分析 從NCBI基因庫中得到了大鼠、雞及人類的ADAM23 ORF閱讀框序列,通過MEAG4軟件繪制了進化樹(圖3)來描述小鼠的ADAM23與其他種類ADAM23的同源性關系。結果顯示:小鼠ADAM23與大鼠的ADAM23同源性最高;與雞的ADAM23同源性次之;與人類的ADAM23同源性最低。
2.3 ADAM23在小鼠腦組織的表達 光鏡下染色反應產物呈藍紫色,主要見于細胞漿,軸突有少量表達。在小鼠腦內ADAM23 mRNA染色陽性細胞主要表達在大腦皮層、尾狀殼核、海馬CA3區錐體細胞、齒狀回的錐細胞、小腦、下丘的中央核、小腦核側部、小腦核前部、前庭外側核區、下丘腦后核、乳頭體內側核、前庭內側核、舌下神經核、腦橋、延髓區域等(圖4、5),圖4、5中英文縮寫對照見表1。圖4A顯示前腦中大腦皮層、尾狀殼核、海馬區域的表達;圖4B和C顯示圖4A方框區域的放大,圖4B顯示大腦皮層顆粒層的表達;圖4C顯示海馬CA3區域的表達,可見浦肯野細胞層高表達;圖4D顯示小腦、下丘的中央核、小腦核側部、小腦核前部、前庭外側核區域的表達;圖4E和F顯示圖4D方框區域的放大,圖E顯示小腦區域的浦肯野細胞層的高表達;圖F顯示前庭外側核區域的高表達;圖G顯示下丘腦區域的表達;圖H和I是圖4G方框區域的放大,可見丘腦束旁核、杏仁核內側的腹后部、未定帶區域的高表達。圖5A顯示腦橋區域中的前庭神經核 、前庭內側核的高表達;圖5B和C顯示圖5A方框區域的放大;圖5D顯示延腦區域的表達;圖E和F顯示圖D方框區域的放大,可見舌下神經核、網狀核區域神經元的細胞漿藍紫色著色。其中海馬的CA1和CA3區、齒狀回的錐細胞、小腦的普肯野細胞層和粒細胞層為高表達區域,其次為前庭外側核區、下丘腦后核、乳頭體內側核。ADAM23在海馬CA3區和小腦中,普肯野細胞層高表達(圖4C、E中箭頭所指部分),顆粒細胞層和分子層中也表達這個蛋白,但表達量相對低很多(圖4A和圖4B)。下丘腦區域中的舌下神經核、網狀核也出現高表達(圖5E、F中箭頭所指部分),我們還觀察了中樞神經系統的其他部分,結果顯示ADAM23在中樞神經系統中廣泛表達。
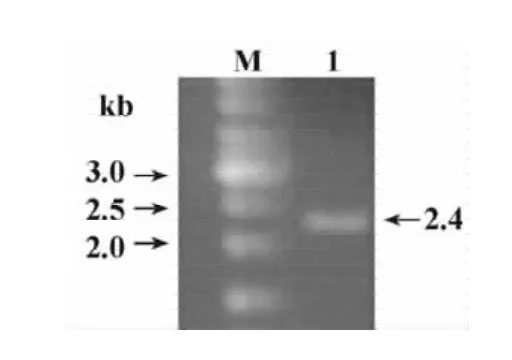
圖2 小鼠腦ADAM23 RT-RCR結果Fig.2 RT-PCR of mouse ADAM23
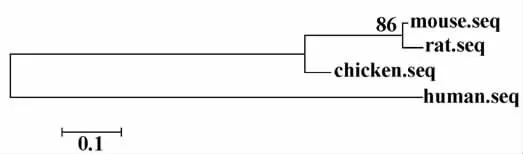
圖3 小鼠、大鼠、雞和人類ADAM23進化樹Fig.3 The four ADAM23 evolutionary relationship
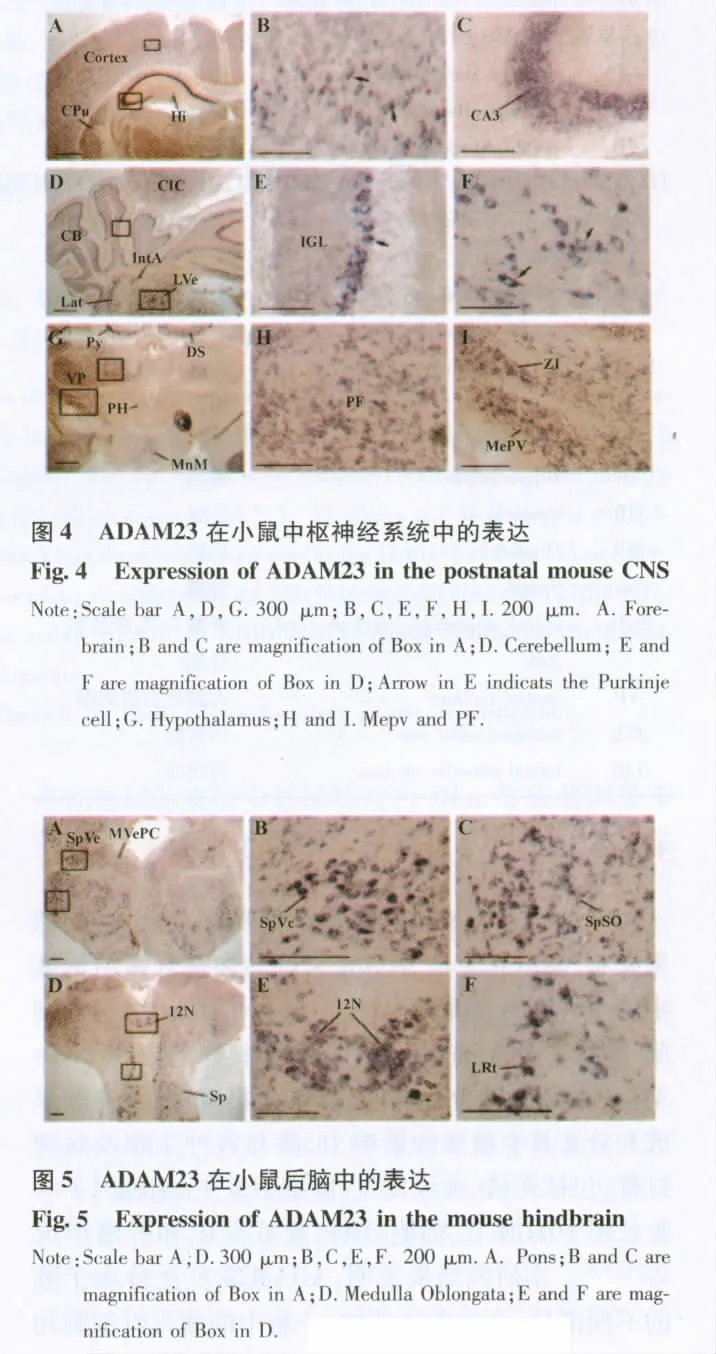
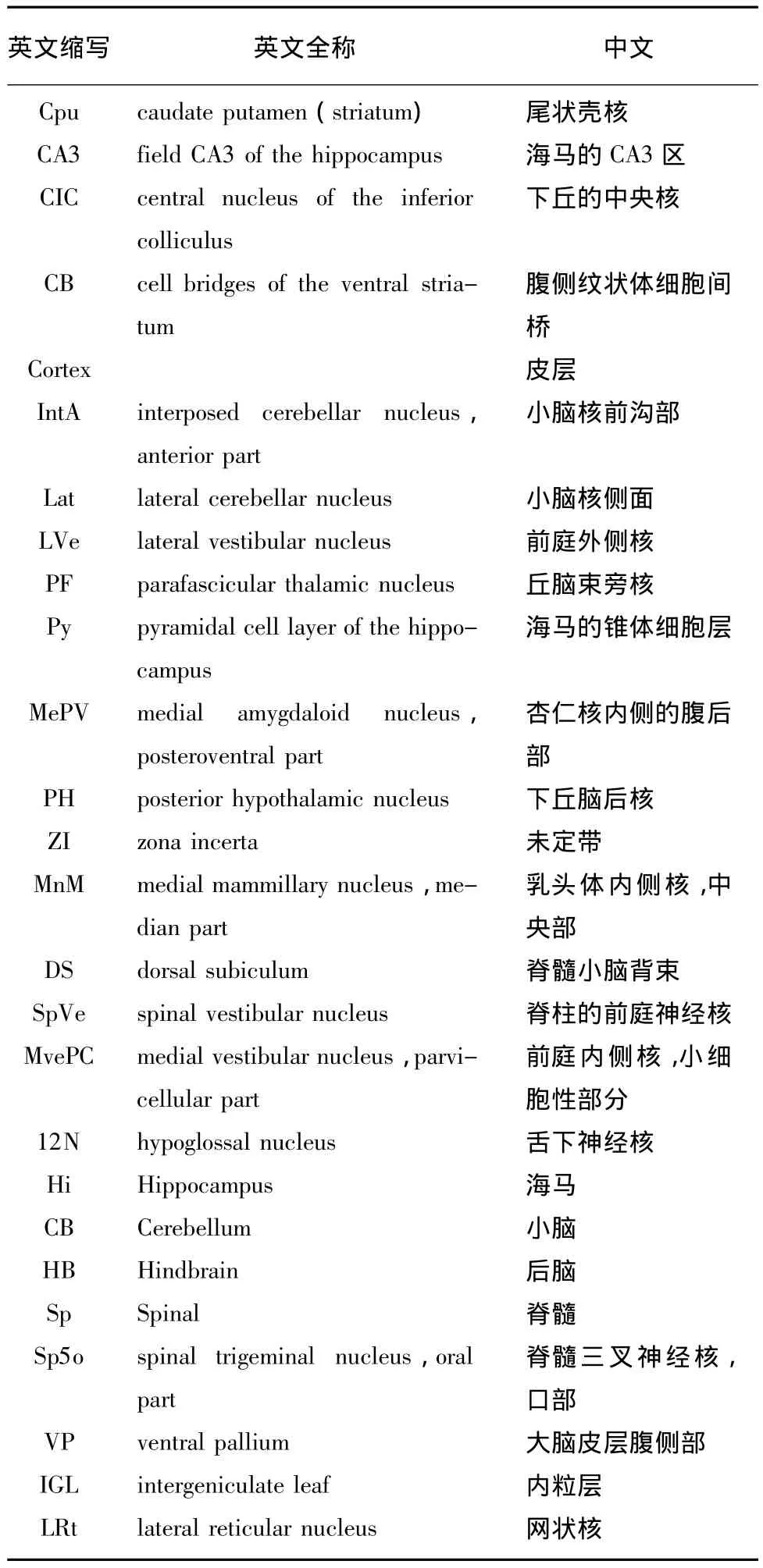
表1 圖4、5中英文縮寫的中英文對照Tab.1 Abbreviations used in the figure 4 and 5
3 討論
ADAM家族成員具有復雜的功能,從已有的結果來看,ADAM23是ADAM家族的去整合素結構域中的一種細胞表面粘附分子,參與了細胞-細胞及細胞-基質的相互作用,從而影響細胞的遷移,ADAM23在細胞的分化、神經纖維聚集成束、軸突的形成和分叉具有極強的影響力,參與各種生理及病理過程,包括受精、神經發生、肌細胞發生、細胞因子和生長因子的加工、細胞遷移、炎癥反應和腫瘤形成等[16,17]。本研究結果表明,ADAM23 廣泛分布于腦的不同部分,而在海馬結構、小腦中的浦肯野細胞和基底神經節則具有非常強的表達。這些部位在運動的反饋調節中有重要作用;從表達分布來看,ADAM23可能與大腦皮層、小腦內運動神經元回路的建立有關,小腦主要與大腦皮層的聯合活動和運動計劃的形成以及運動程序的編制有關,皮層內各種神經元細胞間有錯綜復雜的聯系,ADAM23極有可能通過不同的整合素或其他配體整合,使各種神經元之間建立聯系。這與 Goldsmith等[13]人的研究一致。
ADAM23高表達的部分都是神經纖維密集的部分,紋狀體是基底核的一個部分,基底核參與對隨意運動的調節,和中樞神經系統各個部分有廣泛的纖維聯系;海馬體由海馬通路的纖維向外側集中而形成;小腦主要協調骨骼肌的運動,維持和調節肌肉的緊張,保持身體的平衡;腦干是維持個體生命特征,包括心跳、呼吸、消化、體溫、睡眠等重要生理功能,ADAM23在這些部位的高表達說明,ADAM23除了分布于神經細胞胞體,還可能通過胞漿運輸到軸突、樹突中發揮功能;ADAM23在不同神經元突起的分布有差異,提示ADAM23可能在突起進一步分化成軸突、樹突等過程中發揮作用;上述形態特征和文獻報道的結果吻合[12,13]。
本課題組盡管對其生物學特性、產物特性和在神經發育過程中的作用進行了研究,但進一步弄清其詳細的作用機制、作用途徑和其他生物學功能以及其在神經發育階段所扮演的角色,將是今后所要解決的問題。
1 Wolfsberg T G,Straight P D,Gerena R L et al.ADAM,a widely distributed and developmentally regulated gene family encoding membrane proteins with a disintegrin and metalloprotease domain [J].Dev Biol,1995;169:378-383.
2 Seals D F,Courtneidge S A.The ADAMs family of metalloproteases:multidomain proteins with multiple functions[J].Genes Dev,2003;17:7-30.
3 Cho C,Bunch D O,Faure J E et al.Myles DG.Fertilization defects in spermfrom mice lacking fertilin beat[J].Science,1998;281:1857-1859.
4 Evens J E.Fertilin beta and other ADAMs as integrin ligands:insights into cell adhesion and fertilization[J].Bioessays,2001;23:628-639.
5 Jury J A,Frayne J,Hall L.The human fertilin alpha gene is non functional:Implications for its proposed role in fertilization[J].Biochemical J,1997;321:577-581.
6 Vidaeus C M,vonKapHerr C,Golden W L et al.Human fertilin beta:Identification,characterization,and chromosomal mapping of an ADAM gene family member[J].Molecular Reproduction and Development,1997;46:363-369.
7 Takako Y H,Tomomi S,Tomohiro K et al.A metalloprotease-disintegrin participating in myoblast fusion[J].Nature,1995;377:652-656.
8 Novak U.ADAM proteins in the brain[J].J Clin Neurosci,2004;11:227-235.
9 Sagane K,Yumazak Y,Mizai et al.Cloning and chromosomal mapping of mouse A DAM 11,ADA M22 and ADAM 23[J].Gene,1999;236:79-86.
10 Mitchell K J,Pinson K I,Kelly O J et al.Functional analysis of secreted and transmembrane proteins critical to mouse development[J].Nature Genetics,2001;28:241-249.
11 Rybnikova E,Karkkainen M,Pelto-Huikko et al.Developmental regulation and neuronal expression of the cellular disintegrin ADAM11 gene in mouse nervous system[J].Neuroscience,2002;112(4):921-934.
12 Sagane K,Ohya Y,Haseguwa Y et al.Metalloproteinase-like,disintegrin-like,cysteine-rich proteins MDC2 and MDC3:novel human cellular disintegrins higlly expressed in the brain[J].Biochemical Journal,1998;334:93-98.
13 Goldsmith A P,Gossage S J,ffrench-Constant.ADAM23 is a cellsurface glycoprotein expressed by central nervous system neurons[J].Neurosci Res,2004;78:647-658.
14 Ishimitsu T,Nishikimi T,Saito Y et al.Plasma levels of adrenomeduIIin,a newIy identified hypotensive peptide,in patients with hypertension and renal failure[J].Clin Invest,1994;94(5):2158-2161.
15 Redies C,Engelhart K,Takeichi M .Differential expression of N-and R-cadherin in functional neuronal systems and other structures[L5]of the developing chicken brain[J].Comp Neurol,1993;333:398-416.
16 Zolkiewska A.DisIntegrin-like cysteine-rich region of ADAM 12 is an active cell adhesion domain[J].Experimental Cell Research,1999;252(2):423-431.
17 Huet C,Li Z F,Liu H Z et al.Skeletal muscle cell hypertrophy induced by inhibitors of metalloproteases;myostatin as a potential mediator[J].Am J Physiol Cell Physiol,2001;28l(5):1624-1634.

