應(yīng)用聚偏氟乙烯-絲氨酸進(jìn)行血液灌流治療膿毒癥的實(shí)驗(yàn)研究
李 寧 周煥玉 張媛媛 周 巖 徐 放
河北大學(xué)附屬醫(yī)院重癥醫(yī)學(xué)科,河北保定 071000
內(nèi)毒素血癥是造成膿毒癥的一個(gè)重要原因,血液中的內(nèi)毒素(lipopolysaccharides,LPS)促使補(bǔ)體活化和腫瘤壞死因子 α(tumor necrosis factor-α,TNF-α)、白細(xì)胞介素-1β(interleukin-1β,IL-1β)等多種促炎介質(zhì)釋放,后者導(dǎo)致嚴(yán)重的外周血管阻力降低,低血壓和微循環(huán)障礙最終發(fā)展為組織缺血缺氧、休克和多器官功能衰竭[1]。筆者前期的動(dòng)物實(shí)驗(yàn)證實(shí),應(yīng)用聚偏氟乙烯-絲氨酸(PVDF-Ser)進(jìn)行血液灌流,可有效清除膿毒癥豬的血漿LPS,降低TNF-α和白細(xì)胞介素-6(interleukin-6,IL-6),最終降低72 h死亡率[2]。本研究旨在進(jìn)一步證實(shí)其對(duì)感染性休克的血流動(dòng)力學(xué)影響。
1 材料與方法
1.1 實(shí)驗(yàn)材料
1.1.1 實(shí)驗(yàn)動(dòng)物及分組 大長(zhǎng)種家豬16只,雄性,體重(22.3±3.5)kg,由河北大學(xué)動(dòng)物實(shí)驗(yàn)中心提供。依據(jù)隨機(jī)數(shù)字表分為兩組:PVDF-Ser組(E 組)8 只,LPS 給藥完成后 1 h,應(yīng)用PVDF-Ser吸附膜進(jìn)行血液灌流2 h,血流速50 mL/min;對(duì)照組(C組)8只,應(yīng)用空白灌流器(容積與PVDF-Ser相同)進(jìn)行血液灌流2 h。
1.1.2 實(shí)驗(yàn)試劑 內(nèi)毒素 (LPS from Escherichia coli 0111:B4,L2630)由SIGMA公司提供,鱟試劑由福建省廈門市鱟試劑實(shí)驗(yàn)廠提供,檢測(cè) IL-1β、白細(xì)胞介素-8(interleukin-8,IL-8)、白細(xì)胞介素-10(interleukin-10,IL-10)和高遷移率組蛋白-1(high-mobility group box-1 protein,HMGB-1)的 ELISA試劑盒由Bluegene公司提供。
1.1.3 實(shí)驗(yàn)設(shè)備 蠕動(dòng)泵由河北省保定市蘭格恒流泵有限公司提供(型號(hào)BT01-100),Servo300 型呼吸機(jī)由瑞典SIMENS公司提供,PiCCO由德國(guó)PULSION公司提供。
1.1.4 PVDF-Ser吸附膜 由浙江大學(xué)工學(xué)院合成提供(專利號(hào)200910100567.5),容積80 mL,有效吸附面積為4 830 cm2。
1.2 實(shí)驗(yàn)步驟
1.2.1 麻醉:首先給予氯胺酮5mg/kg+咪達(dá)唑侖0.5mg/kg肌肉注射,然后咪達(dá)唑侖 6 mg/(kg·h)+芬太尼 60 μg/(kg·h)靜脈泵入維持。
1.2.2 所有動(dòng)物均行經(jīng)口氣管插管,機(jī)械通氣[容量控制模式:潮氣量6 mL/kg,頻率25次/min,吸入氧濃度 100%,呼氣末正壓 0 cm H2O(1 cm H2O=0.098 kPa)]。
1.2.3 兩側(cè)頸外靜脈穿刺置管用于血液灌流;右側(cè)頸內(nèi)靜脈置入單腔深靜脈導(dǎo)管,連接溫度感知探頭;左側(cè)股動(dòng)脈置入PiCCO動(dòng)脈溫度壓力導(dǎo)管;左側(cè)股靜脈置入雙腔深靜脈導(dǎo)管,用于注射LPS、輸注液體和采集血樣。
1.2.4 復(fù)制內(nèi)毒素致感染性休克模型:LPS持續(xù)靜脈泵入4 h,劑量 1 μg/(kg·h)[3]。 開始注射 LPS 后,輸注 0.9%的氯化鈉溶液 30 mL/(kg·h)。
1.3 血液標(biāo)本采集、保存和檢測(cè)
分別于注射LPS前和完成注射后即刻、1、2、3、4 h采集血樣,依次記為T0~T5。標(biāo)本立即在4℃的條件下離心3 000 g×10 min, 取血漿在-80℃條件保存。 測(cè)定 LPS、IL-1β、IL-8、IL-10 和 HMGB-1。
1.4 血流動(dòng)力學(xué)指標(biāo)的采集
分別于T0~T5測(cè)定有創(chuàng)平均動(dòng)脈壓 (mean arterial pressure,MAP)、中心靜脈壓(central venous pressure,CVP)、每搏輸出量指數(shù)(stroke volume index,SVI)、心排指數(shù)(cardiac index,CI)、體循環(huán)阻力指數(shù)(systemic vascular resistance index,SVRI)和全心舒張末期容量指數(shù) (global enddiastolic volume index,GEDVI)。
1.5 統(tǒng)計(jì)學(xué)方法
全部數(shù)據(jù)分析應(yīng)用SPSS 13.0統(tǒng)計(jì)軟件處理。計(jì)量資料以均數(shù)±標(biāo)準(zhǔn)差(±s)表示,組間基線數(shù)據(jù)的比較采用兩獨(dú)立樣本的t檢驗(yàn),實(shí)驗(yàn)中LPS、細(xì)胞因子和血流動(dòng)力學(xué)參數(shù)的變化采用重復(fù)測(cè)量數(shù)據(jù)的方差分析。以P<0.05 為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 內(nèi)毒素及細(xì)胞因子水平
組間基線數(shù)據(jù)比較均無(wú)差異(P>0.05)。注射LPS后,內(nèi)毒素均明顯升高,組間比較無(wú)差異(P=0.089);此后,內(nèi)毒素水平均呈下降趨勢(shì),但開始血液灌流后E組顯著低于C組。IL-1β、IL-8、IL-10 和HMGB-1 在注射LPS后均顯著增高,C組的升高趨勢(shì)持續(xù)到LPS注射結(jié)束后2 h,此后變?yōu)榫徛陆担欢鳨組在開始血液灌流后即明顯降低,顯著低于C組,IL-10 在結(jié)束灌流后1 h已接近實(shí)驗(yàn)前水平(P=0.132)。見表1。
2.2 血流動(dòng)力學(xué)參數(shù)
兩組基線數(shù)據(jù)比較差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。給予LPS 后,兩組動(dòng)物出現(xiàn) MAP、CVP、SVI、SVRI和 GEDVI下降,CI則先升高后降低,符合感染性休克的典型改變。與C組相比,E 組行血液灌流后,MAP、SVI、CI、SVRI和 GEDVI均有顯著改善,這種效應(yīng)持續(xù)到灌流結(jié)束后1 h。而CVP僅在血液灌流 2 h 后略有升高[(3±1) mm Hg vs (2±1) mm Hg,P=0.017](1mmHg=0.133kPa)。與灌流前比較,E組中除CI在灌流2 h后回升、CVP無(wú)改善外,其他參數(shù)均在開始灌流1 h后即呈升高表現(xiàn);而C組的多項(xiàng)指標(biāo)呈進(jìn)行性惡化趨勢(shì)。見表2。
3 討論
LPS作為革蘭陰性細(xì)菌的外層細(xì)胞壁的重要組成部分,當(dāng)菌體繁殖或死亡后,其以游離形式或與菌體表層蛋白結(jié)合的形式釋放。與血漿LPS結(jié)合蛋白 (LPS-binding protein,LBP)形成復(fù)合物,到達(dá)粒單核細(xì)胞膜CD14分子(membrane CD14,mCD14)或與可溶性 CD14 分子(soluble CD14,sCD14)結(jié)合,sCD14/LPS復(fù)合物則進(jìn)一步結(jié)合到CD14-的血管內(nèi)皮細(xì)胞、上皮細(xì)胞。在跨膜蛋白Toll-like receptor家族(TLR),尤其是TLR4的作用下,依次募集調(diào)節(jié)分子MyD88 和IL-1 受體相關(guān)激酶實(shí)現(xiàn)LPS信號(hào)從mCD14 到胞質(zhì)的轉(zhuǎn)導(dǎo)。然后通過(guò)核因子κB途徑或氨基末端激酶/應(yīng)激活化蛋白激酶途徑造成細(xì)胞活化,大量炎癥基因表達(dá),多種促炎和抗炎因子合成釋放,從而導(dǎo)致嚴(yán)重而失控的全身性炎癥反應(yīng),進(jìn)一步發(fā)展為感染性休克、多器官功能障礙綜合征[4-5]。正是基于內(nèi)毒素作為膿毒癥、感染性休克發(fā)生進(jìn)展的始動(dòng)和關(guān)鍵環(huán)節(jié)的認(rèn)識(shí),近年來(lái)大量研究證實(shí),應(yīng)用多黏菌素B等多種內(nèi)毒素吸附劑進(jìn)行血液灌流,可以有效清除血漿內(nèi)毒素,控制炎癥介質(zhì)水平,從而改善血流動(dòng)力學(xué)紊亂和組織灌注,減輕氧化應(yīng)激和呼吸氧合異常,最終降低膿毒癥病死率[6-8]。筆者前期的動(dòng)物實(shí)驗(yàn)證實(shí)應(yīng)用PVDF-Ser進(jìn)行血液灌流,可以有效吸附膿毒癥豬的血漿LPS,進(jìn)而降低TNF-α和IL-6 水平,減輕肺、肝、腸等器官損傷,最終降低實(shí)驗(yàn)組死亡率[2]。
血漿吸附、血液濾過(guò)等多種血液凈化措施用于治療膿毒癥和MODS的機(jī)制研究不斷深入,其中“峰值濃度學(xué)說(shuō)”認(rèn)為發(fā)生膿毒癥時(shí)機(jī)體免疫反應(yīng)處于完全混亂的狀態(tài),促炎和抗炎介質(zhì)的峰值濃度可同時(shí)或先后出現(xiàn),血液凈化是非選擇性清除這兩類炎癥介質(zhì),降低促炎介質(zhì)的峰值濃度,減少其對(duì)內(nèi)皮細(xì)胞和血流動(dòng)力學(xué)的影響;降低抗炎介質(zhì)的峰值濃度,保持了細(xì)胞對(duì)內(nèi)毒素血癥反應(yīng)性,恢復(fù)了機(jī)體的免疫能力[9]。Shimizu等[6]和Takwmi等[10]的臨床研究動(dòng)物實(shí)驗(yàn)結(jié)果均證實(shí)了如上觀點(diǎn)。本次實(shí)驗(yàn)發(fā)現(xiàn)PVDF-Ser吸附膜在清除血漿LPS的基礎(chǔ)上,不僅有效控制IL-1β、IL-8的異常升高,亦可降低抗炎因子IL-10的血漿水平,從而重建機(jī)體的免疫穩(wěn)態(tài),提高 MAP、SVI、SVRI和 GEDVI,進(jìn)一步驗(yàn)證了以上假說(shuō)和解釋了PVDF-Ser改善血流動(dòng)力學(xué)紊亂的機(jī)制。
表1 血漿內(nèi)毒素和細(xì)胞因子變化(±s)
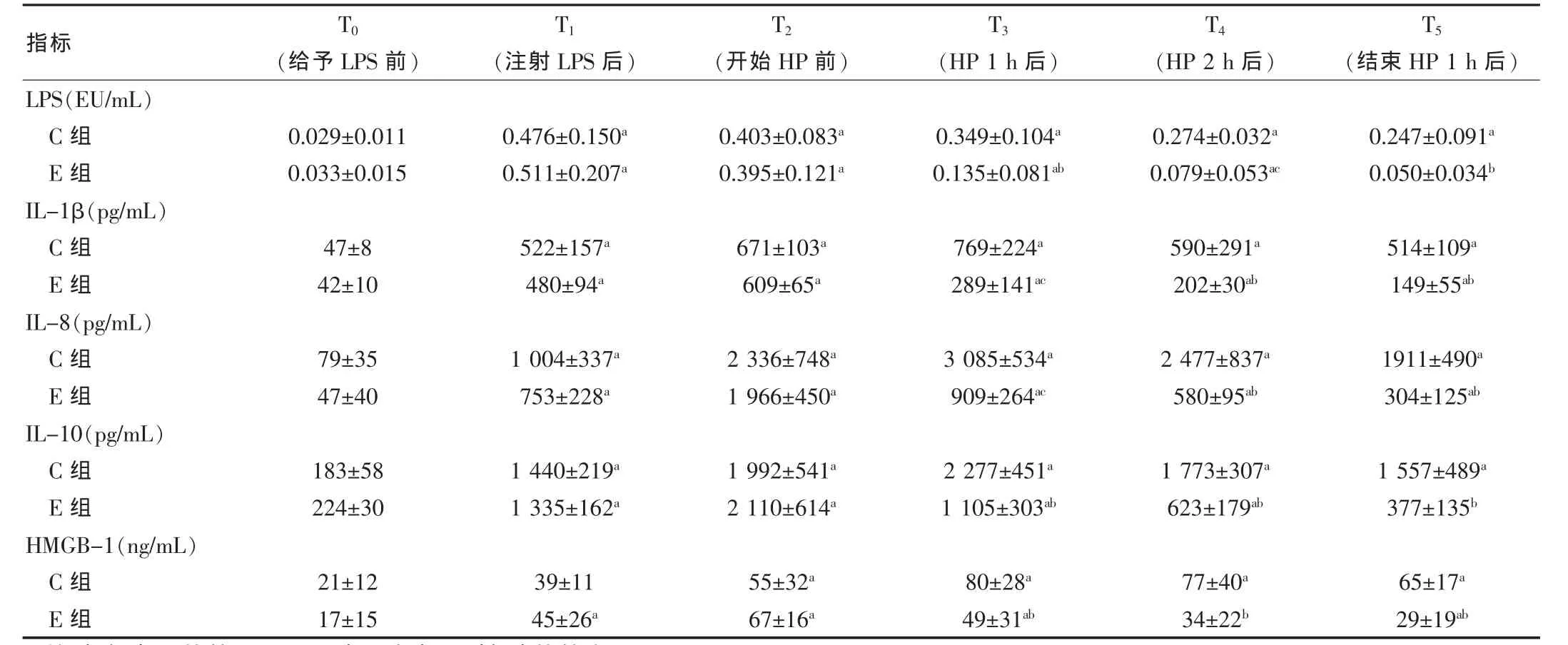
表1 血漿內(nèi)毒素和細(xì)胞因子變化(±s)
注:與組內(nèi)T0 比較,aP<0.05;與C組相同時(shí)間點(diǎn)比較,bP<0.05,cP<0.01
指標(biāo) T0(給予LPS前)T1T2T3T4T5(注射LPS后) (開始HP前) (HP 1 h后) (HP 2 h后) (結(jié)束HP 1 h后)LPS(EU/mL)C組E組IL-1β(pg/mL)C組E組IL-8(pg/mL)C組E組IL-10(pg/mL)C組E組HMGB-1(ng/mL)C組E組0.029±0.011 0.033±0.0150.476±0.150a 0.511±0.207a 0.403±0.083a 0.395±0.121a 0.349±0.104a 0.135±0.081ab 0.274±0.032a 0.079±0.053ac 0.247±0.091a 0.050±0.034b 47±8 42±10 522±157a 480±94a 671±103a 609±65a 769±224a 289±141ac 590±291a 202±30ab 514±109a 149±55ab 79±3547±40 1 004±337a 753±228a 2 336±748a 1 966±450a 3 085±534a 909±264ac 2 477±837a 580±95ab 1911±490a 304±125ab 183±58 224±30 1 440±219a 1 335±162a 1 992±541a 2 110±614a 2 277±451a 1 105±303ab 1 773±307a 623±179ab 1 557±489a 377±135b 21±12 17±1539±11 45±26a 55±32a 67±16a 80±28a 49±31ab 77±40a 34±22b 65±17a 29±19ab
表2 血流動(dòng)力學(xué)參數(shù)變化(±s)
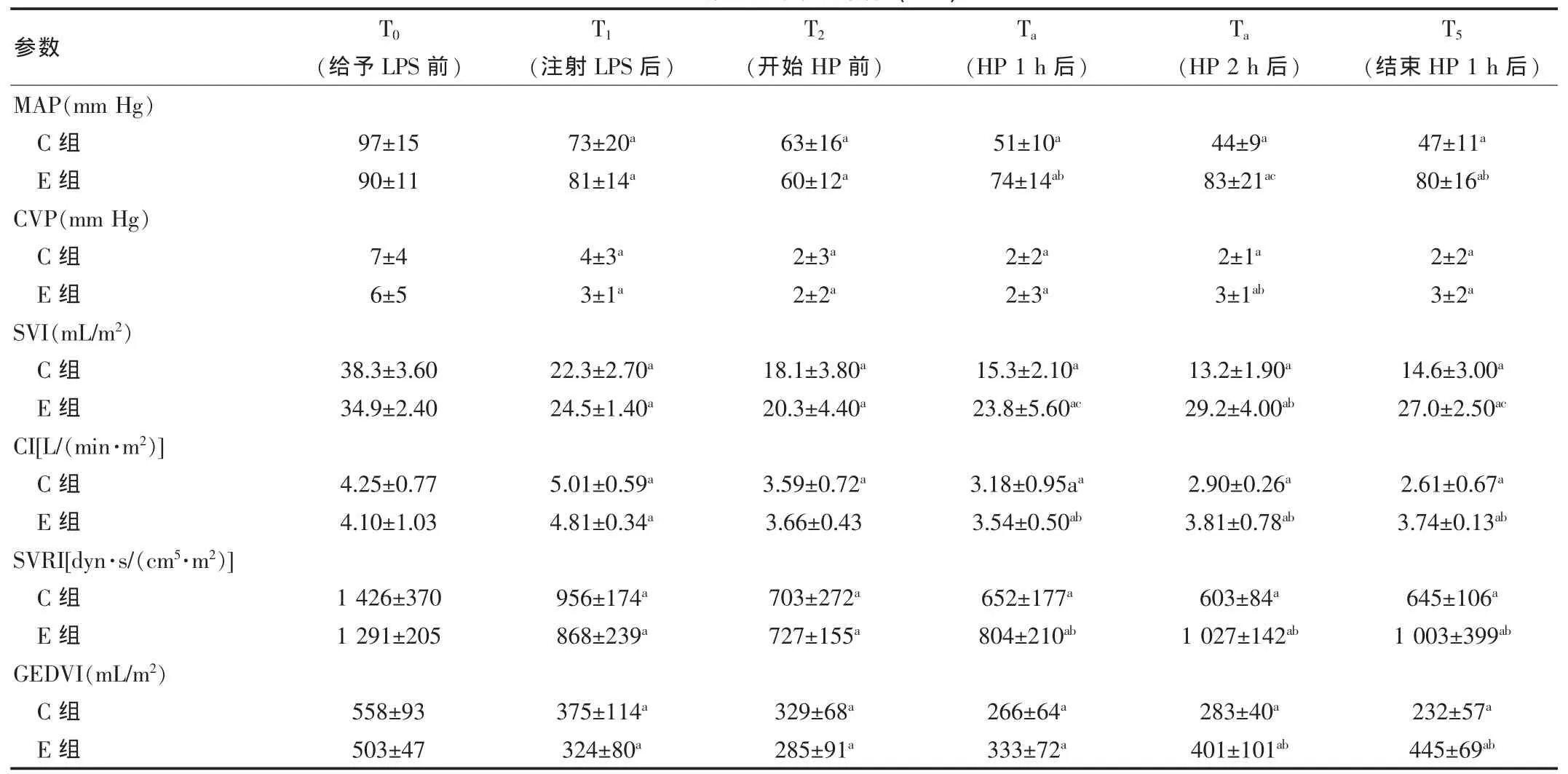
表2 血流動(dòng)力學(xué)參數(shù)變化(±s)
注:與組內(nèi)T0 比較,aP<0.05;與C組相同時(shí)間點(diǎn)比較,bP<0.05,cP<0.01
參數(shù) T0(給予LPS前)T1T2Ta Ta T5(注射LPS后) (開始HP前) (HP 1 h后) (HP 2 h后) (結(jié)束HP 1 h后)MAP(mm Hg)C組E組CVP(mm Hg)C組E組SVI(mL/m2 )C組E組CI[L/(min·m2 )]C組E組SVRI[dyn·s/(cm5 ·m2 )]C組E組GEDVI(mL/m2 )C組E組97±1590±11 73±20a 81±14a 63±16a 60±12a 51±10a 74±14ab 44±9a 83±21ac 47±11a 80±16ab 7±4 6±54±3a 3±1a 2±3a 2±2a 2±2a 2±3a 2±1a 3±1ab 2±2a 3±2a 38.3±3.60 34.9±2.40 22.3±2.70a 24.5±1.40a 18.1±3.80a 20.3±4.40a 15.3±2.10a 23.8±5.60ac 13.2±1.90a 29.2±4.00ab 14.6±3.00a 27.0±2.50ac 4.25±0.77 4.10±1.03 5.01±0.59a 4.81±0.34a 3.59±0.72a 3.66±0.43 3.18±0.95aa 3.54±0.50ab 2.90±0.26a 3.81±0.78ab 2.61±0.67a 3.74±0.13ab 1 426±370 1 291±205956±174a 868±239a 703±272a 727±155a 652±177a 804±210ab 603±84a 1 027±142ab 645±106a 1 003±399ab 558±93 503±47 375±114a 324±80a 329±68a 285±91a 266±64a 333±72a 283±40a 401±101ab 232±57a 445±69ab
現(xiàn)已證實(shí),HMGB-1 在內(nèi)毒素血癥和嚴(yán)重膿毒癥的病生理過(guò)程中扮演晚發(fā)炎癥介質(zhì)的重要角色,大量釋放可激活炎癥反應(yīng)、活化單核細(xì)胞和誘導(dǎo)內(nèi)皮細(xì)胞的黏附分子[11]。Yuichiro等[12]對(duì)20例感染性休克患者應(yīng)用多黏菌素B進(jìn)行血液灌流,發(fā)現(xiàn)與死亡組相比,存活組的HMGB-1 顯著改善,提示可能通過(guò)降低HMGB-1的途徑,糾正感染性休克的循環(huán)衰竭。筆者的研究顯示,血液灌流2 h后,E組HMGB-1 較灌流前顯著降低[(34±22)ng/mL vs(67±16)ng/mL,P=0.007],同時(shí)也明顯低于 C 組水平 [(34±22)ng/mL vs (77±40)ng/mL,P=0.024]。表明PVDF-Ser可能通過(guò)清除血漿HMGB-1 控制炎癥反應(yīng)和改善血流動(dòng)力學(xué)紊亂。
近來(lái),大量動(dòng)物實(shí)驗(yàn)和臨床研究報(bào)道了多種內(nèi)毒素和炎癥介質(zhì)吸附治療在膿毒癥、感染性休克和MODS中的積極影響,提示未來(lái)它可能成為膿毒癥的重要治療手段[13]。筆者的實(shí)驗(yàn)進(jìn)一步證實(shí)了PVDF-Ser通過(guò)清除HMGB-1 和非選擇性清除促炎、抗炎介質(zhì)的機(jī)制,在調(diào)節(jié)失控的嚴(yán)重炎癥反應(yīng)和糾正血流動(dòng)力學(xué)紊亂方面的有效作用,不失為膿毒癥和感染性休克血液灌流的有益嘗試。
[1] Ismail Cinel.Molecular biology of inflammation and sepsis:A primer[J].Crit Care Med,2009,37(1):291-304.
[2] 李寧,徐秋萍,黃曼,等.應(yīng)用聚偏氟乙烯-絲氨酸吸附膜血液灌流治療豬膿毒血癥的實(shí)驗(yàn)研究[J].中國(guó)急救醫(yī)學(xué),2010,6:524-527.
[3] Miklós Lipcsey,Anders Larsson,Mats BE,et al.Inflammatory,coagulatoryandcirculatoryresponsestologarithmicincreasesinthe endotoxindose in the anaesthetised pig[J].Journal of Endotoxin Research,2006,12(2):99-112.
[4] Didier H,Thierry R.Initial responses to endotoxins and Gram-negative bacteria[J].Clinica Chimica Acta,2002,323:59-72.
[5] Kensuke M.Innate recognition of lipopolysaccharide by Toll-like receptor 4–MD-2 Innate recognition of lipopolysaccharide by Toll-like receptor 4–MD-2[J].TRENDS in Microbiology,2004,12(4):186-192.
[6] Shimizu T,Hanasawa K,Sato K,et al.Direct hemoperfusion with polymyxin-B-immobilized fiber columns improves septic hypotension and reduces inflammatory mediators in septic patients with colorectal perforation[J].Langenbecks Arch Surg,2009,394(2):303-311.
[7] Kushi H,Miki T,Sakagami Y,et al.Early hemoperfusion with a polymyxin b column improves gastric intramucosal pH in sepsis[J].Ther Apher Dial,2008,12(4):278-284.
[8] Taniguchi T,Kurita A,Yamamoto K,et al.Comparison of a cytokine adsorbing column and an endotoxin absorbing column for the treatment of experimental endotoxemia[J].Transfus Apher Sci,2009,40(1):55-59.
[9] Ciro T,Rinaldo B,Paola I,et al.Endotoxin and cytokine removal in sepsis[J].Therapeutic Apheresis,2002,6(2):109-115.
[10] Takumi T,F(xiàn)umiyasu H,Yasuhiro T,et al.A novel adsorbent of circulating bacterial toxins and cytokines:The effect of direct hemoperfusion with CTR column for the treatment of experimental endotoxemia[J].Crit Care Med,2006,34(3):800-806.
[11] Wang H,Bloom O,Zhang M,et al.HMGB-1 as a late mediator of endotoxin lethality in mice[J].Science,1999,285:248-251.
[12] Yuichiro S,Kunihiro M,Hisashi M,et al.Relationship between effect of polymyxin b-immobilized fiber and high-mobility group box-1 protein in septic shock patients[J].ASAIO Journal,2007,53:324-328.
[13] Taniguchi T.Cytokine adsorbing columns[J].Contrib Nephrol,2010,166:134-141.

