血清CEA水平與EGFR-TKI治療晚期非小細胞肺癌的預后相關性分析
樊志明 黃超紅 鄭宏瑩 賀鴻桂
在世界范圍內,肺癌是導致人類死亡的最大的惡性腫瘤之一。傳統的系統化療是治療非小細胞肺癌的主要治療方法,雖然這類方法對患者生存時間有一定的緩解作用,但是,對于中晚期非小細胞肺癌其治療療效差,近年來研究發現,分子靶向藥物治療對非小細胞肺癌有較好的治療效果。分子靶向藥物表皮生長因子受體絡氨酸激酶受體抑制劑(EGFR-TKI),其主要為厄洛替尼以及吉非替尼,其在進展以及復發性非小細胞肺癌中均有良好的抗腫瘤作用[1]。現階段研究證明對于EGFR突變與治療效果有一定的相關性,但由于對EGFR突變的檢測對醫院實驗室的要求復雜,從而難以在臨床中得到有效的運用。在本臨床研究中,我們對患者治療前CEA水平與患者EGFR-TKI治療的療效進行分析,并對患者進行生存分析,以探討患者CEA水平與患者預后的相關性,并擬說明血清CEA是否可作為EGFR-TKI治療療效的一重要指標。報道如下。
1 資料與方法
1.1 一般資料 對我院2008年2月至2011年1月收治的住院以及門診的晚期非小細胞肺癌患者121例作為研究對象,其來自呼吸科21例以及腫瘤科100例。患者均為Ⅲ~Ⅳ期非小細胞肺癌,納入本臨床研究的患者均經支氣管鏡活檢并進行病理確診。其中男61例,女60例;年齡31~72歲,平均年齡(61±12)歲。對其進行組織學型WHO分類標準,其中腺癌82例,非腺癌39例;吸煙患者41例,非吸煙患者80例,臨床分期采用2009年國際抗癌聯盟所制定的肺癌國際分期法[2]進行,其中ⅢA期11例,ⅢB其10例,Ⅳ期100例。對所有患者均進行常規胸部、頭部以及腹部CT檢查,以及進行全省骨掃描檢查。排除標準:患者接受1個周期以及以上化療、手術以及放療;患者無嚴重的肝腎功能、血常規、心電圖異常。
1.2 治療方法 對本臨床研究患者在接受時,給予其吉非替尼,1片/d,直到患者腫瘤進展或者難以耐受時停藥。同時給予患者常規聯合局部放療。并對患者每月進行腹部B超、腦部以及胸部CT檢查并記錄轉移灶大小以及范圍,并對患者進行長期隨訪,對本研究的所有患者均隨訪至2012年1月30日,或者隨訪至患者死亡。
1.3 血清CEA檢測 對本臨床研究的所有患者均在治療前以及接受化療2療程后收集清晨空腹靜脈血5 ml,并對其進行2 500 r/min的離心10 min,而后分離上清液,并將其放置-20℃的環境保持,待積滿10份標本時進行檢測。在本臨床研究中,我們對患者采用電化學發光免疫側低昂法進行測定,試劑以及分析儀均由美國雅培公司提供,同時所有操作均嚴格執行儀器以及試劑使用說明書進行。在本臨床研究中,我們將Roche作為質控液。并參照文獻,將50μg/L作為分界線。
1.4 療效評價 對患者在服用吉非替尼后療效采用骨掃描、胸腹部CT掃描以及頭部CT和磁共振作為參照,并按照RECIST的標準進行評價,其中將部分緩解(PR)、完全緩解(CR)作為療效有效,將穩定(SD)作為病情穩定,以及進展(PD)作為病情惡化[3]。并與無法通過影像學判斷的患者,結合患者的臨床表現結合相關生化指標,并由2名以上腫瘤學高級職稱的醫師進行評價。
1.5 統計學分析 應用SPSS 14.0統計軟件,等級資料采用秩和檢驗,并對生存時間采用log-rank檢驗,同時采用COX比例風險模型對患者進行多因素生存分析,P<0.05為差異有統計學意義。
2 結果
2.1 患者服藥后臨床表現 所有患者均至少服藥1個月,服藥后主要臨床不良癥狀為皮疹、厭食、惡心以及嘔吐等(表1)。服藥后不良反應主要為消化道反應,如腹瀉等,對其采用甲地孕酮及黃連素對癥治療后,患者有不同程度的緩解,從而不對其進行停藥處理,出現皮疹的患者以丘疹為主要表現,面部居多,但瘙癢不嚴重及癥狀較輕,從而不需要處理。所有患者在每個化療周期結束后行心電圖、肝腎功能以及血常規檢查,均表現正常。對患者行胸部CT檢查提示其未發現新的肺間質病變。
2.2 晚期非小細胞肺癌患者的一般資料構成以及其采用吉非替尼治療療效 無吸煙史的患者其采用吉非替尼治療更加有效,不同CEA水平的患者其采用吉非替尼治療后其臨床療效差異有統計學意義(P<0.05);其他臨床體征差異無統計學意義(P >0.05)。見表2。

表1 患者的不良反應 例
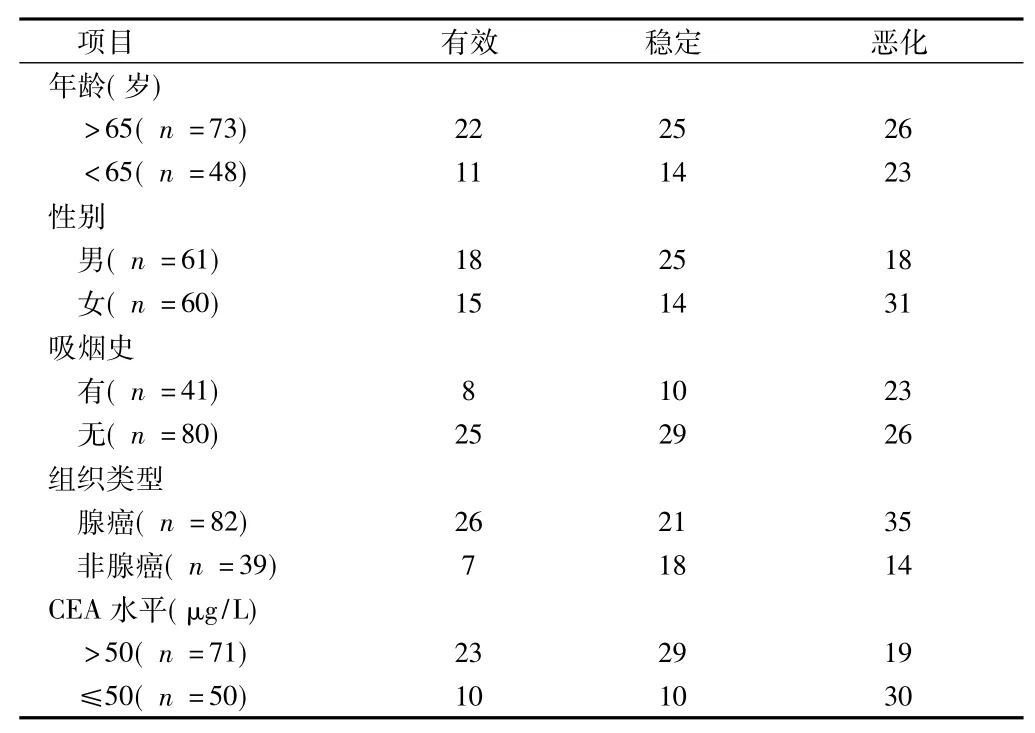
表2 吉非替尼治療有效、穩定以及惡化患者的臨床病理特征比較例
2.3 疾病無進展時間(PFS)分析 男性、女性平均PFS比較差異均無統計學意義(P>0.05)。在對病理類型比較中,女性腺癌患者的PFS雖然高于女性鱗癌以及高于男性腺癌,但差異無統計學意義(P>0.05),而與男性鱗癌比較,差異有統計學意義(P <0.05)。見表3。

表3 吉非替尼治療后PFS與患者的性別相關性分析 月
2.4 對CEA水平與患者的PFS的進展比較 CEA高水平的患者其生存率明顯高于低水平的患者(χ2=36.750,P=0.0000)。見表 4。

表4 2組患者PFS進展比較 例
2.5 對患者的年齡、性別、組織學類型、吸煙史以及CEA水平進行COX多因素生存分析 結果提示晚期非小細胞肺癌患者服用吉非替尼后CEA以及組織學類型可為其獨立因子。見表5。

表5 采用吉非替尼治療后進行COX多因素生存分析
3 討論
肺癌分子靶向治療其常用靶點主要是細胞受體、遺傳標志物以及腫瘤血管等,現階段研究中主要將EGFR作為其靶點,Sun等[4]研究表明,其作為Erb B家族的一主要成員,其由細胞內區、細胞外區以及跨膜區構成,當其一旦與配體相結合,其將在細胞表面形成受體的異源二聚體或者同源二聚體,從而在肺癌發生發展中發揮重要作用。
Tsai等[5]對EGFR的研究表明其在上皮來源的腫瘤細胞中表達,如:乳腺癌以及非小細胞肺癌等。而在肺癌個組織中,鱗癌的EGFR表達最高,其陽性率高達80%,其次為腺鱗癌以及腺癌,其陽性率為30% ~50%。Yusuf等[6]對EGFR的研究發現,其不但為細胞增殖有一定的調控作用,而且其對腫瘤的進展、血管的生成以及癌細胞的轉移擴散等均有關鍵性作用,而過度表達的EGFR對化療以及放療均不敏感,從而容易發生遠處轉移,繼而導致其預后不良。針對EGFR的這一特性,現階段多種藥物以其作為靶點,并在實驗以及臨床運用中均有較為理想的療效。吉非替尼作為EGFR絡氨酸激酶的一可逆性抑制劑,其是第一種運用于治療非小細胞肺癌EGFR酪氨酸激酶的抑制劑。Togashi等[7]對其臨床研究發現,其對晚期肺癌的緩解率高達10%~19%,表明其對非小細胞肺癌的治療中的療效,同時可顯著提高患者的生活質量。在本臨床研究中,我們發現,患者的治療效果較為理想,而且由于吉非替尼可通過血腦屏障,從而對腦轉移有良好的治療效果,林云笑等[8]報道相似。在對患者不良反應的研究中,我們發現其常見的不良反應為皮膚瘙癢、腹瀉、惡心以及皮疹,但其均為I~Ⅱ度,從而不影響患者治療。Nagano等[9]對吉非替尼治療與EGFR基因突變的研究發現,對于19、21外限制特點位點發生突變的患者其治療顯著,故表明對于EGFR基因突變的患者采用吉非替尼進行治療具有良好的臨床療效。但由于對EGFR基因檢測較為復雜,部分醫療機構不能達到檢測其的水平以及技術。故在本臨床研究中,我們對CEA進行檢測,并擬說明其對患者的影響。本臨床研究表明血清CEA水平可作為預測晚期肺癌患者采用吉非替尼治療的療效的標記物,Won等[10]研究發現,血清CEA水平可作為晚期非小細胞肺服用EGFR-TKI治療療效的預測指標。而血清CEA的檢測具有方法簡單、技術成熟以及快捷、定量以及可重復等優點,并可通過在治療期間對患者進行觀測血清中CEA水平進行評估療效。彭亮等[11]通過大樣本隨機雙盲臨床研究發現,CEA可作為腫瘤診斷以及鑒別其良惡性、預測患者復發情況具有較好的臨床運用價值。Hotta等[12]研究發現近65%的非小細胞肺癌患者其CEA水平升高,并以肺腺癌為主,而只有少部分肺鱗癌患者有升高。在本臨床研究中,我們對CEA水平的檢測與Kamiya等[13]報道相似,從而為CEA的臨床運用提供的更好的依據。Takakuwa等[14]研究發現血清CEA水平與患者EGFR的突變有密切相關性。在本臨床研究中,我們發現CEA表達高的患者其PFS較表達低的患者有明顯差異性(P<0.05),故我們認為對于CEA表達較高的患者采用吉非替尼進行治療,其預后優于低表達的患者。
總之,通過本臨床研究,我們認為CEA高表達的晚期非小細胞肺癌患者采用吉非替尼進行治療,其PFS明顯增長,從而提高了患者的存活時間,但現階段研究發現CEA高的患者發生腦轉移的風險將增加[15],故我們認為在采用吉非替尼進行治療過程中,CEA水平、吉非替尼以及腦轉移的風險的關系有待進一步探究。
1 李鋇,王燕,朱紅霞,等.外周血表皮生長因子受體蛋白濃度與吉非替尼治療晚期非小細胞肺癌療效的相關性.中華腫瘤雜志,2011,33:431-435.
2 顧愛琴,高志強,王慧敏,等.吉非替尼單藥治療晚期非小細胞肺癌老年患者的臨床分析.上海交通大學學報醫學版,2011,31:305-308.
3 朱青山,劉基巍,張春珍,等.吉非替尼聯合擇期放療治療晚期非小細胞肺癌的臨床研究.中國醫師進修雜志綜合版,2011,34:19-21.
4 Sun JM,Ahn JS,Lee S,et al.Predictors of skeletal-related events in nonsmall cell lung cancer patientswith bonemetastases.Lung Cancer,2011,71:89-93.
5 Tsai CM,Chen JT,Stewart DJ,et al.Antagonism between gefitinib and cisplatin in non-small cell lung cancer cells:why randomized trials failed?JThorac Oncol,2011,6:559-568.
6 Yusuf SW,Kim P,Durand JB:Erlotinib or gefitinib for non-small-cell lung cancer.N Engl JMed,2011,364:2367.
7 Togashi Y,Masago K,Fukudo M,etal.Efficacy of increased-dose erlotinib for central nervous system metastases in non-small cell lung cancer patientswith epidermal growth factor receptormutation.Cancer Chemother Pharmacol,2011,68:1089-1092.
8 林云笑,陳昌南,黃活勛.吉非替尼一線治療晚期非小細胞肺癌.中國醫師進修雜志內科版,2009,32:48-50.
9 Nagano T,Kotani Y,Kobayashi K,et al.Long-term outcome after multidisciplinary approach for leptomeningeal carcinomatosis in a non-small cell lung cancer patientwith poor performance status.Intern Med,2011,50:3019-3022.
10 Won YW,Han JY,Lee GK,et al.Comparison of clinical outcome of patientswith non-small-cell lung cancer harbouring epidermal growth factor receptor exon 19 or exon 21 mutations.JClin Pathol,2011,64:947-952.
11 彭亮,焦順昌,楊俊蘭.吉非替尼一線治療晚期非小細胞肺癌的療效和生存因素分析.現代腫瘤醫學,2011,19:1749-1753.
12 Hotta K,Kiura K,Tabata M,et al.Role of early serial change in serum carcinoembryonic antigen levels as a predictive marker for radiological response to gefitinib in Japanese patientswith non-small cell lung cancer.Anticancer Res,2007,27:1737-1741.
13 Kamiya K,Watanabe M,Kohno M,et al.KL-6 and CEA levels in epithelial lining fluid microsamples predict response to gefitinib in patients with advanced non-small cell lung cancer.Respirology,2011,16:976-982.
14 Takakuwa O,Oguri T,Sato S,et al.[Two cases of recurrent non-small cell lung cancer successfully treated with S-1 as fifth-line chemotherapy].Gan To Kagaku Ryoho,2009,36:1721-1724.
15 Kappers I,Vollebergh MA,van Tinteren H,et al.Soluble epidermal growth factor receptor(sEGFR)and carcinoembryonic antigen(CEA)concentration in patients with non-small cell lung cancer:correlation with survival after erlotinib and gefitinib treatment.Ecancermedicalscience2010,4:178.

