藥品GMP 檢查指南規范性研究
北京大學醫藥管理國際研究中心
屈浩鵬 俞堅靜 張鳳梅 張娟 李衛華 張如坤 宋然然 江濱 楊松
(接8 月下)
第四部 建立藥品GMP 檢查指南的行性分析
一、建立藥品GMP 檢查指南的法律法規依據
(一)行政許可法的規定
行政許可是指行政機關根據公民、法人或者其他組織的申請,準予其從事特定活動的行為。根據《中華人民共和國行政許可法》,對“直接涉及國家安全、公共安全、經濟宏觀調控、生態環境保護以及直接關系人身健康、生命財產安全等特定活動,需要按照法定條件予以批準的事項”,可以設定行政許可。因此,藥品監督管理部門對藥品生產企業的生產行為進行GMP 認證,符合《行政許可法》的規定。
(二)藥品管理法的規定
《中華人民共和國藥品管理法》第九條規定:藥品生產企業必須按照國務院藥品監督管理部門依據本法制定的《藥品生產質量管理規范》組織生產。藥品監督管理部門按照規定對藥品生產企業是否符合《藥品生產質量管理規范》的要求進行認證;對認證合格的,發給認證證書。《藥品生產質量管理規范》的具體實施辦法、實施步驟由國務院藥品監督管理部門規定。
第七十九條規定:藥品的生產企業未按照規定實施《藥品生產質量管理規范》的,給予警告,責令限期改正;逾期不改正的,責令停產、停業整頓,并處五千元以上二萬元以下的罰款;情節嚴重的,吊銷《藥品生產許可證》。
這是各級藥品監督管理部分依法制定、發布、實施《藥品生產質量管理規范》,并對未按規定實施《藥品生產質量管理規范》的企業進行處罰的合法依據。
(三)藥品管理法實施條例的規定
《中華人民共和國藥品管理法實施條例》第五條規定:省級以上人民政府藥品監督管理部門應當按照《藥品生產質量管理規范》和國務院藥品監督管理部門規定的實施辦法和實施步驟,組織對藥品生產企業的認證工作;符合《藥品生產質量管理規范》的,發給認證證書。其中,生產注射劑、放射性藥品和國務院藥品監督管理部門規定的生物制品的藥品生產企業的認證工作,由國務院藥品監督管理部門負責。《藥品生產質量管理規范》認證證書的格式由國務院藥品監督管理部門統一規定。
第六條規定:新開辦藥品生產企業、藥品生產企業新建藥品生產車間或者新增生產劑型的,應當自取得藥品生產證明文件或者經批準正式生產之日起30 日內,按照規定向藥品監督管理部門申請《藥品生產質量管理規范》認證。受理申請的藥品監督管理部門應當自收到企業申請之日起6 個月內,組織對申請企業是否符合《藥品生產質量管理規范》進行認證;認證合格的,發給認證證書。
第七條規定:國務院藥品監督管理部門應當設立《藥品生產質量管理規范》認證檢查員庫。《藥品生產質量管理規范》認證檢查員必須符合國務院藥品監督管理部門規定的條件。進行《藥品生產質量管理規范》認證,必須按照國務院藥品監督管理部門的規定,從《藥品生產質量管理規范》認證檢查員庫中隨機抽取認證檢查員組成認證檢查組進行認證檢查。
這是省級以上藥品監督管理部門《藥品生產質量管理規范》認證的事權劃分、《藥品生產質量管理規范》認證檢查員的遴選和檢查員庫的設立、企業申請GMP認證的要求、《藥品生產質量管理規范》認證的組織等相關規定的法律基礎。
(四)《藥品生產質量管理規范》的規定
《藥品生產質量管理規范(2010 年修訂)》于2011 年1 月17 日發布,自2011年3 月1 日起施行。GMP 從質量管理、機構與人員、廠房與設施、設備、物料與產品、確認與驗證、文件管理、生產管理、質量控制與質量保證、委托生產與委托檢驗、產品發運與召回、自檢等方面,明確了GMP 作為藥品生產企業質量管理體系的一部分,是藥品生產管理和質量控制的基本要求,旨在最大限度地降低藥品生產過程中污染、交叉污染以及混淆、差錯等風險,確保持續穩定地生產出符合預定用途和注冊要求的藥品。藥品生產質量管理規范是《GMP 檢查指南》制定的基礎。
(五)《藥品生產質量管理規范認證管理辦法》的規定
《藥品生產質量管理規范認證管理辦法》的宗旨是加強藥品生產質量管理規范檢查認證工作的管理、進一步規范檢查認證行為。在《管理辦法》中詳細規定了GMP 檢查的事權劃分,申請、受理與審查、現場檢查、審批與發證、跟蹤檢查、《藥品GMP 證書》管理等內容,也是《GMP 檢查指南》制定的依據之一。
二、建立藥品GMP 檢查指南的戰略要求
(一)《中國的藥品安全監管狀況》白皮書
藥品是人類用于預防、治療、診斷疾病的特殊商品,對藥品實施有效監管,關系到廣大消費者的用藥安全,關系到公眾生命健康權益的維護和保障。中國政府一貫高度重視藥品安全監管,多年來以強化藥品安全監管、保障公眾用藥安全為目標,逐步建立健全藥品安全監管體制與法制,不斷完善藥品供應體系,穩步提高藥品質量安全保障水平,積極維護公眾用藥權益,努力提高公眾的健康水平。
針對藥品生產質量管理的問題,在書中第一部分藥品供應和質量安全概況,介紹了中國藥品安全監管的法律法規體系建設,其中提到“將藥品生產、經營質量管理規范作為法定要求予以明確”,隨后在藥品安全監管的政策措施部分又以單獨小節介紹到藥品質量管理規范的相關情況。其中尤其提到按照1998 年版本的《藥品生產質量管理規范》對生產企業進行認證檢查,到2004 年已實現化學原料藥和全部藥品制劑在符合藥品GMP 的條件下組織生產的目標。從這個角度來說,GMP 的有效推行實施,從對展現我國藥品監管能力、反映藥品安全狀況、提升我國對外形象具有重要的戰略意義。
2010 版GMP 自2011 年3 月1 日起施行,凡新建藥品生產企業、藥品生產企業新建(改、擴建)車間均應符合2010 版GMP 的要求;現有藥品生產企業血液制品、疫苗、注射劑等無菌藥品的生產,應在2013 年12 月31 日前達到新版GMP 的要求;其他類別藥品的生產均應在2015 年12 月31 日前達到新版GMP 的要求。從規定的進度來看,要達到這些目標是有難度,其中很重要的一個原因在于:從2004 年到2010 年六年的時間里,我國的藥品生產企業數量和產品類別都大幅增加,對有效開展GMP 的檢查認證工作帶來挑戰。制定針對2010版GMP 的GMP 檢查指南是一個重要解決的手段,通過從監管部門(檢查人員)的角度提升GMP 檢查的能力能夠有力助推藥品GMP 的施行。
(二)國家藥品安全“十二五”規劃
2012年是國家“十二五”的開局之年,我國的各項事項事業都針對性地制定了全國性的五年規劃方案,作為關系到國計民生的藥品安全問題,同樣也需要制定一個全盤的發展規劃。
2012 年1 月20 日國務院印發《國家藥品安全“十二五”規劃》,為接下來五年的藥品安全工作做了部署。《國家藥品安全“十二五”規劃》緊緊圍繞《中華人民共和國國民經濟和社會發展第十二個五年規劃綱要》,一脈相承,從全面提高國家藥品標準、強化藥品全過程質量監管等角度進行了細化和延伸。規劃系統提出了5 項規劃指標,覆蓋了藥品研制、生產、流通、使用各個環節。在生產環節方面,明確提出藥品生產100%符合2010 年修訂的《藥品生產質量管理規范》的要求,無菌和植入醫療器械生產100%符合《醫療器械生產質量管理規范》要求。
《國家藥品安全“十二五”規劃》是我國藥品安全領域首個由國務院公布的國家專項規劃,總體目標是經過5 年努力,藥品標準和藥品質量大幅提高,藥品監管體系進一步完善;藥品研制、生產、流通秩序和使用行為進一步規范;藥品安全保障能力整體接近國際先進水平,藥品安全水平和人民群眾用藥安全滿意度顯著提升。而作為五個規劃指標之一的藥品生產企業GMP 符合比率,是這五個指標中要求較高的。上文已經提到,我國目前藥品生產企業的情況比較復雜,時間又非常緊迫,所以GMP 檢查指南的制定就顯得非常迫切。
(三)北京市“十二五”時期衛生發展改革規劃
在Altman Z-score模型中,樣本公司的Z-Score值越小,說明公司出現財務危機的可能性越大Altman Z-score模型如下:
本次研究制訂的北京市的GMP 檢查指南,因而必須要符合北京市關于藥品生產企業相關事項的整體要求。2011 年2 月1 日北京市衛生局和北京市發展改革委員會聯合發布的《北京市“十二五”時期衛生發展改革規劃》。在《規劃》保障市民用藥質量和安全一節中,就完善藥品生產供應體系問題,提出要“強化藥品生產的動態監管,在全市藥品生產企業推行2010 版GMP,保證藥品生產質量,促進制藥工業健康發展”。
北京市目前持有《藥品生產許可證》的藥品生產企業共計247 家,取得北京市頒發的GMP 證書261 個,取得國家局證書約86 個[23]。這些企業都需要按照國家的整體部署完成GMP 的認證。更為重要的是,北京首都對于藥品生產企業所產的藥品質量有著更為嚴格的要求,因此在進行GMP 檢查時,對于檢查的科學性、規范性、有效性等要有明確的可操作的規定。為保證北京市進行GMP 檢查認證時,能夠履行北京市對于藥品質量的要求、體現首都藥品監管的特色,有必要建立藥品GMP 檢查指南。
(四)北京市藥品監督管理工作第十二個五年規劃綱要
北京市的藥品GMP 認證檢查工作由北京市藥品監督管理局統一領導、統籌規劃、并委托藥品認證管理中心具體實施。因而藥品GMP 的認證管理工作要契合北京市藥品監督管理工作的整體規劃和部署。
2011 年2 月1 日,北京市藥品監督管理局發布《北京市藥品監督管理工作第十二個五年規劃綱要》。《規劃綱要》指出:“在全市藥品生產企業推行2010版GMP”被列為“十二五”的發展目標之一。2012 年是“十二五”的開局之年,也是新版藥品GMP 認證檢查工作最為關鍵的一年,2012 年到2013 年3 月1 日是2010 版GMP 施行的第一個關口,為妥善完成北京市藥品監督管理工作的“十二五”發展目標,制定切實可行的推動GMP 認證檢查工作的實施方案非常重要,作為認證檢查工作的指導,藥品GMP 檢查指南起著舉足輕重的作用。
綜合以上幾個方面的情況,無論是《國家藥品安全“十二五”規劃》,還是《北京市藥品監督管理工作第十二個五年規劃綱要》都對GMP 的實施推廣做出了具體的要求。因此,GMP 檢查指南作為GMP 實施推廣的重要組成部分,具有重要的戰略意義。
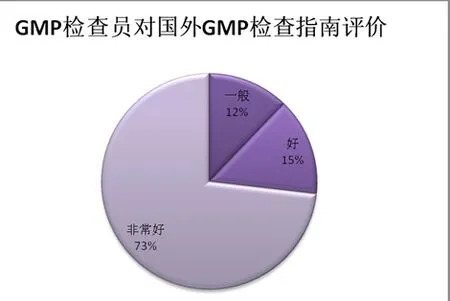
圖16 GMP 檢查員對國外GMP 檢查指南評價分布
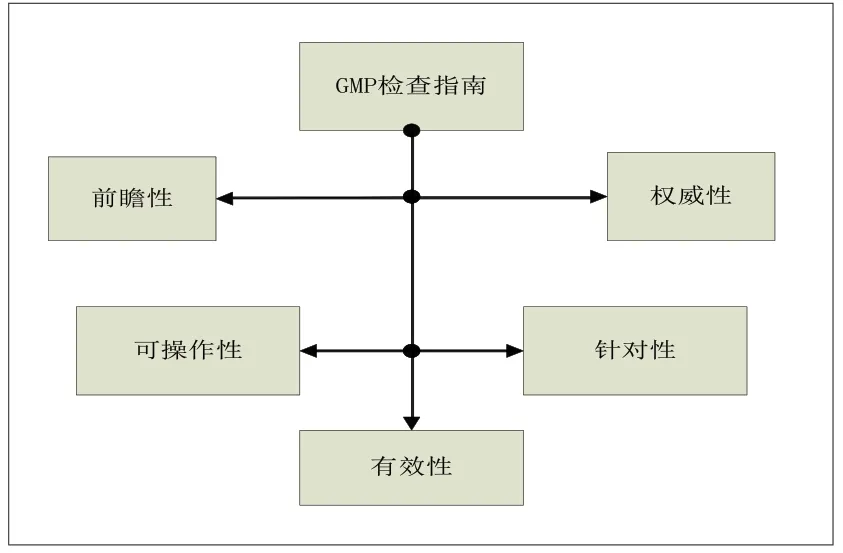
圖17 GMP 檢查指南的構建原則
三、GMP 檢查指南的國外實踐經驗
在分析了法律法規以及戰略要求方面的可行性后,課題組對國外藥品GMP檢查指南的經驗進行分析。國外的實踐經驗為制定我國的藥品GMP 檢查指南提供了扎實的基礎和豐富的經驗,從實踐的角度保障了GMP 檢查指南制定的可行性。下面分別從GMP 檢查指南在GMP體系中的地位、所起到的作用,以及國內GMP 檢查員對于國外GMP 檢查指南的評價三個角度來闡述。
(一)GMP 檢查指南是GMP 體系中核心構成
GMP 檢查是一項系統工程,針對不同的檢查項目和不同的檢查目的,會有不同的檢查策略,所以需要不同的檢查指南,也即檢查指南系統化。上面介紹的幾個國家或組織,均針對不同的項目制定不同的GMP 檢查指南。中國的GMP監管實踐已經發展到這一階段:我們在GMP 發布生效的同時,也發布了無菌藥品、原料藥、生物制品、血液制品、中藥制劑等五個附錄文件。但是同歐盟發布的針對不同類型產品的11 個附錄文件相比,我們還有很大的完善的空間。
(二)GMP 指南是反應監管要求的風向標
從FDA 的經驗來看,GMP 是一個動態變化的過程,在GMP 變化的過程中,需要及時有效的進行指南的更新和修訂,GMP 檢查指南的修訂從本質上來說就是反應的FDA 對于GMP 相關問題的近期思考。所以可以說GMP 檢查指南是反應監管要求的風向標,在美國廠商會經常性地了解FDA 在GMP 檢查指南方面所作出的調整,并針對這些調整來改變自己的GMP 檢查體系,從而能夠和FDA的想法保持一致。目前我國還沒有GMP 檢查指南,更無法有效地通過GMP 指南來反應監管要求的變化。從我們對企業調研訪談的情況來看,很多企業GMP 相關負責人都認同藥品GMP 指南可以用于反映藥品安全監管的要求。從這一角度來說,GMP 檢查指南是非常具有可行性的。
(三)國外GMP 檢查指南評價情況
針對國外GMP 指南情況,我們分析了美國、歐盟以及WHO 的GMP 制度的情況,并重點介紹了美國CGMP 檢查指南。縱觀這些發達國家或者地區以及國際組織的GMP 體系,其運行狀況都非常不錯。為了能夠更好地評價國外GMP 檢查指南的狀況,我們專門就這一問題進行了問卷調查,從我們的問卷統計情況來看(參見圖16),GMP 檢查員對于國外GMP 相關指南的評價也非常好,從這一結果來說,國外GMP 檢查指南的運行狀況很好,值得在國內推廣施行。
第五部 建立藥品GMP 檢查指南的構架與編寫流程
一、構建GMP 檢查指南的原則
綜合以上分析,我們得到構建GMP檢查指南的原則和基本框架。綜合我國GMP 檢查指南的歷史和現狀,吸取國外GMP 檢查指南的運行狀況,我們認為構建GMP 檢查指南的原則應該是確保其具有權威性、前瞻性、可操作性、針對性、有效性等五個方面的功能(具體邏輯關系參見圖17)
(一)權威性
GMP 檢查指南的制定和發布應該由藥品監管部門負責,以保證GMP 檢查指南的權威性和公信力,同時也是GMP 檢查指南區別于實施指南的特點。GMP 檢查指南是GMP 檢查員在檢查過程中,在做出最后的認證檢查評定結論之前,應參考和執行的法定依據,最終的評定結果必須使得企業足夠信服,所以保證GMP檢查指南的權威性非常重要。
(二)前瞻性
GMP 的根本目的是要保證藥品生產的質量,而對于質量的定義是動態調整的,不同的發展階段對于質量的定義存在差異。隨著生產工藝的改進和提升,藥品生產質量要求也會不斷提高,所以,制定的藥品GMP 檢查指南要有一定的前瞻性。藥品GMP 是企業應該滿足的最低條件,在指南的制定過程中,應當適當參考藥品生產管理和質量控制水平比較發達的國家或地區的要求,也可以借鑒WHO、ICH 等國際組織發布的指南建議。
此外,指南的制定還需要參考國家的整體發展規劃,如指南標準的制定需要考慮到國家宏觀層面的發展趨勢,如“十二五”規劃的發展方向等。
通過保持GMP 檢查指南的前瞻性,可以更好地促進企業改進GMP 體系的建設。從長期來看,我國的GMP 會越來越嚴格,保持GMP 指南的前瞻性可以減少企業因為GMP 的修訂所帶來的改造成本。
(三)可操作性
可操作性是指南最為重要的特征,一份不具有可操作性的指南沒有任何的指導意義。要保證GMP 指南的可操作性,可以從四方面入手:第一,GMP 指南的制定必須要有具有實踐工作經驗的人參與;第二,GMP 操作指南必須要借鑒已有指南的特色;第三,GMP 操作指南在可能的情況下要列舉所有的備選項;第四,指南的制定要有實際檢查運用的效果反饋,并針對反饋意見加以修訂。
(四)針對性
由于本版指南是北京市編寫的GMP檢查指南,在實際的編寫中必須要充分考慮到北京市的具體情況,如藥品生產企業的規模、產品類型等因素。此外要考慮到北京市本身所設定的監管目標,從而使得指南能夠更好地適應北京的需求,更具有針對性。
(五)有效性
有效性是指指南必須要能夠有效地指導GMP 檢查員開展檢查工作。上文所列舉的四項原則,從本質上來說都是為了保障藥品GMP 檢查指南的有效性。有效性的衡量標準可以從三個維度來看:第一,使用者,即GMP 檢查員,對GMP 檢查指南的滿意程度來衡量GMP的有效性;第二,生產企業,即生產企業的甑別情況,一份有效的GMP 檢查指南能夠甑別一個企業的GMP 體系的水平;第三,最終產品,即最終生產出的藥品的質量,GMP 的檢查不是目的,通過GMP檢查保障藥品生產過程的規范合理,最終使得藥品的質量得以提高才是目的。通過這三個維度的評定,可以判斷出GMP 檢查指南是否有效。在實際的編寫中,也要從這三個維度來加以考慮。最為有效的方式是在編寫指南的過程中,隨機選擇幾家企業,用GMP 檢查指南進行實際的檢查,從而檢驗其有效性。
二、藥品GMP 檢查指南的基本框架
以前文所提到的GMP 檢查指南的原則為指導,擬定出GMP 檢查指南的基本框架。在整體架構上,為保證一致性和便于查閱,指南以2010 版GMP 正文作為構架,遵循其本身的章節劃分方式和層次。具體的框架構成參見附錄中的GMP檢查指南標準頁。
在基本框架的基礎上,結合到目前中國藥品GMP 檢查的實際情況,可以在指南的附錄部分添加專題內容,專題內容的基本思路是“由點到線”,再“由線到面”,從而形成GMP 檢查指南的體系。具體而言,“由點到線”是指綜合分析文獻和實際的檢查反饋,針對藥品生產企業所具有的共性問題進行分析,從一個具體問題(點)入手,并由此橫向展開,將一系列的共性問題加以串聯整合,從而形成系列問題(線);針對系列問題,再進行縱向深入,延伸提煉出其它問題,從而形成一個以問題為基礎的檢查體系(面)。但是這種思路的實踐需要一定的時間,在具體的操作過程中,可以采用逐步增加的方式進行。
三、藥品GMP 檢查指南的編寫流程
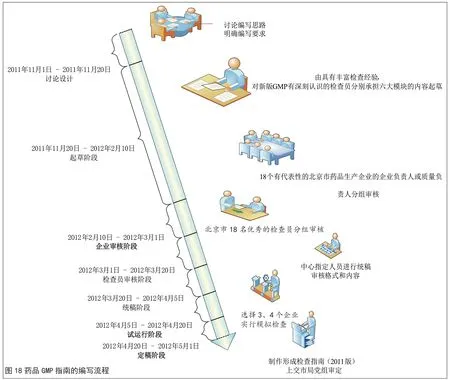
在編寫過程中,要綜合考慮多方意見,比如,貫徹GMP,藥品生產企業是主體。只有充分調動生產企業的積極性、主動性和創造性,才能真正將貫徹2010版GMP 的各項措施落到實處。比如,檢查指南的編寫必須源于生產實踐,并能有效地用于指導藥品生產實踐,所以檢查指南編寫需要藥品生產企業的參與。對于不同的意見要充分討論、分析,并達成共識,討論的形式可以是現場調研,也可以是組織專題會議討論等等。尤其需要注意的是,為保證GMP 指南有效性,需要選擇企業進行實地驗證。結合指南的設想和基本框架,制定出如圖18 的編寫流程。
(未完待續)

