Ⅱ型糖尿病腎病模型db/db小鼠血漿的代謝組學研究
孫立業 毛 璇 張冬娟 孫 博 管又飛 顏賢忠
1.軍醫進修學院,北京 100853;2.國家生物醫學分析中心,北京 100850;3.北京大學醫學部生理學與病理生理學系,北京 100083
糖尿病腎病(DN)是糖尿病最常見和最嚴重的并發癥之一,同時也是導致終末期腎損害的重要因素[1]。目前,臨床上對糖尿病腎病的診斷主要依賴于對尿微量白蛋白排泄率(UAER)的檢測,但因為尿微量白蛋白的含量會受肥胖、胰島素抵抗等諸多因素影響而存在著局限性[2]。糖尿病腎病的發病機制目前尚無統一定論,當前研究主要集中在糖代謝、脂代謝、氧化應激[3-5]等方面。代謝組學作為一種全面研究生物機體或組織細胞動態代謝的技術手段,近年來在疾病的診斷、標志物篩查以及發病機理的研究等方面已有廣泛的應用[6-8]。本文采用基于核磁共振(NMR)的代謝組學技術對db/db糖尿病腎病小鼠血漿中內源性小分子代謝物進行分析,結合模式識別技術確定糖尿病腎病小鼠機體由于病理刺激而產生的代謝紊亂,進行潛在代謝標志物分析,并對其病理機制進行探討,為臨床的診療提供可能的新思路,新方法。
1 資料與方法
1.1 實驗動物及分組
糖尿病腎病模型db/db小鼠(試驗組)6只,體重(53.9±2.1)g;db/m 小鼠(對照組)6 只,體重(26.8±2.3)g。所有小鼠均為雄性,周齡為14~16周,由北京大學醫學部提供。動物飼養房12 h晝夜交替,溫度為25~27℃,動物自由攝食飲水。
1.2 試劑和儀器
重水(D2O)購自美國 Norell公司;2,2,3,3,三甲基甲硅烷基丙酸(TSP)購自加拿大默克公司;戊巴比妥鈉和肝素鈉購于國藥集團化學試劑有限公司。VarianUNITYINOVA 600 MHz超導脈沖傅立葉變換核磁共振譜儀,購自美國瓦里安公司;Eppendorf 5810R離心機,購自德國Eppendorf公司。
1.3 血漿樣本制備和處理
對小鼠進行解剖,各組小鼠用戊巴比妥鈉(2%,2.5 mL/kg)麻醉后,于心臟動脈取血,使用肝素鈉抗凝,3 500 r/min離心15 min后得到血漿,取250 μL血漿,13 000 r/min離心10 min,取上清液 200 μL,加入 100 μL 的 TSP 重水溶液(1 mg/mL)和300 μL D2O,渦旋混勻后加入至5 mm核磁管中,用于核磁共振檢測。
1.4 核磁共振數據采集與預處理
于27℃下,使用VarianUNITYINOVA 600 MHz超導脈沖傅立葉變換核磁共振譜儀采集血漿核磁共振一維1H譜,采用Carr-Purcell-Meiboom-Gill(CPMG)序列抑制由蛋白和脂蛋白等物質產生的寬峰,檢測血漿中的小分子代謝物,實驗主要參數如下:譜寬8 000 Hz、弛豫延遲時間2 s、采樣點數64 K、累加次數64次,采用預飽方式抑制水峰信號。FID信號經過傅立葉變換轉換為一維1H NMR譜圖,調整相位并進行基線校正后以乳酸雙峰左側峰定標,化學位移定為δ1.33。將δ4.4~0.4范圍內的譜圖按照每段δ0.002進行分段積分,再將積分按每張譜的總積分強度為10 000進行歸一化,所得數據輸出并轉換到Excel文件后保存。
1.5 數據分析
應用 MATLAB R2008a(The MathWorks,Inc.,Natick,MA,USA)軟件對積分數據進行對齊,采用多元統計分析軟件SIMCA-P12.0+(Umetrics AB,Umea,Sweden)對對齊后的數據進行模式識別分析及皮爾森(Pearson)相關性分析,數據在進行單位方差(UV scaling)預處理之后采用正交偏最小二乘判別法(OPLS-DA)進行分析[9],采用七折交叉驗證法[10-11](seven-fold cross-validation)來驗證模型的有效性,用R2X和R2Y的值表示模型擬合情況,Q2值表示模型的預測能力。最后利用MATLAB R2008a軟件做出相關系數圖,更直觀也更客觀的發現組間差異代謝物。
2 結果
2.1 1H核磁共振譜圖
圖1顯示的為兩組小鼠血漿的核磁共振1H譜,其中A為對照組db/m小鼠,B為試驗組db/db小鼠。主要代謝物已在圖中進行了標注,從譜圖中可以明顯觀察到db/db小鼠血漿中葡萄糖顯著升高。
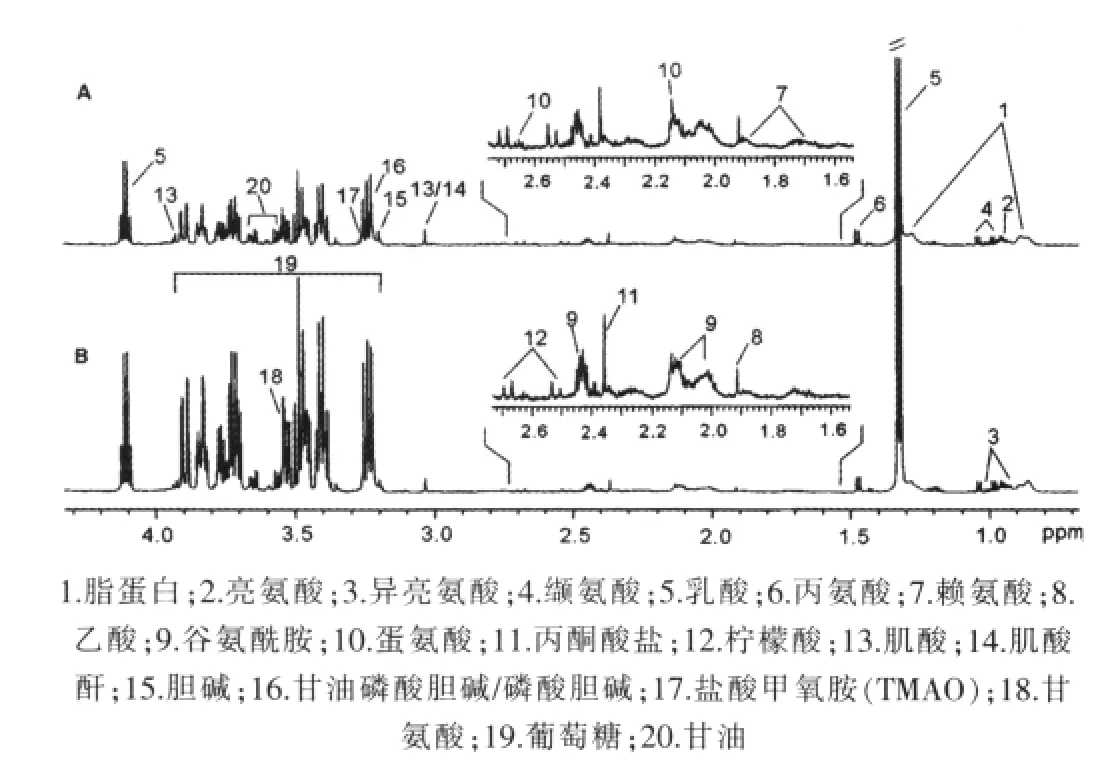
圖1 db/m小鼠(A)與db/db小鼠(B)血漿1H核磁共振譜圖
2.2 多元統計分析
為了更準確客觀地分析兩組間的差異代謝物,筆者采用了OPLS-DA的方法對數據進行了多元統計分析,并用交叉驗證的方法對模型的預測能力進行評估(R2X=0.452,R2Y=0.992,Q2=0.879)。利用MATLAB軟件做相關系數圖,相關系數的臨界值相當于顯著性水平P=0.05,查閱相關系數r臨界值表確定臨界值為0.755,即|r|>0.755的積分段所代表的代謝物在兩組間有差異。圖2B中顏色越接近紅色,代表此信號對組間區分貢獻越大,方向則表示含量的增加與減少。從圖2A中可以觀察到兩組小鼠可以被明顯區分,圖2B則顯示了引起組間差異的代謝物,與對照組db/m小鼠相比,db/db小鼠血漿中葡萄糖和氧化三甲胺(TMAO)的含量升高,脂蛋白、亮氨酸、異亮氨酸、纈氨酸、乳酸、丙氨酸、賴氨酸、乙酸、谷氨酰胺、蛋氨酸、檸檬酸、肌酸、肌酐、甘油磷酸膽堿、磷酸膽堿、甘油的含量則下降。見表1。
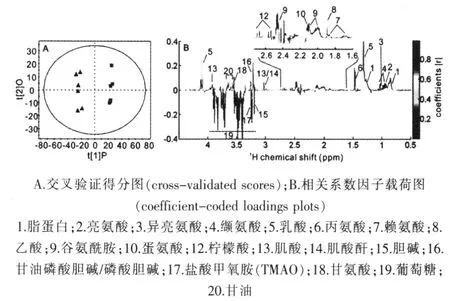
圖2 db/db(▲)及db/m(■)小鼠血漿核磁共振1H譜的 OPLS-DA結果
3 討論
糖尿病腎病是導致終末期腎臟疾病的主要原因,也是糖尿病主要的死亡原因之一,因此,對于糖尿病腎病的早發現早治療是至關重要的。目前,臨床上對糖尿病的診斷主要依靠UAER方法,但這是一個不可逆的過程,當患者出現UAER升高時往往已經伴隨心血管并發癥及其他腎臟疾病,錯過了最佳治療時機。筆者利用基于核磁共振的代謝組學技術較全面的對樣本中各類代謝物種類及含量的變化特點進行分析,尋找出主要的差異代謝物,對于輔助臨床早期診斷是有重要意義的。
本文的研究結果顯示,糖尿病腎病小鼠血漿內多種代謝物含量發生變化,多條代謝通路受到影響。試驗組小鼠血漿中的檸檬酸含量降低,提示三羧酸循環可能受阻,這一結果在zuker大鼠[12]和核受體PPAR-缺失小鼠[13]中已有發現。db/db小鼠血漿中多種氨基酸含量發生變化,如亮氨酸、異亮氨酸、纈氨酸、丙氨酸、賴氨酸、谷氨酰胺、蛋氨酸、甘氨酸,說明糖尿病腎病小鼠體內存在氨基酸代謝異常,可能是由于腎小管的重吸收能力下降,導致大量氨基酸流失。其中甘氨酸作為抗氧化劑,可以延緩氧自由基對腎臟的損害,通過調節腎臟抗氧化酶、Na+-K+-三磷酸腺苷酶、脂質過氧化產物丙二醛和一氧化氮等物質的水平來保護腎臟[14]。而db/db小鼠血漿中甘氨酸含量明顯減少,說明腎臟已受到損傷。
TMAO一般作為腎小管受損的標志物[15],在本實驗中試驗組小鼠血漿內TMAO含量顯著升高,提示著腎臟出現損傷,這一變化在db/db小鼠腎組織中同樣有所體現[16]。肌酸、肌酐含量的降低可能是由于發生糖尿病腎病時,由于高血壓血管緊張蛋白酶代謝紊亂而引起了腎小球濾過速率改變,進而造成腎皮層血流改變[17]。血漿中乙酸鹽含量降低,與Salek等[18]報道一致。磷酸膽堿和甘油磷酸膽堿含量降低與Chen等利用高分辨魔角旋轉技術檢測的8周齡db/db小鼠肝臟內的變化一致[19]。磷酸膽堿是屬于構成細胞膜的主要成分,試驗組小鼠血漿中含量的降低也提示著腎損傷。用代謝組學手段對血漿中小分子代謝物進行分析為進一步研究糖尿病腎病提供了更全面的信息。

表1 db/db小鼠與db/m小鼠血漿中主要差異代謝物及譜峰歸屬
本文采用用基于核磁共振的代謝組學方法對db/db糖尿病腎病模型小鼠的血漿進行了研究。結果顯示,與對照組db/m小鼠相比,試驗組db/db小鼠血漿內多種代謝物含量發生了變化,體現在一些已知的腎損傷的標志物TMAO、肌酸等,同時發現亮氨酸、異亮氨酸、纈氨酸、丙氨酸、賴氨酸、谷氨酰胺、蛋氨酸、甘氨酸等氨基酸含量降低,提示糖尿病腎病出現時,由于腎損傷而出現的腎小管重吸收能力下降,會導致氨基酸的流失,這些氨基酸將可能作為新的潛在代謝標志物。除此之外,糖尿病腎病小鼠可能還存在著三羧酸循環受阻,即能量代謝紊亂。以上結果表明,代謝組學技術能夠更全面的反映生物體的代謝變化,幫助人們更好地了解生物體中各種復雜的代謝通路,這有可能成為一種輔助糖尿病腎病臨床診斷以及病理機制探討的重要手段。
[1]Afifi A,El SM,El Sharkawy M,et al.Diabetic nephropathy as a cause ofend-stagerenaldiseaseinEgypt:asix-yearstudy[J].EastMediterr Health J,2004,10(4-5):620-626.
[2]Weir MR.Microalbuminuria and cardiovascular disease[J].Clin J Am Soc Nephrol,2007,2(3):581-590.
[3]Balakumar P,Arora MK,Singh M.Emerging role of PPAR ligands in the management of diabetic nephropathy[J].Pharmacol Res,2009,60(3):170-173.
[4]Oberg BP,Mc Menamin E,Lucas FL,et al.Increased prevalence of oxidant stress and inflammation in patients with moderate to severe chronic kidney disease[J].Kidney Int,2004,65(3):1009-1016.
[5]Chen YJ,Quilley J.Fenofibrate treatment of diabetic rats reduces nitrosative stress,renal cyclooxygenase-2 expression,and enhanced renal prostaglandin release[J].J Pharmacol Exp Ther,2008,324(2):658-663.
[6]Hodavance MS,Ralston SL,Pelczer I.Beyond blood sugar:the potential of NMR-based metabonomics for type 2 human diabetes,and the horse as a possible model[J].Anal Bioanal Chem,2007,387(2):533-537.
[7]Odunsi K,Wollman RM,Ambrosone CB,et al.Detection of epithelial ovarian cancer using 1H-NMR-based metabonomics[J].Int J Cancer,2005,113(5):782-788.
[8]Hwang GS,Yang JY,Ryudo H,et al.Metabolic profiling of kidney and urine in rats with lithium-induced nephrogenic diabetes insipidus by(1)H-NMR-based metabonomics [J].Am J Physiol Renal Physiol,2010,298(2):F461-470.
[9]Cloarec O,Dumas ME,Trygg J,et al.Evaluation of the orthogonal projection on latent structure model limitations caused by chemical shift variability and improved visualization of biomarker changes in 1H NMR spectroscopic metabonomic studies[J].Anal Chem,2005,77(2):517-526.
[10]Clayton TA,Lindon JC,Cloarec O,et al.Pharmaco-metabonomic phenotyping and personalized drug treatment[J].Nature, 2006,440(7087):1073-1077.
[11]Slupsky CM,Rankin KN,Wagner J,et al.Investigations of the effects of gender,diurnal variation,and age in human urinary metabolomic profiles[J].Anal Chem,2007,79(18):6995-7004.
[12]Williams R,Lenz EM,Wilson AJ,et al.A multi-analytical platform approach to the metabonomic analysis of plasma from normal and Zucker(fa/fa)obese rats[J].Mol Biosyst,2006,2(3-4):174-183.
[13]Atherton HJ,Bailey NJ,Zhang W,et al.A combined 1H-NMR spectroscopy-and mass spectrometry-based metabolomic study of the PPAR-alpha null mutant mouse defines profound systemic changes in metabolism linked to the metabolic syndrome [J].Physiol Genomics,2006,27(2):178-186.
[14]Zakaria FA.Effect of oxygen derived free radicals and glycine on sodium-potassium adenosine triphosphatase in the basolateral membrane of the kidney in ischemia-reperfusion[J].Saudi Med J,2002,23(11):1380-1385.
[15]Serkova N,Fuller TF,Klawitter J,et al.H-NMR-based metabolic signatures of mild and severe ischemia/reperfusion injury in rat kidney transplants[J].Kidney Int,2005,67(3):1142-1151.
[16]毛璇,張冬娟,管又飛,等.Ⅱ型糖尿病腎病小鼠腎水提物代謝組學研究[J].波譜學雜志,2010,27(4):532-539.
[17]Gartland KP,Bonner FW,Timbrell JA,et al.Biochemical characterisation of para-aminophenol-induced nephrotoxic lesions in the F344 rat[J].Arch Toxicol,1989,63(2):97-106.
[18]Salek RM,Maguire ML,Bentley E,et al.A metabolomic comparison of urinary changes in type 2 diabetes in mouse,rat,and human[J].Physiol Genomics,2007,29(2):99-108.
[19]Xu J,Zhang J,Cai S,et al.Metabonomics studies of intact hepatic and renal cortical tissues from diabetic db/db mice using high-resolution magic-angle spinning 1H NMR spectroscopy[J].Anal Bioanal Chem,2009,393(6-7):1657-1668.

