不同化療方案治療卵巢上皮性癌近期療效及安全性的系統評價
燕紀林 白瑞云 李玉斌
河北省張家口市建國醫院婦產科,河北張家口 075000
卵巢癌的病死率居婦科腫瘤的首位,占女性癌癥患者病死率的第5位。在卵巢原發惡性腫瘤中,卵巢上皮性癌(epithelia ovarian cancer,EOC)占 85%~90%,其中 70%EOC患者診斷時已為晚期,病死率居婦科惡性腫瘤之首[1-2]。手術是治療成功的關鍵,有效、及時、足量、規范的化療是卵巢癌術后至關重要的輔助治療[3]。目前國內一線藥物為PAC方案,而國外將TC方案作為一線用藥[4]。本研究通過對1999年1月~2005年10月收治的82例上皮性卵巢癌患者使用PAC、TC等不同方案治療的臨床療效,現報道如下:
1 資料與方法
1.1 一般資料
我院1999年1月~2005年10月使用PAC、TC等不同方案治療卵巢上皮性癌82例,診斷指標根據影像學、CA125、組織學或細胞學診斷。所有病例均參與中華醫學會婦科腫瘤分會多中心開放性臨床研究,入選條件與排除條件與研究要求標準相符[5]。82例患者年齡44~72歲,平均57.7歲,病理切片須經我院診斷及復核。腫瘤組織學類型按(WHO)卵巢腫瘤命名:漿液性腫瘤54例,黏液性腫瘤20例,子宮內膜樣腫瘤8例,透明細胞癌2例。患者年齡20~40歲有11例,41~60歲有53例,61歲以上有18例。分期按卵巢癌FIGO分期:Ⅰ期13例,Ⅱ期4例,Ⅲ期49例,Ⅳ期16例。上述病例均為手術后化療,82例患者手術加TC方案化療(B組)與手術加PAC方案化療(A組)各41例。兩組患者年齡、腫瘤類型以及分期等資料比較差異均無統計學意義(P>0.05),見表1。

表1 兩組不同化療方案一般資料比較(例)
1.2 治療方法
1.2.1 手術治療 Ⅰ期的患者單純行患側附件切除術,Ⅱ期行全宮+雙附件+大網膜+闌尾切除術,Ⅲ期以上行腫瘤細胞減滅術。
1.2.2 化療方案 A組采用PAC方案 (順鉑或卡鉑+阿霉索+環磷酰胺)1日療法,劑量為:順鉑每日50 mg/m2。環磷酰胺每日400~600 mg,阿霉素每日30~50 mg,靜脈滴注,28 d為1個療程,每療程間隔3~4周,共6~8療程。B組中除5例在初次手術后未接受化療外,其余146例均接受了化療,采用代方案(紫杉醇+卡鉑),紫杉醇135~175 mg/m2靜脈滴注1次。卡鉑300~400 mg/m2腹腔內灌注1次。3周為1個療程,每療程間隔3~4周。共6~8療程。
1.2.3 隨訪 265例經初次手術和化療后出院,定期隨診,失訪30例,隨訪率88.7%。復查包括全身及盆腔檢查、超聲、CT或MRI檢查、血清腫瘤標記物。發現復發及時入院再次手術或化療。
1.3 療效評價標準[6]
客觀緩解定義為中國婦科腫瘤學會開放性臨床研究統一標準。完全緩解(CR):所有可測定的和可評價的疾病完全消失或CA125與治療前第3次升高的水平相比,CA125持續下降>75%,4周復測不超過第一次的110%,沒有新的損害,沒有疾病相關癥狀,沒有無法評估的疾病證據。部分緩解(PR):對于所有可測定的損害,其治療產物的總和在二維的垂直直徑上減少≥50%或CA125與治療前第3次升高的水平相比,CA125下降>50%,4周后復測不超過第一次的110%,可評估的疾病沒有進展,沒有新的損害。疾病穩定(SD):未達到 CR、PR 或疾病進展。 疾病進展(PD):病變治療后的產物的總和其最長的垂直直徑增加25%,或具有新的損害出現,或治療后CA125任意2次高于2倍的治療前第3次升高的水平。
1.4 不良反應
化療期間及化療結束后根據臨床客觀反應及實驗指標評估藥物的相關不良事件及實驗室指標毒性反應分級標準。
1.5 統計學方法
所有數據采用SPSS 13.0統計軟件分析,計量資料數據以均數±標準差(±s)表示,比較采用t檢驗,計數資料采用百分率表示,組間對比采用χ2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 近期療效
為了觀察兩組的近期療效,將化療療程分為3個階段,即1~3個療程、4~6個療程、大于7個療程。發現B組有17例完成1~3個療程,共化療28次,有效6例,有效率為35.29%;22例完成4~6個療程,共完成66次化療,有效14例,有效率為63.64%;大于7個療程的2例,不計算百分數。A組完成1~3個療程者13例,共完成20次化療,有效3例,有效率為23.08%。完成4~6個療程的有28例,共53次化療,有效17例,有效率為60.71%。經χ2檢驗,兩組的有效率差異無統計學意義(P>0.05);兩組患者完成化療治療后進行臨床緩解比較,B組CR+PR率明顯高于A組,兩組比較差異有統計學意義(χ2=4.017,P=0.026),見表2;B組5年生存率、中位生存期、PFI明顯高于A組,兩組比較差異有統計學意義(P<0.05),見表3。
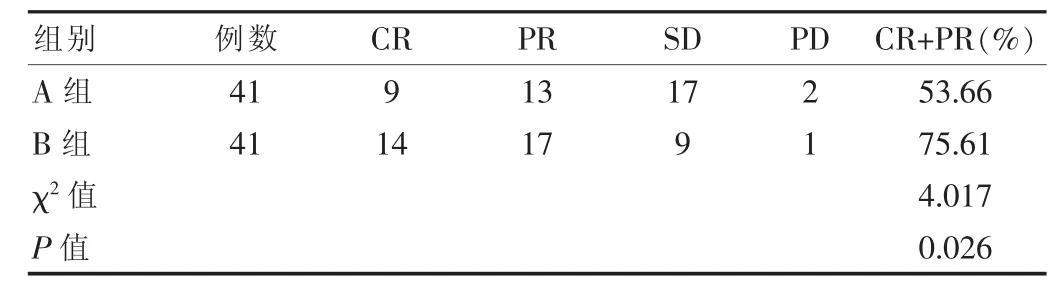
表2 兩組患者臨床緩解率比較(例)
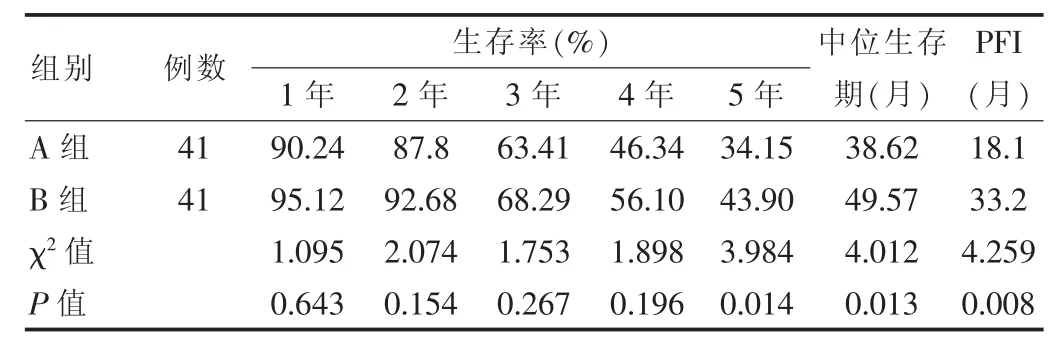
表3 兩組患者生存期的比較
2.2 毒副反應
觀察兩組化療的毒性反應,兩組都有中度的骨髓抑制,明顯的胃腸道反應,輕度的肝、腎功能受損。其中A組有1例化療因白細胞重度下降停藥,治療后改為TC方案,1例化療1次因腎功能嚴重受損放棄化療。兩組患者化療過程中出現的毒副反應情況比較見表4。
3 討論
化療即化學治療,是主要的治療腫瘤方法之一,它是應用化學藥物治療腫瘤的方法。具體地說,就是將能夠抑制或殺滅腫瘤細胞的化學藥物,通過各種途徑,如口服、靜脈注射等方法注入人體,達到治療效果[7]。卵巢癌的發病率位居婦科腫瘤第三,但其死亡率卻居第一[8]。化療是卵巢癌主要的輔助治療手段,而目前以鉑類為基礎的聯合化療是卵巢癌的一線化療方案,但在化療藥物劑量強度、給藥方式、腹腔化療及新輔助化療的維持和鞏固治療方面仍有待進一步探討。靜脈化療方案包括卡鉑聯合紫杉醇方案,靜脈滴注,每3周重復,共6個周期;多西他賽聯合卡鉑方案等。臨床上多推薦中等化療劑量,并沒有什么理想的有效劑量。也有試驗研究加大卡鉑劑量來改善預后,但效果并不明顯。因此其化療劑量強度的增加與否尚屬研究討論階段[9]。

表4 兩組患者化療過程中毒副反應[n(%)]
我院采用TC方案治療上皮性卵巢癌近期療效較PAC方案治療的近期療效有所提高,并且副作用較PAC方案輕。TC方案治療的藥物濃度明顯增高,并且增加了藥物與腫瘤的大范圍接觸和藥物對腫瘤的滲透,血液循環中藥物濃度較低,減少了化療的副作用,藥物經門靜脈吸收可治療肝轉移。TC方案和PAC方案對上皮性卵巢癌治療都有較好的近期療效。筆者通過觀察發現PAC方案的副作用大于TC方案,因此在經濟條件允許的情況下TC方案可作為上皮性卵巢癌術后化療的一線用藥。
但對是否延長患者生存期尚無明顯定論[10]。聯合治療卵巢癌一線化療方案會出現嚴重的毒性反應,因此對于出現嚴重毒性反應或無效患者需及時更改化療劑量或方案,或聯合癌癥生物治療綜合治療方案來改善卵巢癌化療毒副反應[11-12]。本研究中A組中有1例化療因白細胞重度下降停藥,治療后改為TC方案,1例化療1次因腎功能嚴重受損放棄化療。兩組的不良反應為骨髓抑制、惡心嘔吐,末梢神經毒性、腎功能損害、脫發等,兩組方案在胃腸道反應、周圍神經毒性和發熱方面存在差異,其他毒性兩組都存在,但TC方案較PAC方案輕。說明TC化療可有效起到增效減毒的作用,提高患者生存質量,對延長患者生存期也有一定的幫助。
[1]魏麗惠,錢和年.婦科腫瘤手冊[M].北京:人民衛生出版社,2001,317-319.
[2]周衛,翁幗英,陳文忠,等.紫杉醇脂質體在大鼠體內的組織分布[J].中國藥學雜志,2005,40(18):1402-1404.
[3]李祖惠,楊輝.脂質體藥物研究進展[J].中國藥業,2005,14(10):75-76.
[4]丁兆軍,隋世華,陳為志,等.捷佰舒聯合放療治療晚期食管癌的近期療效觀察[J].實用腫瘤學雜志,2004,18(4):258-260.
[5]于麗波,孫文洲,隋麗華,等.紫杉醇為主聯合化療治療晚期卵巢癌近期療效觀察[J].實用腫瘤學雜志,2000,14(2):187-188.
[6]Straublnger RM,Arnold RD,Zhou R,et al.Actibities of liposome-associated drugs[J].Anticancer Res,2004,24(2A):397.
[7]Desoize B,Madoulet C.Particular aspects of platinum compounds used at present in cancer treatment[J].Crit Rev Oncol Hematol,2002,42(3):317-325.
[8]Gadducci A,Cosio S,Conte PF,et al.Consolidation and maintenance treatments for patients with advanced epithelial ovarian cancer in complete response after first line chemotherapy:a review of the literature[J].Crit Rev Oncol Hematol, 2005,55(2):153-166.
[9]Piccart MJ,Bertelsen K,James K,et al.Randomized intergroup trial of cisplatin paclitaxel versus cisplatin cyclophosphamide in women with advanced epithelial ovarian cancer:three year results[J].J Natl Cancer Inst,2000,92(9):699-708.
[10]Hamilton CA,Berek JS.Intraperitoneal chemotherapy for ovarian cancer[J].Curr Opin Oncol,2006,18(5):507-515.
[11]Alberts DS,Liu PY,Hannigan EV,et al.Intraperitoneal cisplatin plus intrarenous cisplatin plus intravenous cyclophvs phamide for stageⅢovarian cancer[J].N Engl J Med,1996,335(26):1950-1955.
[12]Markman M,Bundy BN,Alberts DS,et al.PhaseⅢ trial of standard dose intravenous cisplatin plus paclitaxel versus moderately high dose carboplatin followed by intravenous paclitaxel and intraperitoneal cisplatin small volume stage Ⅲ ovarian carcinoma:an intergroup study of the Gynecologic Oncology Group,Southwestern Oncology Group,and Eastern Cooperative Oncology Group [J].J Clin Oncol,2001,19(4):1001-1007.

