N-烷基芳胺合成的研究進展
楊 芳,嚴新煥
(浙江工業大學綠色化學合成技術國家重點實驗室培育基地,浙江 杭州 310014)
進展與述評
N-烷基芳胺合成的研究進展
楊 芳,嚴新煥
(浙江工業大學綠色化學合成技術國家重點實驗室培育基地,浙江 杭州 310014)
N-烷基芳胺是非常重要的有機原料和精細化工中間體,廣泛應用于染料、塑料、醫藥和農藥等領域。介紹了芳胺與烷基化試劑如鹵代烴、羰基化合物、醇等進行的取代烷基化反應合成N-烷基芳胺的反應機理及烷基化工藝;重點闡述了以芳香硝基化合物為原料一鍋法合成N-烷基芳胺的生產工藝,分別討論了以羰基化合物、腈、醇作為烷基化試劑的優劣,認為以醇為烷基化試劑的反應條件溫和、不需要添加任何配體,具有較好的應用前景。指出開發適合以醇為烷基化試劑的選擇性高的催化劑是以后的研究方向。
芳胺;芳香硝基化合物;N-烷基芳胺;N-烷基化
N-烷基芳胺是重要的化工原料,廣泛應用在有機合成、化學中間體、染料、橡膠助劑、農藥、醫藥等領域[1-2]。隨著染料、橡膠工業的不斷發展,農藥、醫藥的用量也不斷增加,N -烷基芳胺的需求量迅速增長,與其相應的合成開發也備受關注。
N-烷基芳胺的合成一般采用芳胺和烷基化試劑(醇、醚、鹵代烴、硫酸酯等)為原料,生產方法分為液相法和氣相法[3]。傳統的液相法一般以H2SO4、H3PO4以及氫鹵酸等無機酸為催化劑。其合成工藝的優點是反應溫度低、產物選擇性高,缺點是生產效率低、對設備腐蝕嚴重、廢酸排放量大。現多以負載型貴金屬為催化劑,避免酸對設備的腐蝕,且催化活性高,但貴金屬價格相對昂貴。氣相法則采用分子篩、金屬氧化物等為催化劑,其合成工藝的優點是設備投資少、避免了對環境污染和設備腐蝕、操作簡便、生產成本低,缺點是選擇性比液相法低、催化劑容易失活。目前,國內大部分生產單位仍采用液相法生成,其主要原因是液相法技術相對比較成熟。
以芳胺為初始原料合成N-烷基芳胺的方法中,芳胺主要由芳香硝基化合物通過化學還原法或者催化加氫法制得。其中化學還原法通常采用鐵粉、鋅粉和硫化物等將芳香硝基物還原為芳胺,但該過程中產生大量的污染物[4]。近年來國內外許多研究工作者將芳香硝基化合物加氫還原生成芳胺和芳胺N-烷基化反應在同一催化劑下同一反應器內連續制備N-烷基芳胺,工藝大為簡化,產品損失少,收率高,該過程屬清潔工藝,對環境友好,發展前景較為廣闊。本文對近年來國內外以芳胺為初始原料合成N-烷基芳胺進行了綜述,著重介紹了以芳香硝基化合物為初始原料合成N-烷基芳胺的研究進展。
1 芳胺N-烷基化反應
芳胺烷基化反應按反應類型及所用烷基化試劑可分為3種:以醇、鹵代烷烴和酯類為烷基化試劑的取代烷基化;以丙烯酸衍生物、環氧化合物等為烷基化試劑的加成烷基化;以醛和酮為烷基化試劑的縮合還原烷基化。
1.1 取代烷基化
取代烷基化是應用最廣泛的烷基化工藝,最常用的烷基化試劑有鹵代烷烴、醇和酯。醇為烷基化試劑的反應需加催化劑方能使之順利進行。以鹵代烷烴和酯類為烷基化試劑,反應條件比以醇為烷基化試劑溫和,但烷基化試劑價格比醇高,且原料對環境造成污染。取代烷基化反應得到的烷基化產物的選擇性不高,很容易得到雙取代或多取代物。
Narayanan等[5]認為芳胺的烷基化反應是連續的反應,他們認為芳胺先與烷基化試劑發生單取代烷基化,接下來生成的二烷基芳胺是由單烷基芳胺反應而來的(圖1)。
芳胺與醇進行N-烷基化反應也是很常見的合成路線。但是醇是弱親電試劑,不容易進行N-烷基化反應,為了解決這個問題,通常采用過渡金屬作為催化劑,通過氫轉移的過程將醇轉變為具有較強親電性的羰基化合物。羰基化合物再與胺反應得到亞胺,亞胺經過還原后最終得到相應的N-烷基胺[6](圖2)。
1.2 加成烷基化
芳胺與丙烯酸衍生物、環氧化合物為烷基化試劑的加成烷基化中,常用于芳胺引入羥乙基、氰乙基、羧乙基等N-乙基衍生物的制備。但由于兩個氫原子具有相似的活性,進行雙烷基化反應的概率很大,且在烷基化過程中還有聚合及O-烷基化等副反應發生,因而需要控制烷基化試劑的用量[7]。生成的產物都帶有羥基,還需要進一步處理掉羥基[8]。無法與其它直接烷基化反應相比,應用較少。
1.3 縮合還原烷基化
縮合還原烷基化是先由醛、酮和芳胺縮合生成席夫堿,然后在還原劑作用下制得仲胺。如伯胺或仲胺用甲醛和甲酸進行還原甲基化反應機理見圖3[8]。
2 以芳胺為原料合成N-烷基芳胺
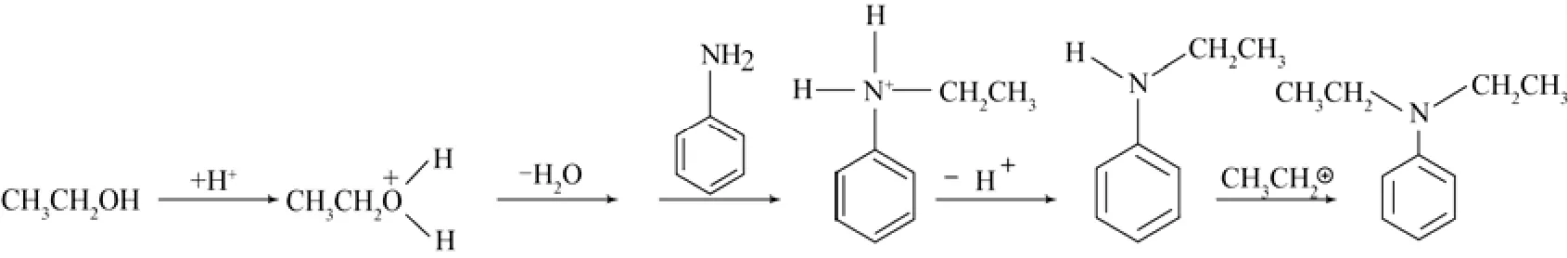
圖1 苯胺N-乙基化反應機理
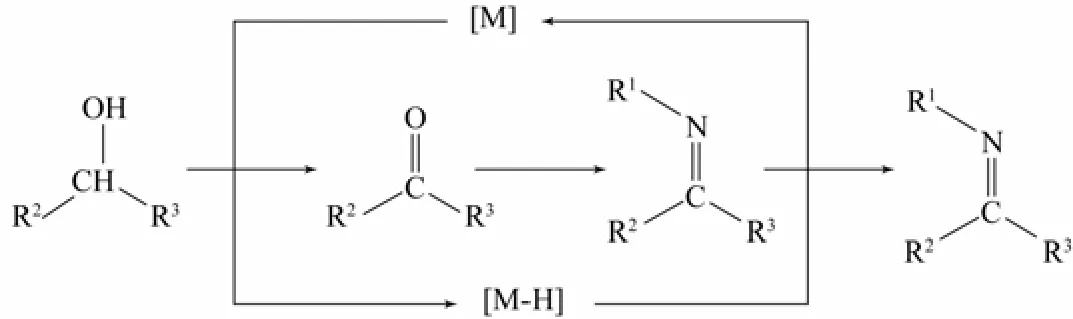
圖2 醇為烷基化試劑的反應機理
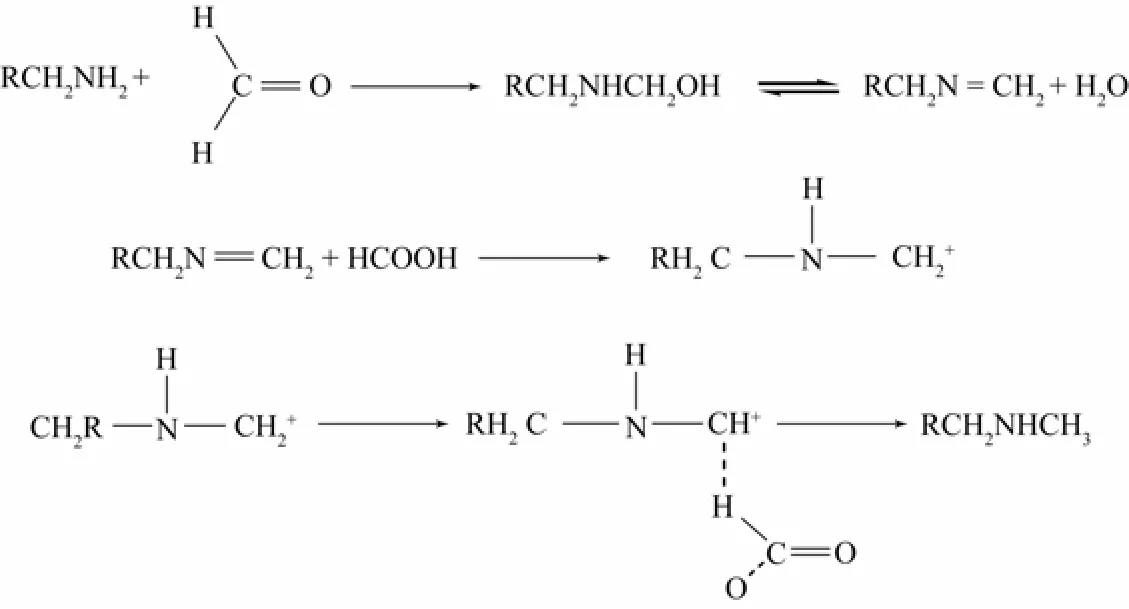
圖3 還原烷基化機理
芳胺N-烷基化反應是有機合成中的一類重要反應,最常用的合成方法是芳胺和烷基化試劑如醇、醚、鹵代烷以及硫酸酯等進行烷基化反應。生產方法分為兩大類,即液相法和氣相法。
2.1 液相法制備
傳統的液相法所用催化劑一般為H2SO4、H3PO4及氫鹵酸等無機酸,反應需在高壓下進行,對設備要求苛刻,且副產物多,三廢處理難,生產間歇進行,效率低。現多以負載型貴金屬為催化劑,將芳胺與烷基化試劑(鹵代烴、羰基化合物和醇)進行N-烷基化反應。該工藝不需要使用酸作為催化劑,但是貴金屬價格昂貴。
2.1.1 以鹵代烴為烷基化試劑
Basu等[9]采用硅膠為催化劑,探討在室溫下胺與鹵代烴發生N-烷基化反應。發現烷基化試劑的用量對烷基化產物的選擇性有很大的影響。當鹵代烴與胺的摩爾比為1∶1時,主要得到單烷基化產物。而當加入過量的鹵代烴則有利于二取代烷基化產物的生成。且該催化劑可以循環使用10次以上。Gawande等[10]使用Al2O3-OK為催化劑,在常溫下胺與鹵代烷烴反應。結果表明,在K2O存在下,以乙腈為溶劑反應效果最好,收率為85%。該反應對不同的鹵代烴和胺都適用。
2.1.2 以羰基化合物為烷基化試劑
以羰基化合物為烷基化的反應,首先得到過渡態的亞胺,經過還原后得到烷基化產物。Gomez等[11]以Ni為催化劑,羰基化合物與NH3和H2反應合成相應的二級胺。Stoter等[12]用酮與胺在加入分子篩后,能夠得到85%的選擇性和94%的ee值。該反應適用于多種芳胺以及雜環芳胺。Mizuta等[13]以Ir為催化劑,胺與相應的醛在Et3SiH存在下反應,得到相應三級胺收率為99%。但該反應過程中需要使用高活性的羰基化合物,且醛和醇很容易發生羥醛縮合,生成不可逆的副產物。
2.1.3 以醇為烷基化試劑
醇作為烷基化試劑由于其廉價易得,且生成的副產物只有水,對環境友好,具有很大的應用前景。Saidi等[14]以[Cp*IrI2]2為催化劑,在水中不加堿及其它添加劑情況下胺與醇進行烷基化反應。結果顯示,對于無分支的芳胺與醇反應得到二級胺的收率為94%。而在無水條件下,反應5 h的轉化率只有48%。采用不同的醇與胺反應,芳香醇與胺可獲得98%的收率,對于直鏈醇也能順利進行,得到80%~90%的收率。Hamid等[15-16]以[Ru(p-cymene)Cl2]2為催化劑,在溫和的反應條件下考察不同配體對反應的影響。結果表明,以1,1'-雙(二苯基膦二茂鐵)(DPPF)為配體,在10% K2CO3存在下,單烷基胺的收率達到100%。Kwon等[17]以Pd為催化劑,考察不同載體、不同醇以及不同胺對反應的影響。研究表明,Pd/AlO(OH)的催化活性最高,對于大部分的醇和胺,在1 atm(1atm=1.013×105Pa)H2室溫下得到單烷基化產率>80%,而在1 atm O290℃環境下,則可以得到>90%的亞胺。
近年來,也有許多研究者使用非貴金屬為催化劑。Martinez等[18]以廉價易得的赤鐵礦為催化劑,分別考察在堿存在下芳胺和直鏈胺以及芳香醇和直鏈醇對單烷基化產物的影響。研究表明,含有吸電子基團和供電子基團的芳胺與芳香醇反應得到較高的收率。對于富含電子的雜原子化合物,單烷基化產物選擇性>99%。但直鏈醇與直鏈胺基本無反應。Likhar等[19]以Cu/Al水滑石為催化劑,在K2CO3存在下,考察含不同取代基團的醇和胺對N-烷基化產物的影響。研究表明,對于大部分的醇和胺,在160 ℃下反應9 h,得到單烷基化產物的收率為70%~98%。
Zhang等[20]以Pd/Fe2O3為催化劑,在不添加任何堿和有機配體、160 ℃下,芳香醇與胺反應可以得到>90%的收率,直鏈醇與胺反應得到80%~86%的收率,直鏈醇與直鏈胺反應得到78%~81%的收率。Fujita等[21]以[Cp*IrCl2]2為催化劑,在K2CO3存在下,芳胺與芳香醇反應可以得到>83%的產率,與直鏈醇反應,產率為63%~79%,而對于環狀脂肪醇,收率為85%以上。
2.2 氣相法
氣相法以固體酸為催化劑,避免了無機酸對設備的嚴重腐蝕,反應條件溫和,消除了對環境的嚴重污染,但選擇性低,催化劑易失活。氣相法進行芳胺N-烷基化反應的催化劑主要包括黏土、分子篩、氧化物、過渡金屬催化劑等。
Yadav等[22]研究了各種醇與胺在K10催化作用下的反應情況。結果表明,弱酸環境以及低溫有利于N-烷基產物的生成。各種烷基化產物的穩定順序為:p-烷基胺>o-烷基胺>N-烷基胺。此外,烷基的鏈長對產物的穩定性也有影響,其順序為:N-甲基胺>N-乙基胺>>N-異丙基胺>N-丁基胺>>N-四丁基胺。Nehate等[23]將十二鎢磷酸(DTPA)負載在K10上催化合成N-甲基苯胺。結果表明,20%(質量分數)的DTPA/K10反應效果最佳,胺的轉化率為79%,N-甲基苯胺的選擇性達到99%。
分子篩作為固體酸催化劑用于烷基化反應已被廣泛報道。Luque等[24]以Al-MCM-41為催化劑,考察了反應溫度、催化劑酸度對產物的影響。結果表明,催化劑經過NH4F處理后,得到單烷基化的選擇性高,且催化劑不易失活。低溫、中等酸度有利于N-烷基化反應,而高溫、強酸則更有利于C-烷基化反應。
氧化物也是使用在工業過程中的催化劑之一,廣泛用在脫氫、氧化、氨解氧化、聚合等反應中。陶克毅等[25-26]采用乙醚作為烷基化試劑,以氧化鋁為催化劑對氣相法合成N,N-二乙基苯胺進行了研究,考察了反應溫度、原料配比和空速等因素對反應的影響。結果表明,在反應溫度為310 ℃、空速1.0 h-1,n(乙醚)/n(苯胺)=1.5時,反應效果最好,且該催化劑具有很好的穩定性。以苯胺和甲醇混合物為原料,結果表明,在甲醇/苯胺摩爾比為3∶1、苯胺液體空速為0.5 h-1、反應溫度為300 ℃時,苯胺的轉化率接近100%,N,N-二甲基苯胺的選擇性達到95%,沒有苯環取代物生成。唐靖等[27]在固定床催化反應器中研究了常壓下芳胺和醇的氣相法N-烷基化反應,考察了反應條件對該反應的影響。結果表明,當甲醇和苯胺的摩爾比為3∶1時,反應溫度為280 ℃,液體空速為0.3 h-1的條件下,苯胺轉化率為99%,生成N,N-二甲基苯胺的選擇性為92%。此外還考察了不同取代基團對反應的影響,其轉化率順序為:苯胺≈對甲苯胺≈間甲苯胺>鄰甲苯胺。隨著醇中碳原子數目的增加,醇的反應活性降低,正構醇和苯胺反應與異構醇和苯胺反應隨溫度升高的變化趨勢相反。
過渡金屬及其氧化物用于芳胺N-烷基化反應因具有轉化率高、選擇性好、產品質量高、三廢少等優點而應用較廣。Vijayaraj等[28]以Cu1-xZnxFe2O4為催化劑催化芳胺衍生物進行單N-甲基化反應。在最佳的反應條件下(MeOH∶胺∶水=3∶1∶1,空速為3.58 h-1,反應溫度為543~603 K),當x=0.5時,胺的轉化率最高。由于電子效應的影響,鄰位和對位取代的衍生物中胺的轉化率降低,空間效應只影響二取代基團的衍生物。當甲醇的量增大時,形成N,N-二甲基化產物的選擇性增加。
3 以芳香硝基化合物為原料合成N-烷基芳胺
上述N-烷基化反應都是采用芳胺為初始原料,而芳胺主要由芳香硝基化合物通過化學還原法或者催化加氫法制得,導致產物分離難,效率不高。因此,如果把上述兩個工藝放在同一反應器內進行,則簡化了生產步驟,提高了生產效率、降低了成本。且中間產物不需要分離,避免了大多數芳胺毒性大、易變質、不易儲存的缺點,是一種有較大發展前途的生產工藝。近年來也有很多相關報道。
3.1 以羰基化合物為烷基化試劑
Bae等[29-30]以10% Pd/C為催化劑,羰基化合物為烷基化試劑,采用B10H14為還原劑,室溫下將芳香硝基化合物與羰基化合物一鍋法合成N-烷基芳胺,最高可得到單烷基芳胺的收率為93%。在該反應中B10H14分兩次加入,首先添加30%將硝基還原為氨基,再加入20%進行還原胺基化反應。對含不同取代基的芳香硝基化合物進行N-烷基化反應,得到N-單烷基化產物的收率為84%~93%。此外,當向反應體系中添加37%的甲醛溶液時,則可以得到三級胺(圖4)。不同取代基團的芳香硝基化合物依次與酮和甲醛反應,常溫下得到三級芳胺的收率為72%~99%。
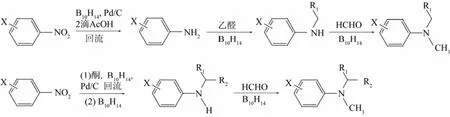
圖4 以B10H14為還原劑制備N-烷基芳胺
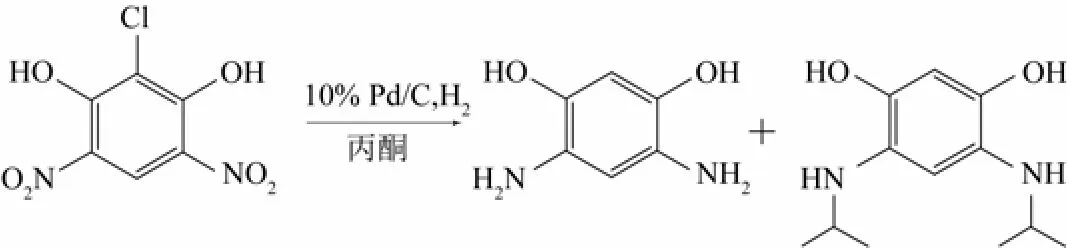
圖5 二硝基物的N-烷基化反應
Byun等[31]也以Pd/C為催化劑,在醇水溶劑中以甲酸銨作為原位氫供體,將芳香硝基化合物與醛反應合成N-單烷基取代芳胺。考察不同的溶劑對產物收率的影響。結果表明,在i-PrOH/H2O (10∶1,體積比)環境下得到N-單烷基芳胺的收率最高,且不生成N,N-二烷基取代產物。不同的脂肪醛與硝基苯反應,得到N-單烷基苯胺的收率為50%~98%,含不同取代基團的芳香硝基化合物與丁醛反應,都能順利完成。其中當取代基團為供電子基團時,N-丁基芳胺的收率為88%~99%,而當取代基團為吸電子基團時,反應效果較差,N-丁基芳胺的收率為49%~78%。
Sydnes等[32]以10% Pd/C為催化劑,脂肪醛為烷基化試劑,H2為還原劑,一鍋法合成N-單烷基芳胺。反應1 h得到的產物全是芳胺,延長反應時間,則得到N-單烷基芳胺。考察了醛的用量對產物的影響。結果表明,當醛的摩爾用量為反應物的1.0~1.7倍時,得到的都只是N-單烷基化產物。但對于甲醛而言,則必須控制用量,否則很容易得到二取代烷基胺。此外,通過改變反應條件,可以使芳香硝基物與甲醛的收率由61%提高到99%。
Dell’Anna等[33]以聚合物負載的Pd為催化劑,以H2為還原劑,硝基化合物與羰基化合物一鍋法合成N-單烷基芳胺。考察不同芳香衍生物與苯甲醛反應情況。實驗表明,對于含有供電子基團的物質,單烷基化收率在93%以上,而含有吸電子基團的收率稍低,為82%。當同時含有兩個硝基時,得到70%的二取代烷基芳胺。不同的脂肪醛與硝基苯反應,得到N-單烷基苯胺的選擇性為75%~85%。而對于芳香醛效果相對較差,但延長反應時間可以提高收率。
Sreedhar等[34]以阿拉伯樹膠(GA)為穩定劑制備膠體Pd納米顆粒催化劑,在1 atm H2、室溫下將芳香硝基化合物與不同的醛反應合成N-烷基芳胺。結果表明,對于含有不同取代基團的芳香醛和脂肪醛與硝基苯的反應效果都很好,得到N-單烷基芳胺的收率為85%~96%。對于含有不同取代基團的芳香硝基化合物與苯甲醛反應,得到N-單烷基芳胺的收率為76%~92%。如果以酮作為烷基化試劑,則無催化活性。
Jin等[35]考察了芳環上含有兩個硝基的化合物與丙酮在10% Pd/C催化劑作用下的反應(圖5)。在該反應中,反應條件對產物的分布有很大的影響。以乙酸為溶劑,當乙酸的量為0~40 mL時,反應3 min后,4,6-二氨基-1,3-苯二酚(DAR)的收率從0增至93%。延長反應時間至90 min,則4,6-二(異丙基氨基)-1,3-苯二酚(BPAR)的收率從21%增至98%。此外,丙酮在該反應中起著重要的作用,當溶劑中丙酮與2-丙醇的體積比從0∶1變為1∶0時,對產物的選擇性有很大的影響,BPAR的收率由0增至98%。此外,氫壓對反應也有一定的影響。
Yamane等[36]以Au/Fe2O3為催化劑,在2 MPa H2、120 ℃下硝基苯與苯甲醛反應得到單烷基取代物。結果顯示,當硝基物與醛的摩爾比為1∶1.5、反應6 h時,得到單烷基化產物收率為80%。當硝基物中含有供電子基團時,收率95%以上,而含有吸電子基團時,收率為71%。
3.2 以腈為烷基化試劑
Nacario等[37]以Pd/C為催化劑、腈為烷基化試劑、甲酸銨為氫源,在室溫下將硝基化合物還原烷基化為相應的二級胺。在該反應中,乙腈用量較大,因為其既是反應物,又是溶劑。向反應體系中加入適量的甲醇,既能提高硝基物的溶解度,又能提高腈的溶解度。對于含有不同取代基團的芳香硝基化合物與脂肪腈反應,得到N-單烷基芳胺的收率為71%~100%。對于脂肪族硝基化合物,反應效果相對較差,容易生成N,N-二取代胺。
Reddy等[38]以Pd(OH)2/C為催化劑,聚甲基氫硅氧烷(PMHS)為還原劑,室溫下芳香硝基化合物與腈反應合成N-單烷基芳胺。考察含不同取代基團的芳香硝基化合物與乙腈的反應,得到N-乙基芳胺的收率為63%~73%,但該催化劑不能重復使用。
Ikawa等[39]以Pd/C和Rh/C為催化劑,H2為還原劑,室溫下芳香硝基化合物與乙腈反應合成N-烷基芳胺。結果表明,當溶劑中添加乙酸乙酯(AcOEt)時,AcOEt與Pd形成弱的相互作用,從而有效地抑制了二烷基取代,而向體系中添加適量的乙酸銨(AcONH4)則可以有效地提高催化活性。當取代基團中含有苯環時,由于空間效應,得到的產物大部分為芳胺。如果延長反應時間,生成二取代產物的量增加。同時考察了不同腈與硝基苯的反應情況。結果表明,直鏈和支鏈腈與硝基苯反應都得到N-單烷基苯胺,但對于有空間位阻的腈,反應效果較差,只能得到苯胺。
3.3 以醇為烷基化試劑
吳祖望等[40-41]采用Raney Ni為催化劑,將硝基物的還原反應和N-烷基化反應在同一個反應釜中進行,加氫反應溫度為50~150 ℃,氫氣壓力為0.5~4.0 MPa,反應0.5~3 h,烷基化反應溫度為50~250 ℃,壓力為0.2~3.0 MPa,硝基物的轉化率≥99%,胺基物的轉化率≥90%,N-單烷基物的選擇性≥85%。同時考察了取代基團的位置和性質以及醇的結構對產物的影響。結果表明,空間效應是影響N-烷基化反應以及各種副反應發生的關鍵因素。與大部分直鏈醇反應得到N-單烷基芳胺的產率都很高,但由于甲醇較難脫氫,導致反應效果差。含支鏈的醇由于空間反應效果也較差。
Feng等[42]以Ru為催化劑,芳香硝基化合物和芳醇反應制備N,N-二烷基苯胺。考察催化劑以及配體對反應的影響,結果表明,以Ru(CO)H2(PPh3)3為催化劑、N-雜環卡賓(NHC)為配體時,在150 ℃下反應16 h后得到二烷基化產物的收率最高,為96%。與脂肪醇反應,得到54%~68%的二烷基取代芳胺。但該反應體系對二元醇幾乎無活性。Cui等[43]以Ru為催化劑,考察不同配體對N-烷基化反應的影響。研究表明,當不加任何配體時,得到的都是亞胺。而以[Ru(p-cymene)Cl2]2為催化劑,1,4-雙(二苯膦基)丁烷(DPPB)為配體,在K2CO3存在下,N-烷基化的選擇性達到97%。對不同的硝基物與醇反應,得到N-烷基胺的收率為73%~95%。Lee等[44]以Ru為催化劑,磷酸銨為配體,在適當的t-BuOK存在下,將芳香硝基化合物與芳醇于150℃反應24 h。結果表明,當在空氣中反應時,生成一定量的亞胺中間體,而向反應中通入1 atm的H2時,則全部得到N-單烷基取代芳胺,但與仲醇的反應效果較差。
Peng等[45]以Au為催化劑,將硝基化合物與醇反應合成N-烷基胺。研究表明,采用不同的氧化物為載體,只有Fe2O3的效果最好,增加Au的量對反應的轉化率影響不大,但是能夠顯著地提高單烷基化的選擇性。有趣的是,可以通過改變反應條件選擇性地得到單烷基化合物或二烷基化合物,且得到的產率都在80%以上。但該催化劑對直鏈醇無催化活性。
上述研究都是從芳香硝基化合物為初始原料,一鍋法合成N-烷基胺。但還存在一些問題,如需要用到外加氫氣,有些需要用到有機配體和堿,對環境造成一定的影響,產物需要分離,反應時間長,催化效率低。為了避免使用各種有機添加劑、堿以及氫氣,許多研究者致力于醇/水體系重整制氫,提高催化效率,避免使用外加氫氣。
作者課題組曾提出了原位液相催化加氫反應體系[46-50],即將含氧化合物的液相重整制氫所得的活化氫直接用于液相加氫反應,從而可以避免使用外加氫源,提高操作的安全性。沈穎旎等[51]以Pt/Al2O3為催化劑,在固定床反應器中,以醇/水重整制氫為氫源,將硝基苯還原制備苯胺與苯胺N-烷基化反應相耦合。考察水的含量以及原料濃度對反應的影響,結果表明,當醇水體積比為70∶30時,硝基苯的質量濃度為8%時,反應效果最好,得到N-乙基和N,N-二乙基苯胺的總收率達到99.5%。Li 等[52-53]以Raney-Ni為催化劑,甲醇與硝基苯合成N,N-二甲基苯胺,考察反應溫度以及水在反應中作用。結果顯示,反應溫度越高,得到二烷基胺的收率也越大,443 K達到最大為94.4%。當添加適當的水后,苯環容易加氫成環己烷,導致烷基化產物的選擇性降低。這主要是因為有水存在下,水與醇容易制氫使整個體系處于富氫狀態,從而使苯環加氫。Xiang等[54]以Pd為催化劑,硝基苯與甲醇在固定床反應器中進行,重點探討水在其中的作用。結果表明,在水存在下可以大大提高反應的轉化率和選擇性,且甲醇是最好的氫供體。此外,該反應中氫來自于甲醇和水重整,因而原子利用率大大提高。
上述研究中,以羰基化合物和腈為烷基化試劑的反應,大部分都需要使用還原劑,且需要嚴格控制羰基化合物的用量,反應時間長,催化效率低。以醇為烷基化試劑的反應中,在溫和的反應條件下不需要添加任何配體、還原劑的反應體系是目前研究的熱點。
4 展 望
N-烷基芳胺在染料、橡膠工業、制藥、精細化工等很多領域有廣泛的應用價值,隨著應用領域的開拓和發展,其需求量逐年增加。以芳胺為初始原料合成工藝中,芳胺需要經過芳香硝基化合物還原制得,生產工藝復雜,整體收率低,生產成本高。而以芳香硝基化合物為原料一鍋法合成N-烷基芳胺這一工藝具有反應過程及分離操作簡便、能耗低、三廢污染少等特點,具有良好的發展前景。在以芳香硝基化合物為原料一鍋法合成N-烷基芳胺工藝中,可以在以下幾個方面展開重點研究:①開發出能夠在常溫常壓下,以醇為烷基化試劑,不添加任何助劑的廉價催化劑;②能夠很好地控制烷基化產物的選擇性,通過控制反應條件選擇性得到相應的N-(單、雙)烷基芳胺;③開發出既對脂肪族硝基化合物又對芳香族硝基化合物都有很好活性的催化劑。
[1] Kim J S,Shon O J,Rim J A,et al. Pyrene-armed calix azacrowns as new fluorescent ionophores:Molecular taekwondo process via fluorescence change[J]. J. Org. Chem.,2002,67:2348-2351.
[2] Sunwanprasop S,Nhujak T,Roengsumran S,et al. Petroleum marker dyes synthesized from cardanol and aniline derivatives[J]. Ind. Eng. Chem. Res.,2004,43:4973-4978.
[3] Hargis D C. Catalytic alkylation of aromatic amines with alkanols:US,4613 705[P]. 1986.
[4] 楊慶榮.苯胺的生產現狀及市場分析[J]. 河南化工,2005,22:12-13.
[5] Narayanan S,Deshpande K. Aniline alkylation over solid acid catalysts[J]. Appl. Catal. A:Gen.,2000,199(1):1-31.
[6] Hamid M H S A,Slatford P A,Williams J M J. Borrowing hydrogen in the activation of alcohols[J]. Adv. Synth. Catal.,2007,349:1555-1557.
[7] 周小建,吳祖望. 芳胺N-單烷基化定向控制工藝進展[J]. 化工進展,1996,15(1):5-9.
[8] 師華,陸峰,熊家錦,等. 芳胺的N-烷基化反應[J]. 精細化工中間體,2008,38:8-11.
[9] Basu B,Paul S,Nanda A K. Highly selective N-alkylation of amines promoted on silica:An efficient and recyclable surface[J]. Green Chem.,2009,11:1115-1120.
[10] Gawande M B,Deshpande S S,Satam J R,et al. A novel N-alkylation of amines by alkyl halides on mixed oxides at room temperature[J]. Catal. Commun.,2007,8:576-582.
[11] Gomez S,Peters J A,Maschmeyer T. The reductive amination of aldehydes and ketones and the hydrogenation of nitriles:Mechanistic aspects and selectivity control[J]. Adv. Synth. Catal.,2002,10:344.
[12] Stoter R,Carrera D E,Ni Y,et al. Enantioselective organocatalytic reductive amination[J]. J. Am. Chem. Soc.,2006,128:84-86.
[13] Mizuta T,Sakaguchi S,Ishii Y. Catalytic reductive alkylation of secondary amine with aldehyde and silane by an iridium compound[J]. J. Org. Chem.,2005,70:2195-2199.
[14] Saidi O,Blacker A J,Farah M M,et al. Iridium-catalysed amine alkylation with alcohols in water[J]. Chem. Commun.,2010,46:1541-1543.
[15] Hamid M H S A,Williams J M J. Ruthenium catalysed N-alkylation of amines with alcohols[J]. Chem. Commun.,2007(7):725-727.
[16] Hamid M H S A,Allen C L,Lamb G W,et al. Ruthenium-catalyzed N-alkylation of amines and sulfonamides using borrowing hydrogen methodology[J]. J. Am. Chem. Soc.,2009,131:1766-1774.
[17] Kwon M S,Kim S,Park S,et al. One-pot synthesis of imines and secondary amines by Pd-catalyzed coupling of benzyl alcohols and primary amines[J]. J. Org. Chem.,2009,74:2877-2879.
[18] Martinez R,Ramon D J,Yus M. Selective N-monoalkylation of aromatic amines with benzylic alcohols by a hydrogen autotransfer process catalyzed by unmodified magnetite[J]. Org. Biomol. Chem.,2009,7:2176-2181.
[19] Likhar P R,Arundhathi R,Kantam M L,et al. Amination of alcohols catalyzed by copper-aluminium hydrotalcite:A green synthesis of amines[J]. Eur. J. Org. Chem.,2009,31:5383-5389.
[20] Zhang Y,Qi X J,Cui X J,et al. Palladium catalyzed N-alkylation of amines with alcohols[J]. Tetrahedron Lett.,2011,52:1334-1338.
[21] Fujita K,Li Z,Ozeki N,et al. N-alkylation of amines with alcohols catalyzed by Cp*Ir complex[J]. Tetrahedron Lett.,2003,44:2687-2690.
[22] Yadav G D,Doshi N S. Alkylation of aniline with methyl-tert-butyl ether (MTBE) and tert-butanol over solid acids:Product distribution and kinetics[J]. J. Mol. Catal. A:Chem.,2003,194:195-209.
[23] Nehate M,Bokade V V. Selective N-alkylation of aniline with methanol over a heteropolyacid on montmorillonite K10[J]. Appl. Clay Sci.,2009,44:255-258.
[24] Luque R,Campelo J M,Luna D,et al. Catalytic performance of Al-MCM-41 materials in the N-alkylation of aniline[J]. J. Mol. Catal. A:Chem.,2007,269:190-196.
[25] 鄭海濤,陶克毅. 氣相法合成N,N-二乙基苯胺[J]. 石油化工,2001,30:844-846.
[26] 臧雅茹,陶克毅,趙永記,等. 苯胺氣相N-甲基化反應與動力學研究[J]. 石油化工,1991,20:671-676.
[27] 唐靖,陳駿如,李瑞祥,等. 芳胺常壓氣相N-烷基化反應研究[J].化學研究和應用,1996,8:402-407.
[28] Vijayaraj M,Gopinath C S. Selective mono-N-methylation of aniline substrates on Cu1-xZnxFe2O4[J]. Appl. Catal. A:Gen.,2007,320:64-68.
[29] Bae J W,Cho Y J,Lee S H,et al. A one-pot synthesis of N-alkylaminobenzenes from nitroaromatics:Reduction followed by reductive amination using B10H14[J]. Chem. Commun.,2000(19):1857-1858.
[30] Jung Y J,Bae J W,Park E S,et al. An efficient conversion of nitroaromatics and aromatic amines to tertiary amines in one-pot way[J]. Tetrahedron,2003,59:10331-10338.
[31] Byun E,Hong B,Castro K A,et al. One-pot reductive mono-N-alkylation of aniline and nitroarene derivatives using aldehydes[J]. J. Org. Chem.,2007,72:9815-9817.
[32] Sydnes M O,Isobe M. One-pot reductive monoalkylation of nitro aryls with hydrogen over Pd/C[J]. Tetrahedron Lett.,2008,49:1199-1202.
[33] Dell’Anna M M,Mastrorilli P,Rizzuti A,et al. One-pot synthesis of aniline derivatives from nitroarenes under mild conditions promoted by a recyclable polymer-supported palladium catalyst[J]. Appl. Catal. A:Gen.,2011,401:134-140.
[34] Sreedhar B,Reddy P S,Devi D K. Direct one-pot reductive amination of aldehydes with nitroarenes in a domino fashion:Catalysis by gum-acacia-stabilized palladium nanoparticles[J]. J. Org. Chem.,2009,74:8806-8809.
[35] Jin Z H,Li D,Ma R,et al. One-pot method to synthesize 4,6-bis(isopropylamino)-benzene-1,3-diol by catalytic reductive mono-N-alkylation of amine derivatives[J]. Chim. J. Catal.,2008,29:878-880.
[36] Yamane Y,Liu X,Hanasaki A,et al. One-pot synthesis of Indoles and aniline derivatives from nitroarenes under hydrogenation condition with supported gold nanoparticles[J]. Org. Lett.,2009,11:5162-5165.
[37] Nacario R,Kotakonda S,Fouchard D M D,et al. Reductive monoalkylation of aromatic and aliphatic nitro compounds and the corresponding amines with nitriles[J]. Org. Lett.,2005,7:471-474.
[38] Reddy C R,Vijeender K,Bhusan P B,et al. Reductive N-alkylation of aromatic amines and nitro compounds with nitrils using polymethylhydrosiloxane[J]. Tetrahedron Lett.,2007,48:2765-2768.
[39] Ikawa T,Fujita Y,Mizusaki T,et al. Selective N-alkylation of amines using nitriles under hydrogenation conditions:Facile synthesis of secondary and tertiary amines[J]. Org. Biomol. Chem.,2012,10:293-304.
[40] 吳祖望,周小建,林莉,等. 硝基物還原-烷基化制N-單烷基芳胺:中國,1127748A[P]. 1996-07-31.
[41] Zhou X J,Wu Z W,Lin L,et al. Studies on the selective synthesis of N-monoalkyl aromatic amines[J]. Dyes Pigments,1999,40:205-209.
[42] Feng C,Liu Y,Peng S M,et al. Ruthenium-catalyzed tertiary amine fornation from nitroarenes and alcohols[J]. Org. Lett.,2010,12:4888-4891.
[43] Cui X J,Zhang Y,Shi F,et al. Ruthenium-catalyzed nitro and nitrile compounds coupling with alcohols:Alternative route for N-substitued amine synthesis[J]. Chem. Eur. J.,2011,17:2587-2591.
[44] Lee C C,Liu S T. Preparation of secondary and tertiary amines from nitroarenes and alcohols[J]. Chem. Commun.,2011,47:6981-6983.
[45] Peng Q L,Zhang Y,Shi F,et al. Fe2O3-supported nano-gold catalyzed one-pot synthesis of N-alkylated anilines from nitroarenes and alcohols[J]. Chem. Commun.,2011,47:6476-6478.
[46] 嚴新煥,李小年,羅雄軍,等. 一種苯胺的制備方法:中國,1660 771[P]. 2005-08-31.
[47] 嚴新煥,李小年,羅雄軍,等. 一種鄰氯苯胺的制備方法:中國,1 660 774[P]. 2005-08-31.
[48] 楊建峰,孫軍慶,李小年,等. 利用乙醇重整制氫進行硝基苯原位液相加氫合成苯胺[J]. 催化學報,2006,27:559-561.
[49] 姜莉,祝一鋒,項益智,等. 甲醇水相重整制氫原位還原苯乙酮制備α-苯乙醇[J]. 催化學報,2007,28:281-286.
[50] 李小年,項益智. 一類新的液相催化氫化反應體系[J]. 中國科學B輯,2007,37:136-142.
[51] 沈穎旎,羅智偉,嚴新煥. 原位液相催化加氫法合成N-乙基苯胺和N,N-二乙基苯胺[J]. 催化學報,2008,29:612-616.
[52] Xu L,Li X N,Zhu Y F,et al. One-pot synthesis of N,N-dimethylaniline from nitrobenzene and methanol[J]. New J. Chem.,2009,33:2051-2054.
[53] 李小年,張軍華,項益智,等. 硝基苯和乙醇一鍋法合成N-乙基苯胺[J]. 中國科學 B輯:化學,2008,38:27-34.
[54] Xiang Y Z,Li X N,Lu C S,et al. Water-improved heterogeneous transfer hydrogenation using methanol as hydrogen donor over Pd-based catalyst[J]. Appl. Catal. A:Gen.,2010,375:289-294.
Progress in the synthesis of N-alkyl anilines
YANG Fang,YAN Xinhuan
(State Key Laboratory Breeding Base of Green Chemistry Synthesis Technology,Zhejiang University of Technology,Hangzhou 310014,Zhejiang,China)
N-alkyl anilines are widely used as synthetic intermediates for pharmaceuticals,agrochemicals,fine chemicals,bioactive compounds,and dyes chemicals. The mechanism and the research process of N-alkylation of aromatic amines with corresponding alkylating agents,such as alkyl halides,carbonyl compounds and alcohols were summarized in this paper. The one-pot synthesis of N-alkyl anilines from nitroaromatics as starting material with carbonyl compounds,nitriles and alcohols was highlighted. Recently,much attention has been paid to the use of alcohols as alkylating reagents for the N-alkylation of nitroaromatics due to the mild reaction conditions,without additional organic ligand. Therefore,the development of efficient catalyst for N-alkylation system with alcohol is still a challenging goal.
anilines;nitroaromatics;N-alkyl anilines;N-alkylation
TQ 246.3
A
1000-6613(2012)06-1306-08
2011-12-19;修改稿日期:2012-01-29。
國家自然科學基金(21076197)及浙江省自然科學基金
(Y4090440)項目。
楊芳(1987—),女,碩士研究生。聯系人:嚴新煥,教授,博士生導師,研究方向為催化加氫。E-mail xinhuanyan139@hotmail.com。

