殼寡糖制備過程中還原糖的全自動電化學測定
李雪梅,史建國,*,鄭 暉,馬耀宏,李秋順
(1.山東省科學院生物研究所,山東濟南 250014; 2.山東省生物傳感器重點實驗室,山東濟南 250014)
殼寡糖制備過程中還原糖的全自動電化學測定
李雪梅1,2,史建國1,2,*,鄭 暉1,馬耀宏1,2,李秋順1
(1.山東省科學院生物研究所,山東濟南 250014; 2.山東省生物傳感器重點實驗室,山東濟南 250014)
采用還原糖電化學分析儀測定殼寡糖制備過程中還原糖的含量。儀器線性范圍0.005%~0.500%氨基葡萄糖,檢測限為0.005%。通過還原糖含量的變化,研究了不同酶促條件如溫度、pH、底物濃度對反應的影響,優化了酶解工藝,并得到酶促反應中還原糖濃度變化與產物聚合度的關系。通過實驗發現,還原糖電化學分析儀適合測定殼寡糖制備過程低濃度還原糖,儀器方法快速、準確、靈敏度高。
殼寡糖,還原糖,電化學測定,酶解
殼寡糖(chitosan oligosaccharide)是殼聚糖降解的產物,不僅具有水溶性好,易吸收等優點,近年來還發現其具有抗腫瘤、抗菌、免疫激活以及保濕吸濕等獨特的生理活性[1-2],其應用前景倍受矚目。目前制備殼寡糖的方法主要有化學降解法和酶降解法[3-4],酸解法殼寡糖得率低、水解產物復雜、分離困難,且對環境污染嚴重[5]。酶解法是利用非專一性酶或專一性酶對殼聚糖進行降解的方法,因反應條件溫和而被認為極具工業化生產價值,而選擇何種酶以及酶解條件又成為酶解法制備殼寡糖的關鍵[6]。優化酶解工藝,實現多糖的可控降解,可以提高目標產品收率,降低生產成本。在生產實踐中若能通過研究不同酶解條件下還原糖的濃度變化規律,得到酶解過程還原糖濃度與產物得率的關系,從而優化酶解條件。還原糖作為糖酶解過程中重要的生化指標,其測定方法的快速、準確、便捷顯得尤為重要。目前殼寡糖制備過程還原糖檢測方法常用DNS比色法[7-9],此方法手工操作較復雜、渾濁,和有不同顏色的樣品有很大的干擾。殼寡糖生產過程中產生還原糖含量較低,常規斐林滴定法、全自動還原糖分析儀[10]等其他方法達不到檢測靈敏度。目前還未見有測定低濃度還原糖的準確、快速的自動化分析技術的報道。本文根據以前的工作基礎[11-12],研制出了還原糖的自動化測定儀器,用于測定殼寡糖制備過程中低濃度還原糖。提高測定的速度和準確度,降低測試成本。得到還原糖濃度與酶解產物的相關性。
1 材料與方法
1.1 材料與儀器
殼聚糖 脫乙酰度>90%,上海生工;β-葡聚糖酶(β-Glucanase) 諾維信酶制劑公司,活性100FBG/g(真菌β-葡聚糖單位);氨基葡萄糖鹽酸鹽BIO Basic Inc;其它試劑均為分析純。
SGD-4A型還原糖電化學分析儀 山東省科學院生物研究所;KQ-50B型超聲波清洗器 昆山市超聲儀器公司;Allegra 64R冷凍離心機 美國Beckman公司;HH-6數顯恒溫水浴鍋 金壇市精達儀器制造有限公司;玻碳電極 直徑4mm,天津艾達恒晟科技發展有限公司;Ag/AgCl參比電極 上海辰華儀器有限公司。
1.2 實驗方法
將不同量的殼聚糖溶解在50m L一定pH的乙酸-乙酸鈉(0.2mol/L)緩沖液中,配制成為反應底物溶液,將此溶液置于20~80℃溫度范圍內,使其與反應溫度達到一致。然后向底物溶液中加入β-葡聚糖酶液5m L,混合均勻,反應一定時間后測定還原糖的濃度。
1.2.1 還原糖濃度測定 還原糖濃度用還原糖電化學分析儀測定:在儲液瓶中加入 0.8%(w/v) K3Fe(CN)6和2.5%NaOH混合溶液。開機后油浴加熱啟動,自動升溫至90℃;自動顯示“準備就緒”,按“運行”鍵,等儀器顯示“定標,請進標樣”,取10μL 0.5%的標準氨基葡萄糖進樣定標,連續定標兩次后,儀器自動提示“測樣,請進樣品”,取酶解液10μL進樣測定,儀器打印測定結果。此結果乘以樣品稀釋倍數即為被測定樣品中還原糖的含量。
每份樣品同時采用DNS(3,5-二硝基水楊酸)法做對照實驗:分別取出一定量的酶解液加入0.2mol/L的乙酸-乙酸鈉緩沖液(pH5.8)補至 2m L,再加1.5m L DNS,沸水浴中反應5m in后,定容至25m L,于520nm測定吸光度。同時,利用氨基葡萄糖鹽酸鹽繪制標準曲線,從而計算酶解產物中還原糖含量。
1.2.2 平均聚合度測定 取1m L酶解液,用還原糖電化學分析儀測定出還原糖的量C0。另取相同溶液1m L,加入3m L 12mol/L鹽酸,沸水浴2h。用適量6mol/L NaOH溶液中和水解液后,用蒸餾水稀釋定容至25m L。取稀釋后的水溶液1m L,同樣用還原糖電化學分析儀測出還原糖量C1。若C0與C1均處于儀器線性范圍之內,則殼寡糖的平均聚合度計算:
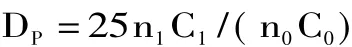
式中:n0、n1分別為酸解前和酸解后酶解液的稀釋倍數。
2 結果與討論
2.1 標準品的選擇
殼寡糖是由氨基葡萄糖以β-1,4鍵連接2~10個單元的低聚糖,所以測定殼寡糖制備過程中的還原糖需用氨基葡萄糖做標準。王英瑛等[13]比較了USP法、HPLC衍生化法和紫外分光光度法測定氨基葡萄糖含量的準確性和可靠性。其中,紫外分光光度法采用在碳酸鈉溶液環境下,鐵氰化鉀與氨基葡萄糖反應后在420nm處測定吸收值,在0.2~0.8mg/m L (0.02%~0.08%)內線性關系良好。說明利用氨基葡萄糖與鐵氰化鉀的反應來測定氨基葡萄糖是可行的。
2.2 儀器線性范圍及檢測限
用干燥恒重后的氨基葡萄糖鹽酸鹽配制不同濃度的氨基葡萄糖溶液:0.500%、0.200%、0.100%、0.050%、0.020%、0.010%、0.005%(w/v)。以氨基葡萄糖標準濃度做橫坐標,以測定電流的平均值做縱坐標,得到儀器標準工作曲線(圖1),即線性范圍。在0.005%~0.500%范圍內線性回歸分析,線性回歸方程為i=5.85+27.27C,相關系數r為0.9999,線性相關性良好。
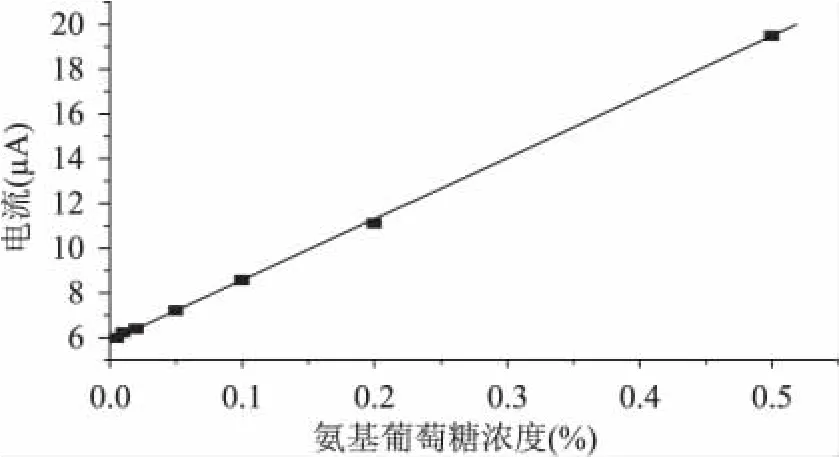
圖1 氨基葡萄糖溶液的標準工作曲線Fig.1 Standard curve for determination of glucosamine
由表1測定電流的標準偏差(0.042)的3倍與工作曲線斜率(27.27)之比,得最低檢測限為0.005%,即5×10-2mg/m L。

表1 0.100%氨基葡萄糖測定結果Table 1 Measurement results of 0.100%glucosamine
2.3 酶促反應條件的研究
2.3.1 溫度對酶促反應的影響 將0.5g殼聚糖溶解在50m L pH為5.0的乙酸-乙酸鈉(0.2mol/L)緩沖液中,配制成為反應底物溶液,將此溶液置于20~80℃溫度內,使其與反應溫度達到一致。然后在此溶液中加入β-葡聚糖酶5m L混合均勻,在此溫度下反應2h,分別用還原糖電化學分析儀和DNS法測定各個溫度下的還原糖的濃度,結果見圖2。t檢驗,p>0.05表明兩種分析方法無顯著差異。由此可以看出,當溫度低于25℃時,酶的活性很低。隨著溫度逐漸升高,β-葡聚糖酶的酶活也逐漸升高;當溫度升至45℃時,酶活力升至最高;當溫度升至65℃時酶活迅速下降,最后變性失活。溫度對酶有著雙重影響,一方面升高溫度可以提高反應速率;但另一方面由于酶的本質是蛋白質,隨著溫度的升高,酶會逐漸地變性失活。因此酶的最適溫度是考慮兩方面影響的綜合結果。本實驗選擇酶的最適反應溫度為45℃。
2.3.2 pH對酶促反應的影響 分別取50m L乙酸-乙酸鈉配成的pH為4.0~5.8的緩沖液,在其中加入0.5g殼聚糖,攪拌均勻,加入5m Lβ-葡聚糖酶后置于45℃下反應2h,用還原糖電化學分析儀和DNS法分別測定各pH下還原糖的濃度,結果見圖3。t檢驗,p=0.937(>0.05),表明兩種分析方法無顯著差異。由圖3可見,此反應的最適pH為5.0。當pH低于5.0時,尤其是pH在4.0~4.8的時候,反應液的粘度非常大,必然影響酶解的進行,當pH達到5.0時,溶液處于非均相狀態,這使酶與底物的接觸面積大大增加。當pH大于5.0后,雖然粘度降低,但是還原糖濃度也開始下降。pH對β-葡聚糖酶活力的影響主要是因為pH既能影響酶分子功能基團的解離狀態,又能影響殼聚糖分子的溶解性能和分子鏈的舒展狀態。
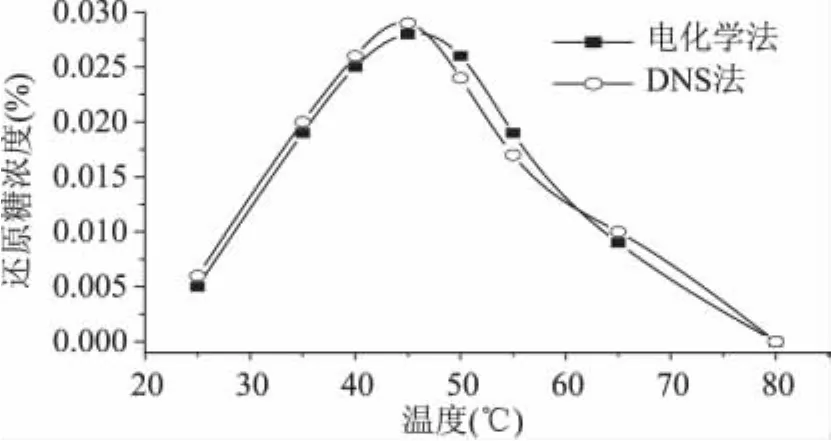
圖2 溫度對酶促反應的影響Fig.2 Influence of temperature on the enzymatic reaction

圖3 pH對酶促反應的影響Fig.3 Influence of pH on the enzymatic reaction
2.3.3 底物濃度對酶促反應的影響 將不同質量的殼聚糖分別溶解在50m L pH為5.0的乙酸-乙酸鈉緩沖溶液中,加入5m Lβ-葡聚糖酶,攪拌均勻,在45℃下反應2h,用還原糖電化學分析儀和DNS法分別測定還原糖的濃度,結果見圖4。t檢驗,p=0.635 (>0.05),表明兩種分析方法無顯著差異。由圖4顯示,此反應的最適底物濃度為4mg/m L。當底物濃度小于4mg/m L時,隨著底物濃度的增加,還原糖濃度增加;當底物濃度大于4mg/m L時,還原糖的濃度又略微下降。這主要是因為底物濃度高時,單糖和二糖的濃度也有所提高,從而表現出更明顯的產物抑制作用。另外,隨著底物濃度的增加,殼聚糖粘度也不斷升高,使酶分子的擴散和底物分子的傳遞都受到了影響,從而影響了酶的催化性能。
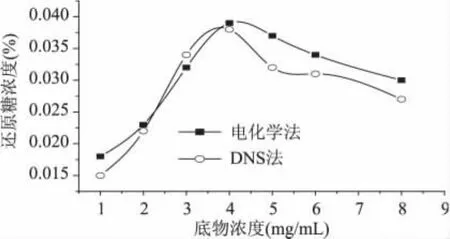
圖4 底物濃度對酶促反應的影響Fig.4 Influence of substrate concentration on enzymatic reaction
2.4 酶促反應中還原糖濃度隨時間的變化及與產物聚合度的關系
根據對溫度、pH和底物濃度對酶促反應影響的分析,確定最適宜的酶促反應條件。稱取2g殼聚糖溶解在500m L,pH為5.0的乙酸-乙酸鈉緩沖溶液中,溫度為45℃,加入β-葡聚糖酶液,在此期間每間隔2h測定一次還原糖濃度,并計算酶促反應過程中的平均聚合度,結果如圖5所示。隨著酶促反應的進行,還原糖的濃度不斷上升,同時殼聚糖的平均聚合度逐漸降低。到了11h以后,還原糖濃度上升的趨勢更為明顯,其原因是此時反應溶液的濃度下降,流動性增大,使酶的作用面積和幾率增大。當酶促反應進行到13h左右時,產物聚合度降到15;當酶促反應進行到15h即可得到聚合度小于10的殼寡糖。
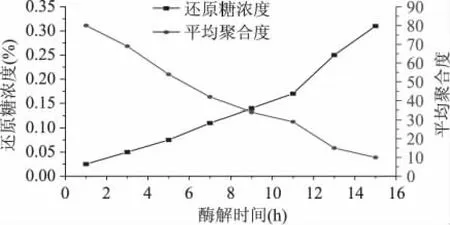
圖5 不同時間還原糖濃度與聚合度的關系Fig.5 Relationship between the reducing sugar concentration and polymerization degree at different times
3 結論
由以上實驗結果可見,用還原糖電化學分析儀檢測還原糖濃度的方法方便快捷、準確,與DNS法的對照數據證明了其可靠性。在酶促反應過程中,通過測定酶解液還原糖濃度可以優化酶解工藝,可控制產物的聚合度。
[1]Jeon Y J,Park P T,Kim S K.Antimicrobial effect of chitooligosaccharides produced by bioreactor[J].Carbohydrate Polymer,2001,44(1):71-76.
[2]Yamada A,Shibuya N,Kodama O.Induction of phytoalexin formation in suspension- cultured rice cells by N -acetylchitooligosaccharides[J] .Bioscience Biotechnology Biochemistry,1993,57(3):405-409.
[3]IIyina A V,Tikhonov V E,Albulov A I,et al.Enzymic preparation of acid-free-water-soluble chitosan[J].Process Biochemistry,2000,35(6):563-568.
[4]Jeon Y J,Kim SK.Production of chitooligosaccharides using an ultrafiltration membrane reactor and their antibacterial activity[J].Carbohydrate Polymer,2000,41(2):133-141.
[5]張立彥,曾慶孝.酶法在低聚殼聚糖制備上的研究現狀及展望[J].湛江海洋大學學報,2000,20(4):72-77.
[6]涂紹勇,楊愛華,梅雙喜,等.酶法降解殼聚糖工藝研究[J].化學與生物工程,2009,26(12):63-65.
[7]曾嘉,鄭連英.通過酶促反應制備殼寡糖[J].食品與發酵工業,2002,27(10):1-4.
[8]戴大章,夏黎明,方祥年.殼聚糖的酶法降解[J].功能高分子學報,2005,18(4):687-691.
[9]孫玉英,張繼泉,王淑軍,等.酶促反應制備殼寡糖條件的研究[J].中國生物工程雜志,2008,28(11):67-71.
[10]史建國,楊艷,張利群,等.一種還原糖自動檢測系統[J].東南大學學報,2003,33(增刊):162-164.
[11]李雪梅,孟慶軍,楊俊慧,等.電化學法測定馬鈴薯全粉中還原糖的含量[J].食品工業科技,2008,29(11):257-259.
[12]李雪梅,史建國,朱思榮,等.淀粉糖生產過程中還原糖的半自動電化學檢測[J].食品工業科技,2009,30(12): 388-390.
[13]王英瑛,李俊,曾蘇.氨基葡萄糖3種含量測定方法的比較[J].中國現代應用藥學雜志,2009,26(4):307-309.
Automatic electrochem ical determ ination of reducing sugar during the preparation of chitosan oligosaccharide
LIXue-mei1,2,SH I Jian-guo1,2,*,ZHENG Hui1,MA Yao-hong1,2,LIQiu-shun1
(1.Biology Institute of Shandong Academy of Sciences,Jinan 250014,China; 2.Key Laboratory for Biosensors of Shandong Province,Jinan 250014,China)
Reducing sugar was measured using reducing sugar elec trochem ical analyzer during the p reparation of chitosan oligosaccharide.The linear range of g lucosam ine was from 0.005%to 0.500%,and detec tion lim it was 0.005%.The effec t of d ifferent enzymatic cond itions such as tem perature,pH,substrate concentration on the reaction were researched by changes of reducing sugar content.The enzymatic hyd rolysis p rocess had been op tim ized.The relationship between the deg ree of polym erization of the p roduc t and the reducing sugar concentration was got.Reducing sugar electrochem ical analyzer could determ ine reducing sugar of low concentrations during the p reparation of chitosan oligosaccharide,itwas fast,accurate,high sensitivity.
chitosan oligosaccharide;reducing sugar;electrochem ical determ ination;enzymatic hyd rolysis
TS201.2+3
A
1002-0306(2012)12-0087-04
2011-08-16 *通訊聯系人
李雪梅(1977-),女,博士,副研究員,研究方向:食品分析、生化分析。
山東省科技攻關項目(S2007GG10002004);山東省自然科學基金(Y2007D54);濟南市青年科技明星計劃(20080121);山東省博士后專項創新基金。

