基于雙向電泳和質譜聯用技術的水牛乳源酪蛋白的研究
向明霞,王麗娜,李子超,成希飛,徐明芳
(暨南大學生命科學技術學院生物工程系,廣東廣州 510632)
基于雙向電泳和質譜聯用技術的水牛乳源酪蛋白的研究
向明霞,王麗娜,李子超,成希飛,徐明芳*
(暨南大學生命科學技術學院生物工程系,廣東廣州 510632)
利用雙向電泳和基質輔助激光解吸電離飛行時間質譜(MALDI-MS)聯用技術對水牛乳酪蛋白與其他乳源蛋白差異性進行了研究。根據Image Master 2D Platinum圖像分析軟件對不同乳源酪蛋白的雙向電泳(2-DE)圖譜進行蛋白斑點的匹配分析,獲得21個存在于水牛奶中,主要分布在低豐度蛋白區的差異蛋白點,經質譜分析,得到4個屬于水牛奶酪蛋白的主要組分,另外發現兩個與水牛奶中的蛋白有較高同源性的新組分。
水牛奶,酪蛋白,雙向電泳,質譜
差異蛋白質組學是蛋白質組學研究的一個重要內容,其核心在于尋找不同樣本之間蛋白質組的區別和變化。當前,差異蛋白質組學的主要研究方法仍以雙向電泳(2-DE)分離和質譜(MS)鑒定聯合應用為主。以2-DE技術進行研究時,電泳圖上的差異蛋白點有三種表現形式:a.電泳遷移率的改變;b.蛋白點的出現或消失,蛋白點濃度的增大或減少;c.某種蛋白點分裂形成的異形體在濃度或位置上的改變[1]。蛋白質鑒定是蛋白質組學研究的一分支,傳統的鑒定方法有 Edman降解法、氨基酸分析法等。Edman降解法測定的肽序列非常準確,但速度較慢,費用較高。氨基酸分析法經濟快速,但靈敏度低。基質輔助激光解吸電離飛行時間質譜(MALDI-MS)和電噴霧質譜(ESI-MS)等質譜技術具有高敏感性、高分辨率,是目前進行蛋白質定性研究不可缺少的工具[2-3]。近年來,運用蛋白質組學技術對人、母馬以及反芻動物奶牛、綿羊和山羊[4]、小鼠[5]和小袋鼠[6]等乳蛋白質組進行了大量研究,例如,利用2-DE分析熱處理對乳蛋白的影響[7]、分析乳蛋白的遺傳多態性[8]等。Galvani等[9]選用pH3~7和pH4~7的兩種梯度膠條,采用2-DE對奶粉中的蛋白質進行分離,并對凝膠分離到的幾個高豐度蛋白質運用MALDITOF-MS進行了鑒定。然而,目前的研究主要集中在全乳蛋白及加工乳蛋白方面,而對水牛奶酪蛋白的研究則較少。本文主要通過2-DE研究水牛奶蛋白的主要組分及一些低豐度蛋白的分離,采用Image Master 2D Platinum圖像分析軟件對電泳圖譜上的水牛奶酪蛋白和乳牛奶酪蛋白及山羊奶酪蛋白進行蛋白斑點匹配,獲得差異蛋白,并利用MALDI-TOF-MS和MALDI-TOF/TOF-MS鑒定這些差異蛋白。
1 材料與方法
1.1 材料與儀器
巴氏殺菌奶(水牛奶、荷斯坦乳牛奶、山羊奶)零售商;固相pH梯度干膠條 pH4~7,13cm,廣州捷倍斯生物科技有限公司;Nuclease Mix、IPG-BUFFER PH4-7NL、硫脲、碘乙酞胺(IAA) 廣州佰路生物科技有限公司;丙烯酰胺、Tris-Base、十二烷基硫酸鈉(SDS)、二硫蘇糖醇(DTT) 廣州捷倍斯生物科技有限公司;甲叉丙烯酞胺 廣州展晨生物科技有限公司;尿素 Sigma公司;CHAPS、低熔點瓊脂糖、乙醇、乙酸、硫代硫酸鈉、無水乙酸鈉、無水碳酸鈉、甲醛、甘油、EDTA等 廣州化學試劑廠。
Image Scanner掃描儀 美國 GE公司;4800 MALDI-TOF/TOF串聯時間飛行質譜儀 美國ABI公司;KDC-2046型冷凍離心機 科大創新股份有限公司中佳分公司;Image Master 2D Platinum Software
AmershamBiosciences公司產品;Gene Quant pro紫外/可見光分光;EPS-601型 SDS-PAGE電泳儀; Ettan IPGphor3型等電聚焦儀等。
1.2 試劑的配制
1.2.1 儲備液 30%聚丙烯酰胺儲液(過濾使用,棕色瓶4℃ 冰箱保存);1.5mol/L Tris-Base,pH8.8;電泳緩沖液(含25mmol/L Tris-Base,192mmol/L甘氨酸,0.1%SDS);平衡儲液(含6mol/L尿素,30%甘油,2%SDS,3.35%1.5mol/L pH8.8 Tris-HCl);裂解液儲液(含7mol/L尿素,2mol/L硫脲,4%CHAPS,過濾使用,-20℃冰箱保存);水化儲液(含7mol/L尿素,2mol/L硫脲,2%CHAPS,一次性濾膜過濾使用,-20℃冰箱保存)。
1.2.2 實驗臨用配制的溶液 裂解液(100μL裂解液儲液,2μL IPG buffer,1.5μL 0.4g/m L DTT,1μL PMSF,1μL蛋白酶,1μL Nuclease Mix);水化液(500μL水化貯液,3.5μL 0.4g/m L DTT,2.5μL IPG buffer);膠條平衡緩沖液 A(20m L平衡儲液,0.2gDTT);膠條平衡緩沖液B(20m L平衡儲液,0.5g碘乙酞胺,充分混勻,避光配制);低熔點瓊脂糖封膠液(0.05g低熔點瓊脂糖,10m L電泳緩沖液,10μL溴酚藍,加熱溶解至澄清,室溫保存);敏化液(75m L乙醇。0.79g硫代硫酸鈉,10.25g無水乙酸鈉,175m L二級純水);萃取液(50%CAN、5%TFA混合液);脫色液(30mmol/L K3Fe(CN)6和100mmol/L Na2S2O3等體積混合)。
1.3 樣品的制備
取新鮮牛奶,4000 r/m in離心30m in,收集下層脫脂乳,調pH至4.6,4000 r/min離心15min。沉淀用蒸餾水洗滌2次,丙酮洗滌2~3次,每次4000 r/m in離心10m in,最后將沉淀自然風干,-20℃冰箱中保存。稱取1mg酪蛋白,加入裂解液,振蕩,充分溶解后,4℃,4000 r/m in離心1h,取上清液,用brand ford法測量蛋白樣品的相對上樣濃度,計算上樣量(蛋白樣品的上樣量為60μg)。將蛋白溶液的體積用水化液補充至250μL,振蕩混勻樣品后,以13200 r/m in、4℃離心30m in取上清液上樣。
1.4 雙向電泳
1.4.1 第一向等電聚焦 酒精擦拭IPGphor的平板電極,去除表面被氧化的部分,待酒精揮發完全備用;取出-20℃冷凍保存的IPG預制干膠條,室溫放置平衡10m in;膠條槽平行放在IPGphor的平板電極上,將樣品均勻加入膠條槽中,取室溫平衡的膠條,用鑷子輕輕的去除干膠條上的保護膜,分清膠條的正負極,將膠面向朝下放入膠條槽中,膠條吸脹15m in;加入1m L覆蓋油,防止膠條水化過程中液體的蒸發;對好正負極,蓋上蓋子。設置等電聚焦程序。S1 30V 12h;S2 500V 1h;S3 1000V 1h;S4 8000V 64000Vh;S5 2000V保持10h。
1.4.2 膠條的平衡 第一次平衡:將聚焦好的膠條用濾紙輕輕吸干膠條上的礦物油,轉移至平管加入10m L平衡緩沖液A,膠面朝上放入平衡管中。置于搖床上平衡13min。第二次平衡:倒掉平衡液A,加入平衡液B,同上平衡13min。
1.4.3 第二向SDS-PAGE電泳 將平衡好的膠條用電泳緩沖液沖洗三遍,膠面朝外貼在玻璃外板上,轉移到13.5%聚丙烯酰胺凝膠膠面上,輕壓膠條使之與膠面充分結合(盡量不要產生氣泡)。用低熔點瓊脂糖凝膠封膠液封口,放置15m in,待封膠液徹底凝固后,將凝膠轉移至電泳槽中,加入電泳緩沖液,接通電源,起始時恒流 15mA/塊膠,15m in后改為30mA/塊膠,待溴酚藍指示劑達到距底部邊緣0.5cm時即可停止電泳。將膠轉移到染色盒中固定。
1.5 銀染、圖像采集與分析
凝膠用含10%乙酸和40%乙醇的固定液固定1h以上;敏化液中敏化30m in;二級純水漂洗四次,每次10m in;用含0.25%AgNO3,0.04%甲醛(臨用前加入)的銀染液避光銀染30min;二級純水漂洗3~4次,每次0.5m in;加入含2.5%Na2CO3,0.04%甲醛(臨用前加入)的顯色液,振蕩顯色2~10m in,直至出現合適的蛋白點;在含1.46%EDTA的終止液中終止反應10m in。使用二級純水沖洗膠面,用Image Scanner掃描儀同一參數掃描并保存,然后用Image Master 2D Platinum進行圖像分析。
1.6 差異蛋白的膠內酶解
用刀片切下膠上目標膠點,依次置于已編號的EP管中,水洗膠塊2次,振蕩,吸出液體;加入新鮮的脫色液,待凝膠變成無色時立即吸出脫色液,水洗2次;先用50%乙腈脫水,再用100%乙腈脫水至膠塊完全變白,吸出液體;100mmol/L NH4HCO3吸脹5m in,吸出液體,加入新鮮的脫色液,待凝膠變成無色時立即吸出脫色液,水洗2次;每管加入2~4μL酶解工作液,待膠吸脹后,加20μL覆蓋液,37°C水浴酶解16h,5000×g離心1m in,上清液移到新的EP管中;在剩余膠塊中加入萃取液,37°C水浴30m in,超聲10min后離心,上清液轉移到對應的裝有酶解液的EP管中,混合后于真空干燥離心機中凍干。
1.7 質譜鑒定
凍干樣品用2μL樣品溶解液溶解,然后與基質工作液按1∶1體積比(0.4μL)點樣于樣品板上,結晶后進行質譜鑒定。采用ABI4800 MALDI-TOF/TOF串聯飛行時間質譜儀進行肽質量指紋圖譜(PMF)鑒定,質譜操作采用正離子反射模式,每個樣品質譜信號累計掃描600~800次,掃描范圍為800~4000u。從一級質譜的肽質量指紋圖譜中選擇信噪比(S/N)大于50的五個得分最高的前體離子做MS/MS分析,質譜信號累計掃描900~1200次,得到其序列信息,對一級質譜鑒定的蛋白質進行進一步確認。將得到

表1 差異蛋白相關信息Table 1 Information of differential proteins
2 結果與討論
2.1 乳源酪蛋白差異性的比較
在相同條件下,分別對水牛奶酪蛋白與乳牛奶酪蛋白、山羊奶酪蛋白進行雙向凝膠電泳分離,銀染后將掃描的圖像用Image Master 2D Platinum圖像分析軟件進行蛋白斑點的匹配分析。在分析報告中,以水牛奶酪蛋白的分離圖譜做為參照,選擇僅在水牛奶中存在的蛋白質斑點進行標記,共獲得21個差異蛋白點。其中,水牛奶酪蛋白和乳牛奶酪蛋白的2-DE圖譜分析顯示有14個差異蛋白點(圖1);水牛奶酪蛋白和山羊奶酪蛋白的2-DE圖譜分析顯示有10個差異蛋白點(圖2)。由圖可知,三種乳源酪蛋白在主要組分上的差異較小,主要在一些含量較少的低豐度蛋白區有顯著差異。
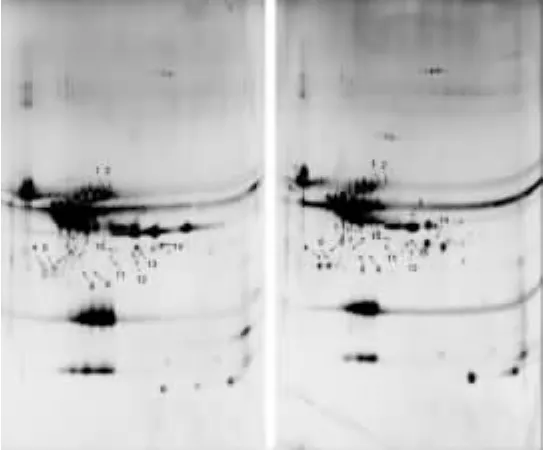
圖1 水牛奶酪蛋白和乳牛奶酪蛋白的差異蛋白分析Fig.1 Analysis of differential proteins ofwater buffalo casein and bovine casein
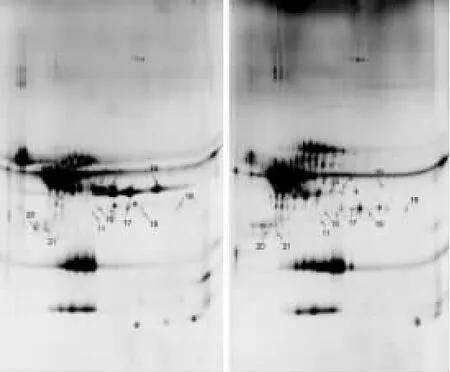
圖2 水牛奶酪蛋白和山羊奶酪蛋白的差異性蛋白分析Fig.2 Analysis of differential proteins of water buffalo casein and goat casein
2.2 酪蛋白差異蛋白質的質譜鑒定
挑選2-DE電泳圖譜中一些差異蛋白點,經過膠內酶解后進行MALDI-TOF-MS和MALDI-TOF/ TOF-MS鑒定分析。選擇一級質譜最多前5個母離子做二級質譜分析,從Mascot軟件得到MS和MS/ MS的數據,然后進行NCBInr數據庫搜索,按得分、匹配的片段數和覆蓋率等進行綜合評判搜索結果。肽段或二級片段的得分超過它的閾值(threshold)的被視為鑒定出的肽段和片段,所對應的蛋白質為鑒定的蛋白質,其可信度大于95%,如果有多個結果超過閾值,一般只取排名第一的質譜結果。
差異蛋白點斑點1的PMF圖譜見圖3。根據適當的荷質比(m/z)選擇7個峰進行串聯質譜測定(見圖4),得到氨基酸序列,將PMF數據和7個序列的數據進行混合NCBInr數據庫查詢,獲得得分,鑒定出蛋白,用同樣的方法鑒定出其他差異蛋白斑點。經質譜鑒定,得到6個差異蛋白點,見表1。結果表明,其中的4個蛋白點是水牛奶酪蛋白的主要組分,其得分分別為366,256,113和110。另外兩個可能是某種未知蛋白,因而僅搜索到與之同源性極高的組分,其得分分別為257和88,其肽指紋圖譜還有待進一步的研究。
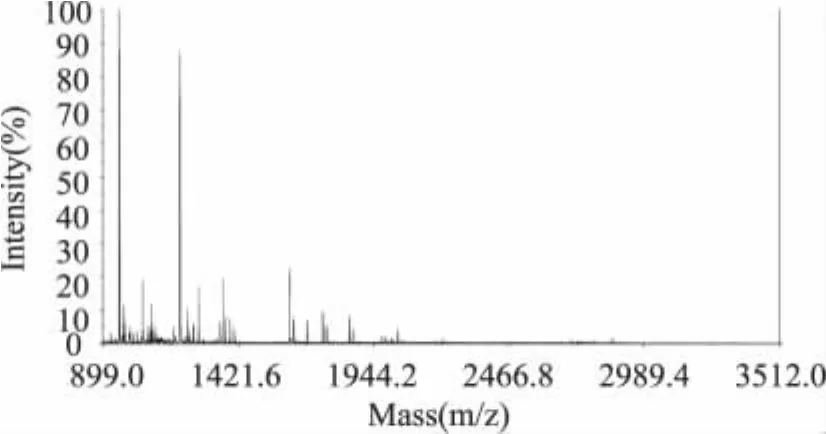
圖3 1號差異蛋白質的PMF圖Fig.3 PMFmap of differential protein 1
3 結論
現今差異蛋白質組學的主要研究方法仍以2-DE分離和MS鑒定聯合應用為主。對雙向凝膠電泳分離的蛋白質點進行微量定性鑒定是蛋白質組學研究關鍵技術之一,肽質譜指紋圖分析方法具有高靈敏度、高準確度、高等分辨率及高通量等特點,是2-DE膠上鑒定蛋白質點最廣泛使用的方法之一,是生命科學等領域一種強有力的分析測試手段,為許多實驗室的首選蛋白質譜鑒定方法。
本文利用雙向電泳和質譜聯用技術對水牛酪蛋白和其他乳源酪蛋白差異性進行了研究。水牛奶酪蛋白在雙向電泳圖譜上根據分子量和等電點的不同,可分離出αs1-、αs2-、β-和 κ-酪蛋白4種主要組分,各組分因分子量和等電點的不同,在圖譜上分布于凝膠的不同部位。利用Image Master 2D Platinum圖像分析軟件分別對水牛奶酪蛋白和乳牛奶酪蛋白、山羊奶酪蛋白的2-DE圖譜進行蛋白斑點的匹配分析,獲得21個存在于水牛奶中的差異蛋白點,這些蛋白點主要分布在低豐度蛋白區。將差異蛋白點切膠回收,經胰蛋白酶解后,用MALDI-TOF/TOF串聯飛行時間質譜儀進行質譜鑒定分析,得到4個屬于水牛奶酪蛋白的主要組分,另外發現了兩個與水牛奶中的蛋白有較高同源性的新組分,為發現水牛奶中未知蛋白提供了依據。
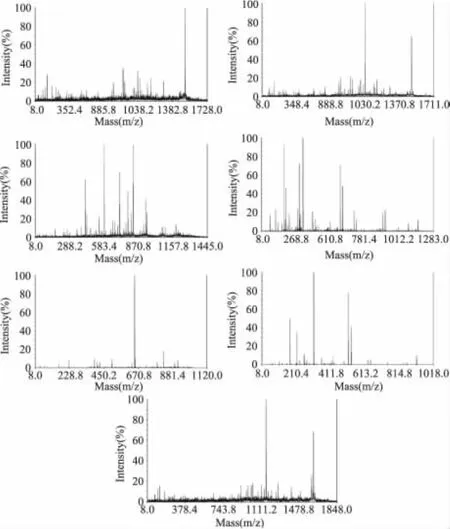
圖4 1號差異蛋白質點的MS/MS圖Fig.4 MS/MS spectra of differential protein 1
[1]孫言偉,姜穎,賀福初.差異蛋白質組學的研究進展[J].生命科學2005,17(2):137-140.
[2]張鵬,朱育強,陳新娟,等.差異蛋白質組學技術及其在園藝植物中的應用[J].中國農學通報,2011,27(4):212-218.
[3]Roncada P,Gaviraghi A,Liberatori S,et al.Identification of caseins in goatmilk[J].Proteomics,2002,2(6):723-726.
[4]Molloy M P,Herbert B R,Yan J X,et al.Identification of wallaby milk whey proteins separated by two dimensional electrophoresis,using amino acid analysis and sequence tagging[J].Electrophoresis,1997,18(7):1073-1078.
[5]Chevalier F,Hirtz C,Sommerer N,et al.Use of reducing/ nonreducing two-dimensional electrophoresis for the study of disulfide-mediated interactions between proteins in raw and HHeated bovine milk[J].Journal of Agricultural and Food Chemistry,2009,57(13):5948-5955.
[6]Holland JW,Deeth H C,Alewood P F.Proteomic analysis of κ-casein micro-heterogeneity[J].Proteomics,2004,4(3): 743-752.
[7]Galvani M,Hamdan M,Righetti P G.Two-dimensional gel electrophoresis/matrix-assisted laser desorption/ionization mass spectrometry of amilk powder[J].Rapid Communications in Mass Spectrometry,2000,14(20):1889-1897.
[8]王鴻麗,韓靜,李萍,等.雙向電泳-串聯飛行時間質譜對急性脊髓損傷大鼠差異蛋白質的分離鑒定[J].分析測試學報,2009,28(5):509-514.
[9]楊永新,王加啟,卜登攀,等.基于2-DE結合質譜研究圍產期奶牛血漿蛋白表達的變化[J].畜牧獸醫學報,2010,41 (2):188-192.
Analysis of water buffalo m ilk in south China by two-dimensional electrophoresis and mass spectrometry combined technology
XIANG M ing-xia,WANG Li-na,LIZi-chao,CHENG Xi-fei,XU M ing-fang*
(Department of Biotechnology,College of Life Science and Technology,Jinan University,Guangzhou 510632,China)
Two-d imensional elec trophoresis and matrix assisted laser desorp tion/ionization-tim e of flight mass spectrometry(MALDI-MS)comb ined technology was used to analysis the d ifferences between in water buffalo m ilk in south China and other m ilk p roteins.21 d ifferential p roteins which mainly d istributed in areas of low abundance existed only in water buffalo m ilk were identified by com paring two-d imensional electrophoresis (2-DE)map of casein spots m atching analysis w ith software of image m aster 2D p latinum.Four casein frac tions mainly could belong to water buffalo casein and two new fractions which were high homology components w ith water buffalo casein were determ ined w ith the further analysis by mass spectrometry(MS).
buffalo m ilk;casein;two-dimensionalelectrophoresis;mass spectrometry
TS252.1
A
1002-0306(2012)12-0188-04
2011-10-21 *通訊聯系人
向明霞(1988-),女,碩士研究生,研究方向:食品科學。

