宏基因組學在食品科學領域的應用研究進展
張維瀟,李 鍵,騫 宇,索化夷,*
(1.西南大學食品科學學院,重慶 400715;2.西南大學 國家食品科學與工程實驗教學中心,重慶 400715;3.西南民族大學生命科學與技術學院,四川 成都 610041;4.重慶教育學院生物與化學工程學院,重慶 400067)
宏基因組學在食品科學領域的應用研究進展
張維瀟1,2,李 鍵3,騫 宇4,索化夷1,2,*
(1.西南大學食品科學學院,重慶 400715;2.西南大學 國家食品科學與工程實驗教學中心,重慶 400715;3.西南民族大學生命科學與技術學院,四川 成都 610041;4.重慶教育學院生物與化學工程學院,重慶 400067)
宏基因組學是一種免培養,能夠直接從環境中提取全部微生物基因組DNA,通過構建宏基因組文庫并適當篩選,得到目的基因及生物活化物質的新型研究方法,它可以最大限度地挖掘微生物資源,現在愈漸成為微生物研究和開發最重要的課題之一。本文綜述了宏基因組學的研究方法及其近幾年來在食品科學領域的應用,著重介紹其在酶制劑開發、食品安全衛生、食品發酵群落、生態演化,食品營養和發現新型物質等領域的應用。同時探討宏基因組學在食品科學領域未來的應用前景。
宏基因組學;食品科學;研究進展
數10年來,自然環境中微生物的鑒定識別的唯一途徑就是用傳統的方法進行培養[1],這不但阻礙了人們認識微生物世界的視野,還限制了生物資源的開發和利用。新興的宏基因組學技術克服了相關培養技術的困難和限制,跳過傳統培養而直接從環境樣品中提取總DNA,通過構建宏基因組文庫、篩選,最后表達,來獲得新的功能基因和生物活性物質,文庫基本上囊括了所有的微生物遺傳信息。因此,宏基因組學的興起,突破了以往限制的尷尬局面,為解決微生物限制資源問題提供了解決途徑,增加了獲得更多新生物活性物質的機會[2]。
1 宏基因組學概念
1998年,科學家Handelsman等[3]首次提出宏基因組這一新的概念,可以被用于在復雜環境中確定細菌群落。而宏基因組學就是利用現代各種基因組的分子技術,在微生物學和生物技術的基礎上,針對宏基因組進行系統全面的研究,其基本策略流程為如圖1所示。
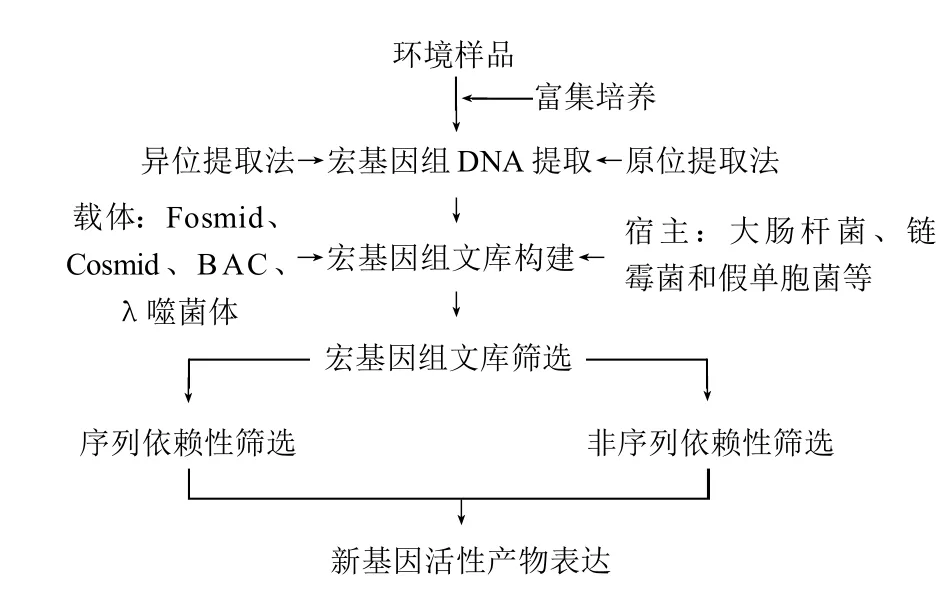
圖1 環境微生物宏基因組學研究策略[4]Fig.1 Research strategies for environmental microbial metagenomics[4]
2 宏基因組學研究策略
2.1 文庫構建
2.1.1 DNA的提取
DNA的提取與其提取質量與搜集DNA的大小、克隆效率、文庫大小和宏基因文庫的同源性緊密相關。提取方法可分為原位裂解法(直接提取法)和異位裂解法(間接提取法)。直接提取法就是將樣品懸浮于裂解緩沖液中處理,然后抽提純化。此法特點是易操作,成本低、DNA提取率高,但所提DNA片段較小(10~50kb),且腐殖酸類物質也難以徹底去除[5]。間接提取法是先采用某種物理方法將微生物細胞從原樣分離,繼而采用較溫和的方法抽提DNA,此法可獲大片段DNA(20~500kb),特點基本與原位提取法相反:所提DNA純度較高,但操作繁瑣,成本高,仍有些微生物在分離過程中可能會丟失[6]。所以,在實驗過程中采用哪一種實驗方法具體取決于實驗所需要的目的基因大小和研究目的。
2.1.2 載體的選擇
宏基因組文庫的構建選擇適宜的克隆載體,要考慮的方面有:研究目的及所提DNA的質量,期望插入目的片段大小、需要的載體拷貝數、宿主以及篩選方法等[7]。常用于DNA克隆的載體主要包括質粒、黏粒、細菌人工染色體和柯斯質粒等。小插入量文庫載體如質粒和噬菌體載體(插入量少于15kb),用于單個基因和小型操縱子的篩選,可篩選出酯酶、淀粉酶、磷酸酶、雙加氧酶、蛋白酶、木聚糖酶、氧合酶芳香烴分解酶、氧化多元醇、乙醇氧化還原酶、酰胺酶、β-內酰胺酶等。大插入量文庫載體如細菌人工染色體(高于40kb,一般100kb以上甚至達到200kb)、黏粒、柯斯質粒(均可達到40kb),更常用來重新恢復期望基因組或大型DNA片段的復雜提取途徑。細菌人工染色體廣泛用于淀粉酶、抗菌物質等大片段基因插入,后兩者都可篩選出雌二醇雙氧酶、抗博來霉素、酰基高絲氨酸等。
2.1.3 宿主的選擇
宿主菌株的選擇主要要考慮:轉化效率、載體在宿主細胞穩定性,宿主為相關基因提供必需的轉錄表達體系的能力,對異源表達基因產物的相容性,目標功能性狀及缺陷型等因素[8]。目前,構建宏基因組文庫最常用的宿主就是操作簡單、繁殖迅速、培養代謝易于控制的大腸桿菌(Escherichia coli)。E. coli不僅適用于淀粉酶、磷酸酶等常用物質,還成功表達了羥基丁酸、羰基產物和抗菌產物等[9]。其次,變鉛青鏈霉菌(Streptomyces lividans)和惡臭假單胞桿菌(Pseudomonasputida)主要用于抗生素的鑒定。另外,根癌土壤桿菌、黃單胞菌(表達天然色素)[10]、根瘤菌(酒精乙醛脫氫酶)、伯克氏菌(抗菌性基因)克隆的噬菌體宏基因組DNA正被研究用于由大腸桿菌作宿主的標準菌株,來抵抗宿主限制性內切酶和穿孔素、溶菌酶等致死因子[11]。同時還進行著對更高效適宜宿主菌株的探索。
2.2 目標基因克隆的篩選
根據研究目的基因組文庫、宏基因組文庫的篩選主要有基于功能篩選和基于序列的篩選。
功能篩選法基于生物活性基因,挖掘新的基因編碼酶和藥物,不用再進行序列分析,對全長基因及功能基因產物有選擇性。用此方法除篩選出抗菌素耐藥性基因[12]、酯酶、脂肪酶[13]、膜蛋白質[14]、幾丁質酶[15]、4-羥基丁酸的基因編碼酶[16]等常用常見物質外,還合成生物素[17],此方法用于抗生素、重金屬等有毒化合物的降解。此法限制性在于許多基因不僅在宿主菌株(如大腸桿菌)里表達不明顯,所以更新的宿主和更高的表達效率還有待開發。
序列篩選法包括完整的基因序列,通過保守的rRNA基因序列用于探索生物多樣性,或指導評估鳥槍法導出序列庫,有可能篩選到某一類結構中的新基因片段。現已篩選出聚酮合成酶和縮氨聚合酶[18],用于復雜的抗生素。另外還有1,2-苯甲酸鹽雙氧化酶、硫化氧合還原酶、烷烴羥化酶、4-氯苯甲酰基輔酶A脫鹵素酶、聚酮合成酶、亞硝酸還原酶、一氧化二氮還原酶、甲基鹵化轉移酶、氧化還原酶[19]。雖然新的高通量序列技術使相當多的微生物多樣變得可行,但組合文庫基因的能力很容易受到復雜的微生物群體的制約。所以在實驗之前必須對相關基因序列進行一定了解。
另外,化合物結構水平篩選通過比較基因篩選,其產物不一定具有生物活性;底物誘導基因表達篩選是利用底物誘導克隆子分解代謝基因,可用于活性酶的篩選等[20]。結合了穩定同位素標記法的宏基因組學能提高發現酶的基因探測頻率,顯著促進了完整基因鳥槍法序列的群體復雜性的發展。此方法中,被標記的C13基質被放到環境中。細菌可以利用有C13合成DNA,與C12區別,再被梯度離心出來。污染的水體中發現包含31kb黏粒運載的芳香環羥基雙氧酶的陽性基因[21]。此外,這個研究證明了完整基因鳥槍法宏基因組學結合穩定同位素標記法,能用于重建微生物種群的基因和生物代謝途徑。
3 宏基因組學在食品科學領域的應用
微生物在食品科學領域占有極其重要的地位,用宏基因組學的方法來研究食品中可能帶有的各種微生物,應用有生物系統多樣性的描述,新基因生物體的表征,新生化途徑或能量轉換的基本代謝的說明,地質儲集層的耐環境污染物的識別,酶的發現,二次代謝物和其他生物活性小分子的發現,高分子聚合物的發現[22]。可以發現有利于新食品技術開發的新型微生物活性物質(現階段主要目標為新型生物催化劑、新型微生物種類、基因和酶、抗生物質、產甲烷生物等的開發),或對食品質量有影響的食品新微生物,也深入了對人體營養的探究,對危害食品安全的各個途徑的分析,與從各方面降低安全風險。另外,傳統的細菌培養耗費人力物力大,將宏基因組學方法運用到食品檢測和食品研究中會帶來更多便捷。
3.1 宏基因組學在酶制劑開發的應用
宏基因組學的方法可以提取更多更新更高效的酶類。目前,多糖修飾酶也是食品工業相當重要的一類酶,如:α-1淀粉酶、α-2淀粉酶、葡萄糖淀粉酶和淀粉脫支酶,它們可用于轉化一些可利用的原材料[23]。更多的淀粉酶、水合酶、脂肪酶、蛋白酶、腈水解酶、糖苷酶和肌醇六磷酸酶等[24]已經被成功商業化。如漆酶[25]作為食品飲料、食品成分測定及食品組分功能改進中重要的作用物質,也通過宏基因組學得到了進一步的研究和發展。到目前為止,研究人員已經利用以功能和序列為基礎的方法,通過宏基因組搜尋,還鑒定了核酸酶、葡糖酸還原酶[26]、4-羥基丁酸脫氫酶、L-氨基酸氧化酶[27]、脂肽、脂蛋白、具有表面活性的脂多糖等多個這樣的新型生物催化劑。歐敏功等[28]通過實驗篩選了甲基丙二酸半醛脫氫酶(MMSDH)。Suenaga等[29]構建的Fosmid文庫用鄰苯二酚作為基質篩選出雌二醇加雙氧酶,產出91個雌二醇加雙氧酶。楊鍵等[30]成功富集宏基因組DNA中克隆到一種廣泛應用于食品行業的α淀粉酶。
研究人員已通過構建湖羊瘤胃未培養微生物的宏基因組文庫,篩選其中新的木聚糖酶基因,建立一個瘤胃來源的木聚糖酶庫,構建高效分解木聚糖的工程菌,降低木聚糖酶的生產成本,提高其應用適應性[31]。從水牛瘤胃未培養微生物宏基因組文庫[32]中克隆并鑒定出1個β-葡萄糖苷酶基因,在同步糖化共發酵工藝生產酒精中有潛在的應用價值。這些新型的酶都在食品科學領域具有極大的潛力和應用價值。
3.2 宏基因組學在食品安全衛生的應用
近年隨著人類的發展,生態系統發生了巨大的變化,并從各個方面作用于人們的生活中。如工業廢水污染河流、土壤,污染物及其代謝產物以不同形式隨作物生長經生物富集作用逐漸滲透入人體內,產生不同的食品安全和衛生問題。最新資料顯示,更多的發展和應用逐步建立在微生物生態群落這個重要的環節。
張建坤等[33]提到要應用宏基因組的新技術對酰胺類除草劑甲草胺進行生物降解。趙宇等[34]根據有機磷降解酶基因保守區設計引物,從宏基因組中擴增有機磷降解酶基因片段。宏基因組技術還被應用到對多環芳烴的降解[35],從而降低了農作物或者水體動物從環境中吸收有害因素進而危害人體的可能性。楚雍烈等[36]建立宏基因文庫篩選出利用甲醇做碳源的微生物種群,為酒工業的安全生產提供了一些啟發。目前還有研究宏基因組學方法篩選鹵醇脫鹵酶[37],催化環境中有害的有機鹵化物分解。牛澤等[38]探索出高效重金屬污染土壤混合基因組的提取純化方法。顏慶云等[39]提出用宏基因PCR-DGGE指紋來反映不同湖區的重金屬污染程度,建立DNA多態性與環境因子的關系。
Martin等[40]構建了宏基因文庫解密微生物群落的生態和代謝功能,包含加強生物磷酸鹽降解系統。宏基因通過整體群落基因擴增(WCGA)和多重取代擴增(MDA)提升了低生物量環境的宏基因可行性和效力,保證了群落微生物基因的代表性[41]。MDA已成為宏基因組學研究的重要手段,如在污水處理系統中,作為預PCR富集步驟減輕聯合提取腐植酸和胞外多糖的困難[42]。
3.3 宏基因組學在生態群落的應用
研究人員逐漸深入宏基因組學的目的之一——在于研究可用特定群落的動態關系和特殊環境各種物質的相互作用。用宏基因組學的方法獲取完整微生物群落基因,使在生態群落、食品發酵群落構建基因文庫這個計劃更易得到有效實行。
宏基因可以直接從食品生態系統經過群落PCR鎖定16S rRNA基因。PCR結果池擴增隨后由變性梯度凝膠電泳(DGGE)或溫度梯度凝膠電泳(TGGE)分離,隨后可以提取、凈化,并在特定的DNA片段序列產生生態系統指紋,可應用到已知的發酵食品生態系統中[43]。
發酵食品生態系統主要由乳酸菌、醋酸菌和一些革蘭氏陽性菌、革蘭氏陰性菌所構成。所謂的“基因探索微列陣”可以用于在12d的韓國泡菜發酵中,監控乳酸菌的群落動態和生物活性,從而使用10個相關時間的宏基因和宏轉錄[44]。直接從發酵的克非爾(俄國一種酸牛奶酒)液體和鼓舞樣品中提出26個包含16S rDNA片段的細菌宏基因,可識別不同細菌種類的存在[45]。此外,宏基因技術分析還在發酵對蝦、韓國泡菜、德國泡菜3種發酵食品的細菌和病毒群體進行研究[46]。通過實驗獲得309445個病毒宏基因序列,表現出與細菌基因序列的強烈相似性。還從發酵蔬菜食品(韓國泡菜和德國泡菜)中獲取了明顯不同于發酵對蝦的細菌群體。近期研究顯示,宏基因序列可以檢測病毒和宿主群落的組成。有趣地是,很大一部分數量的宏基因序列片段可以整合為幾千個不同集合模式的重疊群[47]。隨著對食品乳酸菌外部影響研究的深入,微生物群的宏基因文庫微列陣日后會越漸容易[48]。
黃祖新[49]還提出借助宏基因組技術分離純化大曲酒微生物分泌的功能酶,發現大曲酒發酵生產用微生物的新的功能酶類。篩選出的脂肪酶通過減少不飽和脂肪酸來達到加強茶深度發酵的目的[50]。而由超速454-焦磷酸測序宏基因組法成功分析了發酵罐中沼氣微生物群落評判其結構、基因容量、代謝能力和特定沼氣生物作用[51]。
具有潛在工業應用性的多功能糖基水解酶從奶牛瘤胃中篩選出來[52]。琥珀酸死桿菌、瘤胃球白菌等被揭示在沼氣反應中表現出強大的生物降解木質纖維素的作用[53]。近期,宏基因組學被應用在消化生態系統,發掘在瘤胃細菌的新型水解酶基因和克隆到小鼠大腸的β-葡聚糖酶[54]。一項研究[55]首次揭示人類G1段微生物組在糞便樣本中1299個基因型。高通量宏基因技術產出大量的環境基因序列,因此,復雜環境微生物群落的系統組成陸續得到解密[56]。
3.4 宏基因組學在食品營養的應用
近來還提出用宏基因組學的方法深入研究人體腸道內生態系統即在黏膜建立食物-微生物群體系的運作[57]。人類的腸道微生物群系是一個復雜的生態系統,它們包含了1013~1014數量的微生物,而這些微生物所包含的基因至少是人類基因的100倍。Gill等[58]將來自兩個健康成人的糞便的DNA擴增,率先發現腸道微生物極大豐富著各種聚糖、氨基酸和一些外來物質的代謝,還有甲烷和2-甲基-D-赤蘚糖醇4-磷酸途徑介導的維生素和異戊二烯合成等。Qin Junjie等[59]發現最小的腸道宏基因都含有相當多的功能基因片段,它們雖然很罕見,但是可能對腸道起著至關重要的作用。在研究腸道微生物對膳食纖維的分解代謝起的作用時,Tasse等[60]用多步驟功能性手段引導人體腸道宏基因的特定區域的進一步焦磷酸測序來編碼消化活性碳水化合物(包括膳食纖維素)的酶,首次用高通量功能測序篩選出26個高效降解植物多糖原料的與非富余宏基因相關的克隆子,覆蓋了35個不同源族的73種活性碳水化合物酶類。這相當于人體腸道宏基因隨機測序的5倍目的基因富集量。此發現為人類腸道功能營養鏈提供了新的研究途徑。
而人群膳食與人體腸道微生物菌群結構緊密相關。Preidis等[61]將一組由10個人體腸道菌群基因序列構成的群落引入大鼠體內,觀測到其反應表達的變化。一組對成人和斷奶兒童的結腸微生物宏基因分析顯示,膳食因素和人體各種狀態,包括先天免疫和適應性免疫、對感染的相對敏感性、免疫耐受、營養素的生物利用度、腸屏障功能可能會改變的腸道微生物群落的組成和功能。針對此狀況,可用抗生素、益生菌的合理調配來改善腸道不良狀況。腸道中的共生細菌代謝可作為能量來源的食品組分,而這些組分也能影響腸道細菌群落的組成[62]。如十字花科食物中的硫化合物[63]、多酚等植物化學物質和多不飽和脂肪酸,它們的生物利用度依賴于腸道菌群的利用,但又會對腸道聚群產生一定影響。
3.5 宏基因組學在發現新型物質的應用
近期的報道稱,宏基因組學在對新型物質的發現上起著至關重要的作用。Coetzee等[64]用此方法發現對葡萄藤有害的新型病毒上。宏基因組學還聚焦于與2,5-二酮酸-D-葡萄糖酸相關的以葡萄糖為基質的新型VC的生產研究[65]。趙越等[66]報道正在研究通過宏基因組學方法篩選具有高產核黃素能力的微生物。
4 結 語
宏基因組學克服了傳統培養方法限制微生物資源開發利用的局限性,更大程度揭示了自然群體的生物多樣性。到目前為止,宏基因組克隆技術已為研究者們篩選獲得大量新型基因和活性物質,從中還可以提取更多可以進行高產量的食品工業原料所需的生物活性物質。如上所總結的,已經有一些在食品行業被利用起來,這些成果對于食品微生物研究、食品快速檢測及食品安全系統分析等有著長遠的利用價值,還有很多將來會被應用于食品科學之中。環境中存在的各類微生物通過不同的方式進入到食品之中,相信通過宏基因組學的方法,能確定對人類有影響而還未確定的致病因子。但宏基因組學技術作為一項年輕的生物技術手段還有許多亟待解決的問題,如文庫的篩選方法有待進一步朝更敏感、更高通量方向完善;更新、更合適的載體還有待繼續搜尋和選擇;以質粒為載體的文庫受限于所能包容的插入尺寸,所以捕獲染色體上項目多基因是很不容易的。文庫表達的宿主會影響篩選結果。由于異源基因不能被宿主的轉錄機制識別,篩選時就不能表達進而不能富集。但可以試設想一個具有多重兼容的轉錄機制的平臺微生物[67]來解決這個問題。宏基因組學技術將繼續在食品科學領域開發一片嶄新、光明的天地。
[2] SIMON C, DANIEL R. Achivements and new knowledge unraveled by metagenomic approaches[J]. Applied Microbiology and Biotechnology,2009, 85(2): 265-276.
[3] HANDELSMAN J, RONDON M R, BRADY S F, et al. Molecular biological access to the chemistry of unkown soil microbes: a new frontier for natural products[J]. Chemistry & Biology, 1998, 5(10): 245-249.
[4] 黃循柳, 黃仕杰, 郭麗瓊. 宏基因組學研究進展[J]. 微生物學通報,2009, 36(7): 1058-1066.
[5] 馬莉莉, 宗浩, 宋培勇. 宏基因組學: 研究環境微生物的鑰匙[J]. 安徽農業科學, 2009, 37(20): 9377-9379.
[6] 閻冰, 洪葵, 許云. 宏基因組克隆: 微生物活性物質篩選的新途徑[J].微生物學通報, 2005, 32(1): 113-117.
[7] 宋培勇, 馬莉莉, 王慶容. 宏基因組技術及其應用研究進展[J]. 貴州農業科學, 2009, 37(10): 14-18.
[8] DESAI C, PATHAK H, MADAMWAR D. Advances in molecular andtechnologies to gauge microbial communities and bioremediation at xenobiotic/anthropogen contaminated sites[J].Bioresource Technology, 2010, 101(6): 1558-1569.
[9] SINGH B K, MACDONALD C A. Drug discovery from uncultivable microorganisms[J]. Drug Discovery Today, 2010, 15(17/18): 792-799.
[10] TAUPP M , MEWIS K, HALLAM S J. The art and design of functional metagenomic screens[J]. Current Opinion in Biotechnology, 2011, 22(3): 465-472.
[11] RAJENDHRAN J, GUNASEKARAN P. Strategies for accessing soil metagenome for desired applications[J]. Biotechnology Advances, 2008,26(6): 576-590.
[12] DIAZ-TORRES M L, MCNAB R, SPRATT D A, et al. Novel tetracycline resistance determinant from the oral metagenome[J]. Antimicrob Agents Chemother, 2003, 47(4): 1430-1432.
[13] HENNE A, SCHMITZ R A, BOMEKE M, et al. Screening of environmental DNA libraries for the presence of genes conferring lipolytic activity on Escherichia coli[J]. Applied and Environmental Microbiology,2000, 66(7): 3113-3116.
[14] MAJERNIK A, GOTTSCHALK G, DANIEL R. Screening of environmental DNA libraries for the presence of genes conferring Na+(Li+)/H+antiporter activity on Escherichia coli: characterization of therecovered genes and the corresponding gene products[J]. Journal of Bacteriology,2001, 183(22): 6645-6653.
[15] COTTRELL M T, MOORE J A, KIRCHMAN D L. Chitinases from unculturedmarine microorganisms[J]. Applied and Environmental Microbiology, 1999, 65(6): 2553-2557.
[16] HENNE A, DANIEL R, SCHMITZ R A, et al. Construction of environmental DNA libraries in Escherichia coli and screening for the presence of genes conferring utilization of 4-hydroxybutyrate[J]. Applied and Environmental Microbiology, 1999, 65(9): 3901-3907.
[17] ENTCHEVA P, LIEBL W, JOHANN A, et al. Direct cloning from enrichment cultures, a reliable strategy for isolation of complete operons and genes from microbial consortia[J]. Applied and Environmental Microbiology, 2001, 67(1): 89-99.
[18] SCHLOSS P D, HANDELSMAN J. Biotechnological prospects from metagenomics[J]. Current Opinion in Biotechnology, 2003, 14(3): 303-310.
[19] RAES J, FOERSTNER K U, BORK P. Get the most out of your metagenome: computational analysis of environmental sequence data[J].Current Opinion in Microbiology, 2007, 10(5): 490-498.
[20] 張輝, 崔煥忠. 宏基因組學及其研究進展[J]. 中國畜牧獸醫, 2007,10(5): 490-498.
[21] SUL W J, PARK J, JOHN F, et al. DNA-stable isotope probing integrated with metagenomics for retrieval of biphenyl dioxygenase genes from polychlorinated biphenyl-contaminated river sediment[J]. Applied and Environmental Microbiology, 2009, 75(17): 5501-5506.
[22] HANDELSMAN J. Metagenomics: application of genomics to uncultured microorganisms[J]. Microbiology and Molecular Biology Reviews,2004, 68(4): 669-685.
[23] 錢莉莉, 史炳照. 宏基因組學在新型生物催化劑開發中的研究進展[J]. 微生物學雜志, 2006, 26(4): 68-71.
[24] BRADY S F, CLARDY J. Long-chain N-acetyl amino acid antibiotics isolated from heterologously expressed environmental DNA[J]. Journal of the American Chemical Society, 2000, 122(51): 12903-12904.
[25] 曹治云, 鄭騰, 謝必峰, 等. 漆酶工業應用的研究進展[J]. 生物技術通報, 2004, 15(4): 414-416.
[26] 趙勇, 孫曉紅, 韓麗, 等. 微生物分子生態學技術及其在食品產業中的應用前景[J]. 上海水產大學學報, 2007, 16(4): 381-388.
[27] 強慧妮, 田寶玉, 江賢章, 等. 宏基因組學在發現新基因方面的應用[J]. 生物技術, 2009, 19(4): 82-85.
[28] 歐敏功, 崔曉龍, 李一青, 等. 宏基因組學在未培養微生物研究中的應用[J]. 微生物學雜志, 2007, 27(2): 88-91.
[29] SUENAGA H, OHNUKI T, MIYAZAKI K. Functional screening of a metagenomic library for genes involved in microbial degradation of aromatic compounds[J]. Environmental Microbiology, 2007, 9(9): 2289-2297.
[30] 楊鍵, 曾麗娟, 廖思明, 等. 富集宏基因組DNA中α-淀粉酶全長基因的克隆及重組表達[J]. 中國生物工程雜志, 2010, 30(3): 56-60.
[31] KNIETSCH A, BOWIEN S, WHITED G, et al. Identification and characterization of coenzyme B12-dependent glycerol dehydratase-and diol dehydratase-encoding genes from metagenomic DNA libraries derived from enrichment cultures[J]. Applied and Environmental Microbiology, 2003, 69(6): 3048-3060.
[32] 郭鴻, 封毅, 莫新春, 等. 水牛瘤胃宏基因組的一個新的β-葡萄糖苷酶基因umcel3G的克隆、表達及其表達產物的酶學特性[J].生物工程學報, 2008, 24(2): 232-238.
[33] 張建坤, 趙曉亞, 趙暉, 等. 酰胺類除草劑甲草胺的微生物降解研究進展[J]. 化學與生物工程, 2009, 26(6): 19-23.
[34] 趙宇, 許麗, 田健, 等. 有機磷污染土壤和活性泥中有機磷降解酶基因和微生物多樣性研究[J]. 中國農業科技導報, 2009, 11(6): 63-68.[35] 張薇, 高洪文, 張化永, 等. 宏基因組技術及其在環境保護和污染修復中的應用[J]. 生態環境, 2008, l7(4): 1696-1701.
[36] 楚雍烈, 楊娥. 宏基因組學及其技術的研究進展[J]. 西安交通大學學報: 醫學版, 2008, 29(6): 601-608.
[37] 聶洪麗, 湯麗霞. 基于宏基因組學的鹵醇脫鹵酶篩選[J]. 生物產業技術, 2009(增刊1): 158-161.
[38] 牛澤, 曾艷, 王敏, 等. 北京污灌區重金屬污染土壤DNA提取及宏基因組文庫構建[C]//中國農業生物技術學會第三屆會員代表大會暨學術交流會論文摘要集. 北京: 中國農業生物技術學會, 2006.
[39] 顏慶云, 余育和, 馮偉松, 等. 武漢東湖浮游生物宏基因組與環境重金屬的關系[J]. 中國環境科學, 2010, 30(增刊1): 52-56.
[40] MARTIN H G, IVANOVA N, KUNIN V, et al. Metagenomic analysis of two enhanced biological phosphorus removal (EBPR) sludge communities[J]. Nature Biotechnology, 2006, 24(10): 1263-1269.
[41] GALVAO T C, MOHN W W, LORENZO V D, et al. Explring the microbial biodegradation and biotransformation gene pool[J]. Trends in Biotechnology, 2005, 23(10): 497-506.
[42] GONZALEZ J M, PORTILLO M C, SAIZ-JIMENEZ C. Multiple displacement amplification as a pre-polymerase chain reaction (pre-PCR)to process difficult to amplify samples and low copy number sequences from natural environments[J]. Environmental Microbiology, 2005, 7(7):1024-1028.
[43] ROH S W, KIM K H, NAM Y D, et al. Investigation of archaeal and bacterial diversity in fermented seafood using barcoded pyrosequencing[J]. The ISME Journal, 2010, 4(1): 1-16.
[44] NAM Y D, CHANG H W, KIM K H, et al. Metatranscriptome analysis of lactic acid bacteria during kimchi fermentation with genome-probing microarrays[J]. International Journal of Food Microbiology, 2009, 130(2): 140-146.
[46] CLAESSON M J, O,SULLIVAN O, WANG Qiong, et al. Comparative analysis of pyrosequencing and a phylogenetic microarray for exploring microbial community structures in the human distal intestine[J]. PLoS One, 2009, 4(8): 66-69.
[47] PARK E J, KIM K H, ABELL G C J, et al. Metagenomic analysis of the viral communities in fermented foods[J]. Applied and Environmental Microbiology, 2011, 77(4): 1284-1291.
[48] VAUGHAN E E, HEILIG H G, BEN-AMOR K, et al. Diversity, vitality and activities of intestinal lactic acid bacteria and bifidobacteria assessed by molecular approaches[J]. FEMS Microbiology Reviews, 2005, 29(3): 477-490.
[49] 黃祖新. 宏基因組學及其在大曲酒微生物研究中的應用[J] . 釀酒科技, 2009(10): 17-21.
[50] HASAN F, SHAH A A, HAMEED A. Industrial applicationgs of microbial lipases[J]. Enayme and Microbial Technology, 2006, 39(2): 235-251.
[51] SCHLUTER A, BEKEL T, DIAZ N N, et al. The metagenome of a biogas-producing microbial community of a production-scale biogas plant fermenter analysed by the 454-pyrosequencing technology[J]. Journal of Biotechnology, 2008, 136(1/2): 77-90.
[52] PALACKAL N, LYON C S, ZAIDI S, et al. A multifunctional hybrid glycosyl hydrolase discovered in an uncultured microbial consortium from ruminant gut[J]. Applied and Micobiology Biotechnology, 2007,74(1): 113-124.
[53] LISSENS G, VERSTRAETE W, ALBRECHT T, et al. Advanced anaerobic bioconversion of lignocellulosic waste for bioregenera-tive life support following thermal water treatment and biodegradation by Fibrobacter succinogenes[J]. Biodegradation, 2004, 15(3): 173-183.
[54] FERRER M, GOLYSHINA O V, CHERNIKOVA T N, et al. Novel hydrolase diversity retrieved from a metagenome library of bovine rumen microflora[J]. Environmental Microbiology, 2005, 7(12): 1996-2010.
[55] BREITBART M, HEWSON I, FELTS B, et al. Metagenomic analyses of an uncultured viral community from human feces[J]. Journal of Bacteriology, 2003, 185(20): 6220-6223.
[56] SONG J S, JEON J H, LEE J H, et al. Molecular characterization of TEM-type β-lactamases identified in cold-seep sediments of Edison Seamount (south of Lihir Island, Papua New Guinea)[J]. Journal of Microbiol, 2005, 43(2): 172-178.
[57] MARTINS D S V, MULLER M, de VOS W M. Systems biology of the gut: the interplay of food, microbiota and host at the mucosal interface[J].Current Opinion in Biotechnology, 2010, 21(4): 539-550.
[58] GILL S R, POP M, DEBOY R T, et al. Metagenomic analysis of the human distal gut microbiome[J]. Science, 2006, 312: 1355-1359.
[59] QIN Junjie, LI Ruiqiang, RAES J, et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464:59-65.
[60] TASSE L, BERCOVICI J, PIZZUT-SERIN S, et al. Functional metagenomics to mine the human gut microbiome for dietary fiber catabolic enzymes[J]. Genome Research, 2010, 20(11): 1605-1612.
[61] PREIDIS G A, VERSALOVIC J. Targeting the human microbiome with antibiotics, probiotics, and prebiotics: gastroenterology enters the metagenomics era[J]. Gastroenterology, 2009, 136(6): 2015-2031.
[62] LAPARRA J M, SANZ Y. Interactions of gut microbiota with functional food components and nutraceuticals[J]. Pharmacological Research, 2010,61(3): 219-225.
[63] LI Fei, HULLAR M A J, SCHWARZ Y, et al. Human gut bacterial communities are altered by addition of cruciferous vegetables to a controlled fruit- and vegetable-free diet[J]. Nutrition, 2009, 139(9): 1685-1691.
[64] COETZEE B, FREEBOROUGH M J, MAREE H J, et al. Deep sequencing analysis of viruses infecting grapevines: virome of a vineyard[J]. Virology, 2010, 400(2):157-163.
[65] STREIT W R, SCHMITZ R A. Metagenomics: the key to the uncultured microbes[J]. Current Opinion in Microbiology, 2004, 7(5): 492-498.
[66] 趙越, 王暉, 鮑楠, 等. 利用宏基因組數據篩選高產核黃素的基因片段[J]. 黑龍江大學自然科學學報, 2009, 26(3): 380-384.
[67] NICOLAOU S A, GAIDA S M, PAPOUTSAKIS E T. A comparative view of metabolite and substrate stress and tolerance in microbial bioprocessing: from biofuels and chemicals, to biocatalysis and bioremediation[J]. Metabolic Engineering, 2010, 12(4): 307-331.
Research Progress and Applications of Metagenomics in Food Science
ZHANG Wei-xiao1,2,LI Jian3,QIAN Yu4,SUO Hua-yi1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. National Food Science and Engineering Experimental Teaching Center, Southwest University, Chongqing 400715, China;3. College of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, China;4. College of Biology and Chemical Engineering, Chongqing College of Education, Chongqing 400067, China)
Metagenomics is an advanced methodology by means of extracting all microbialgenomic DNAs in certain environmental habitat, constructing and screening metagenomic libraries to seek novel functional genes and biologically active compounds without cultivating. It can mine microbial resources to the greatest extent. Therefore, it is increasingly becoming one of the most important subjects in microbiological research and development. This paper reviews the recent research progress of metagenomics and its applications in the area of food science, especially in enzyme preparation development, food safety and hygiene, food fermentation, ecological evolution, food nutrition, and the discovery of new compounds, and explores its future prospects in the area of food science.
metagenomics;food science;research progress
TS201.3
A
1002-6630(2012)05-0309-06
2011-09-20
國家公益性行業(農業)科研專項資金資助項目(201203009);西南大學中央高校基本科研業務費專項資金資助項目(XDJK2009C041)
張維瀟(1989—),女,本科生,研究方向為食品質量與安全。E-mail:zwxlaugh@163.com
索化夷(1978—),男,講師,博士研究生,研究方向為食品科學。E-mail:birget@swu.edu.cn

