人受體活性修飾蛋白1基因修飾的骨髓間充質(zhì)干細(xì)胞移植對兔血管成形術(shù)后新生內(nèi)膜的影響*
龍仙萍, 趙然尊, 石 蓓, 許官學(xué)
(遵義醫(yī)學(xué)院第一附屬醫(yī)院心血管內(nèi)科,貴州 遵義 563003)
1000-4718(2012)04-0675-08
2011-11-26
2012-02-21
國家自然科學(xué)基金資助項目(No. 30860100);貴州省國際合作項目(No. 黔科合外G字[2010] 0732)
△通訊作者 Tel:0852-8608406 ;E-mail: shibei2147@163.com
人受體活性修飾蛋白1基因修飾的骨髓間充質(zhì)干細(xì)胞移植對兔血管成形術(shù)后新生內(nèi)膜的影響*
龍仙萍, 趙然尊, 石 蓓△, 許官學(xué)
(遵義醫(yī)學(xué)院第一附屬醫(yī)院心血管內(nèi)科,貴州 遵義 563003)
目的探討人受體活性修飾蛋白1(hRAMP1)基因修飾的骨髓間充質(zhì)干細(xì)胞(MSCs)移植對動脈粥樣硬化模型兔頸動脈球囊成形術(shù)后新生內(nèi)膜增殖的影響。方法密度梯度離心法加貼壁培養(yǎng)法獲得MSCs,并以攜帶hRAMP1的腺病毒轉(zhuǎn)染MSCs獲得hRAMP1基因修飾的MSCs(hRAMP1-MSCs)。建立動脈粥樣硬化狹窄并球囊損傷血管成形術(shù)的兔模型,隨機分為hRAMP1-MSCs組、MSCs組和對照組,模型建立成功后經(jīng)耳緣靜脈分別注射攜帶pAd2-EGFP-hRAMP1或pAd2-EGFP的MSCs和PBS,于細(xì)胞移植后7 d、14 d和28 d分別處死動物取材, 觀察MSCs歸巢、血管內(nèi)皮化程度及內(nèi)膜增生程度,同時檢測血清血管內(nèi)皮生長因子(VEGF)水平和血管局部內(nèi)皮型一氧化氮合成酶(eNOS)表達(dá)。結(jié)果細(xì)胞移植后不同時點hRAMP1-MSCs組和MSCs組損傷血管增生內(nèi)膜均有CD31和增強型綠色熒光蛋白(EGFP)分布,但以 hRAMP1-MSCs組內(nèi)皮化程度明顯,MSCs組次之,兩者與對照組比較均有顯著差異(P<0.05);細(xì)胞移植后不同時點hRAMP1-MSCs組和MSCs組內(nèi)膜增生面積及再狹窄率均低于對照組(P<0.05),尤以hRAMP1-MSCs組降低明顯;細(xì)胞移植后不同時點hRAMP1-MSCs組和MSCs組血清VEGF水平和血管eNOS表達(dá)較對照組增加(P<0.05),而 hRAMP1-MSCs組又明顯高于MSCs組(P<0.05);損傷血管新生內(nèi)膜增殖細(xì)胞核抗原(PCNA)陽性表達(dá)在hRAMP1-MSCs組最少,對照組最多。結(jié)論hRAMP1基因修飾的MSCs能更有效促進(jìn)損傷內(nèi)膜快速內(nèi)皮化,重組hRAMP1腺病毒載體不影響MSCs向內(nèi)皮細(xì)胞分化潛能。基因聯(lián)合干細(xì)胞治療能更好地促進(jìn)損傷動脈快速內(nèi)皮化,降低血管成形術(shù)后再狹窄。
受體活性修飾蛋白1; 間充質(zhì)干細(xì)胞; 新生內(nèi)膜; 再內(nèi)皮化; 血管成形術(shù)
骨髓間充質(zhì)干細(xì)胞(mesenchymal stem cells, MSCs)因其具有多項分化潛能,因此在動脈粥樣硬化和心肌梗死的基礎(chǔ)領(lǐng)域得以廣泛研究。MSCs治療心肌梗死作用在動物實驗和小規(guī)模臨床研究中得到證實,但較少研究關(guān)注MSCs對引起心肌梗死的罪犯血管及其它粥樣硬化動脈的影響。我們先前的研究也顯示,MSCs移植治療可在一定程度上促進(jìn)損傷頸動脈的快速再內(nèi)皮化,一定程度上降低新生內(nèi)膜增生[1]。然而MSCs具有分化為血管平滑肌細(xì)胞(vascular smooth muscle cells,VSMCs)潛能,可能成為血管損傷后局部VSMCs增殖的的來源,加重血管成形術(shù)后再狹窄。基因修飾MSCs可能有利于解決這一問題。降鈣素基因相關(guān)肽(calcitonin gene-related peptide,CGRP)是目前已知最強的血管活性肽,對心血管系統(tǒng)具有保護(hù)作用。研究發(fā)現(xiàn)CGRP可通過cAMP-PKA途徑激活一氧化氮合酶促進(jìn)內(nèi)皮細(xì)胞增生[2-3], CGRP與受體結(jié)合抑制體外培養(yǎng)的VSMCs增殖[4]。受體活性修飾蛋白1(receptor activity-modifying protein 1,RAMP1)是調(diào)節(jié)CGRP受體活性的關(guān)鍵亞單位,外源RAMP1基因可增加內(nèi)源性CGRP活性。因此本研究擬通過腺病毒載體介導(dǎo)人RAMP1(humanRAMP1,hRAMP1)轉(zhuǎn)染MSCs后移植動脈粥樣硬化模型兔頸動脈球囊成形術(shù)模型,觀察高表達(dá)hRAMP1的MSCs移植對血管成形術(shù)后 內(nèi)皮化和新生內(nèi)膜的影響,以期為防治血管成形術(shù)后再狹窄提供實驗依據(jù)。
材 料 和 方 法
1材料
1.1動物與分組 54只新西蘭大白兔,雌雄不限,體重(2.0±0.2) kg,兔齡 4~5月,購自第三軍醫(yī)大學(xué)實驗動物中心。實驗分為hRAMP1轉(zhuǎn)染MSCs移植組(hRAMP1-MSCs,n=18)、空病毒轉(zhuǎn)染MSCs移植組(MSCs組,n=18)和PBS移植對照組(C組,n=18)組,3組動物均構(gòu)建動脈粥樣硬化狹窄模型并接受球囊成形術(shù)。
1.2試劑與儀器 含有hRAMP1基因或增強型綠色熒光蛋白基因的腺病毒載體(pAd2-EGFP-hRAMP1和pAd2-EGFP)由本室構(gòu)建,經(jīng)PCR、Western blotting和測序鑒定成功。胰酶、低糖DMEM及高糖DMEM (Gibco),胎牛血清(HyClone),二甲基亞砜(北京拜爾迪生物公司), Percoll液和噻唑藍(lán)(MTT)(Promega),小鼠抗兔CD31單克隆抗體、山羊抗小鼠IgG-TRITC(紅光)、羊抗綠色熒光蛋白 (green fluorescence protein,GFP)多克隆抗體和驢抗山羊IgG-FITC(綠光)購于Abcam;鼠抗兔內(nèi)皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)多克隆抗體、驢抗小鼠IgG購自Santa Cruz;增殖細(xì)胞核抗原(proliferating cell nuclear antigen,PCNA) 單克隆抗體和小鼠SABC免疫組化試劑盒購自武漢博士德公司;鼠抗兔CD29、CD45和CD90抗體購自US Biological。血管內(nèi)皮生長因子(vascular endothelial growth factor,VEGF) ELISA試劑盒購于上海西塘生物公司。裂解液和其它試劑采用國產(chǎn)或進(jìn)口分析純試劑。2F PTCA 球囊導(dǎo)管為Cordis產(chǎn)品。圖像處理系統(tǒng)為Leica Qwin Plus產(chǎn)品,F(xiàn)ACS Calibur流式細(xì)胞儀為BD產(chǎn)品。
2方法
2.1MSCs分離、培養(yǎng)和鑒定 取同批次兔通過密度梯度離心并貼壁培養(yǎng)法獲得MSCs用于細(xì)胞移植。簡述如下:以苯巴比妥鈉(30 mg/kg)麻醉動物,無菌操作抽取股骨骨髓,1 000 r/min離心10 min,棄上清,無血清DMEM重懸細(xì)胞,加入1.073 kg/L的Percoll液2 000 r/min離心20 min,吸取液面交界處細(xì)胞懸液,加入無血清DMEM混勻后1 000 r/min離心5 min,棄上清,加入含10%FBS、1×105U/L青霉素和8×104U/L鏈霉素的DMEM,于37 ℃、5%CO2培養(yǎng)箱中孵育。每2~3 d更換培養(yǎng)液,MSCs增殖達(dá)80%融合時細(xì)胞傳代,取第3~5代細(xì)胞用于病毒轉(zhuǎn)染和細(xì)胞移植。同時流式細(xì)胞儀檢測細(xì)胞表面抗原CD29、CD45和CD90的表達(dá)。
2.2重組腺病毒載體轉(zhuǎn)染MSCs MSCs融合到80%時棄培養(yǎng)基,PBS洗2次,培養(yǎng)瓶中各加入1 mL無血清DMEM,以pAd2-EGFP-hRAMP1或pAd2-EGFP病毒液按最佳感染復(fù)數(shù)(multiplicity of infection,MOI)為800進(jìn)行細(xì)胞轉(zhuǎn)染,37 ℃、5 %CO2孵箱孵育4 h,最初2 h每隔15 min搖動培養(yǎng)板1次,4 h吸出DMEM液,PBS沖洗培養(yǎng)瓶2次后加入含10%胎牛血清DMEM繼續(xù)培養(yǎng),72 h后行細(xì)胞移植。
2.3建立動脈粥樣硬化并球囊損傷血管兔模型及細(xì)胞移植 按課題組已成功構(gòu)建的方法和標(biāo)準(zhǔn)[5]建立兔動脈粥樣硬化模型;然后在無菌操作下行右側(cè)頸動脈球囊成形術(shù),用3%戊巴比妥鈉(30 mg/kg)耳緣靜脈麻醉動物,脫毛備皮消毒皮膚,取頸部正中切口,游離充分暴露頸總和頸內(nèi)、外動脈,肝素鈉100 U/kg充分抗凝,在距離頸總動脈分叉處約0.4 cm處結(jié)扎頸外動脈,血管夾阻斷近心端和遠(yuǎn)心端頸總動脈,于頸外動脈近心側(cè)進(jìn)行穿刺,送入直徑2.0F 球囊至頸總動脈,6個大氣壓充盈球囊后緩慢拖動持續(xù)1 min,間歇1 min后重復(fù),總共3次以剝脫內(nèi)膜,球囊損傷后,結(jié)扎頸外動脈近心端,去除血管夾,恢復(fù)血流,慶大霉素局部沖洗,逐層縫合頸部切口,大腿內(nèi)側(cè)注射青霉素8×105U/kg連續(xù)3 d預(yù)防感染;球囊損傷后24 h經(jīng)耳緣靜脈注射pAd2-EGFP-hRAMP1-MSCs及pAd2- EGFP-MSCs細(xì)胞懸液0.5 mL(計數(shù)約3×107),對照組移植等量PBS液作為對照。
2.4損傷處MSCs歸巢及MSCs功能鑒定 分別于不同時點處死動物,部分血管取冰凍組織,經(jīng)OCT包埋后連續(xù)切成6 μm超薄切片,進(jìn)行免疫熒光雙標(biāo)記檢測。將Ⅰ抗抗體即羊抗GFP多克隆抗體和大鼠 抗兔CD31 單克隆抗體混合后滴加(兩種抗體終濃度為1∶100)玻片上,再將Ⅱ抗抗體FITC標(biāo)記驢抗山羊IgG和TRITC標(biāo)記的山羊抗鼠IgG(兩種抗體終濃度為1∶200)混合后滴加于玻片,于熒光顯微鏡下分別用綠光和藍(lán)光激發(fā)后觀察結(jié)果并拍照。陰性對照組用PBS 代替Ⅰ抗, 其余步驟與以上相同。GFP陽性細(xì)胞為歸巢的腺病毒轉(zhuǎn)染的MSCs:陽性指數(shù)=熒光吸光度值×陽性面積/總面積,以3個不同橫截斷面的平均數(shù)來表示該組織的免疫熒光定量的最后數(shù)值;GFP及CD31雙陽性的細(xì)胞定義為來源于MSCs的內(nèi)皮細(xì)胞:計算陽性細(xì)胞核占同類總細(xì)胞核的百分比,以3個不同橫截斷面的平均值表示該組織的陽性率。
2.5Western blotting檢測eNOS蛋白表達(dá) 在不同組中取相同長度和重量均勻的血管組織加裂解液,略碾磨勻漿,離心取上清,參照BCA蛋白定量試劑盒使用說明操作測定蛋白濃度,以50 μL上樣, 10%SDS聚丙酰胺凝膠電泳后將蛋白轉(zhuǎn)移至硝酸纖維素膜上,用TBST配制5%脫脂奶粉,將膜封閉1 h后,將膜與eNOS多克隆抗體一起孵育,4℃過夜,再與Ⅱ抗共同孵育2~3 h,顯色,曝光,實驗重復(fù)3次。以β-actin作為內(nèi)參照,利用伯樂凝膠成像系統(tǒng)分析各Western blotting條帶吸光度值,再計算各條帶與內(nèi)參照β-actin條帶的吸光度比值做蛋白含量半定量分析。
2.6免疫組織化學(xué)檢測α-SMA、CD31和PCNA表達(dá)及組織形態(tài)學(xué)分析 10%甲醇固定組織,石蠟包埋切片,脫蠟至水,蒸餾水沖洗,PBS沖洗3次,行抗原熱修復(fù)15 min,隨后冷卻20 min,3%H2O2室溫孵育10 min,以消除內(nèi)源性過氧化物酶的活性,PBS沖洗3次,滴加正常山羊封閉血清,室溫孵育30 min,傾去,勿洗,滴加小鼠抗兔CD31和PCNA (1∶100倍稀釋),陰性對照滴加PBS緩沖液,4℃孵育過夜,PBS沖洗 3次后滴加抗小鼠Ⅱ抗37 ℃孵育30 min,PBS沖洗,再加SABC后37 ℃孵育20~30 min,PBS沖洗, 加DAB室溫顯色,蘇木素復(fù)染,脫水透明,封片。光學(xué)顯微鏡下觀察各組血管內(nèi)膜CD31和PCNA表達(dá)情況并拍照。內(nèi)皮化程度通過測定增生內(nèi)膜CD31陽性表達(dá)的積分吸光度值(IA)表示,以3個不同橫截斷面的平均值統(tǒng)計。石蠟切片經(jīng)梯度乙醇脫水,進(jìn)行HE染色。利用光學(xué)顯微鏡及Leica Qwin Plus圖像分析系統(tǒng)分析各組損傷血管再 內(nèi)皮化情況。
2.7血清VEGF的檢測 術(shù)前和細(xì)胞移植后7 d、14 d、28 d時采集外周血用ELISA法檢測VEGF的水平。嚴(yán)格參照試劑說明書進(jìn)行實驗。
3統(tǒng)計學(xué)處理

結(jié) 果
1動物情況
實驗期間3組實驗動物組均無死亡,無手術(shù)切口感染或不愈合等情況;所有實驗動物管腔均無血栓及閉塞。
2MSCs的分離、鑒定及轉(zhuǎn)染
MSCs貼壁培養(yǎng)24 h開始貼壁,早期呈多角形或長梭形,傳代后細(xì)胞逐漸呈均一的長梭樣,呈現(xiàn)成纖維細(xì)胞樣外觀,見圖1A、B;P3細(xì)胞用于實驗。流式細(xì)胞術(shù)檢測培養(yǎng)細(xì)胞顯示CD29陽性率95.79%,CD45陽性率12.49%,CD90陽性率98.59%,見圖2;經(jīng)EGFP標(biāo)記的重組腺病毒熒光顯微鏡下發(fā)出綠色熒光, pAd2-EGFP-RAMP1和pAd2-EGFP轉(zhuǎn)染的MSCs,72 h后熒光顯微鏡下可見80%以上細(xì)胞可見綠色熒光,見圖1C、D,說明重組腺病毒轉(zhuǎn)染細(xì)胞成功。光鏡觀察細(xì)胞生長狀態(tài)良好,無形態(tài)改變。
3損傷血管再內(nèi)皮化程度測定
CD31是內(nèi)皮細(xì)胞特征性標(biāo)記抗原,檢測血管損傷處CD31表達(dá)可間接反映血管內(nèi)皮化程度。細(xì)胞移植后7 d、14 d和28 d新生血管內(nèi)膜附近有EGFP陽性細(xì)胞分布,EGFP陽性表達(dá)同時CD31陽性表達(dá),尤以hRAMP1-MSCs組明顯,MSCs組次之,而對照組血管則無EGFP和CD31陽性表達(dá),見圖3、4。血管增生內(nèi)膜EGFP表達(dá)同時有CD31陽性,表明重組腺病毒轉(zhuǎn)染至MSCs成功,且MSCs歸巢至損傷血管并分化為血管內(nèi)皮細(xì)胞,促進(jìn)損傷動脈快速內(nèi)皮化。提示外源RAMP1能調(diào)節(jié)局部環(huán)境促進(jìn)MSCs向內(nèi)皮細(xì)胞分化或者外源RAMP1能調(diào)節(jié)CGRP促進(jìn)損傷內(nèi)皮快速內(nèi)皮化作用。

Figure 1. Culture and transfection of mesenchymal stem cells (MSCs)(×100). A:primary cells cultured for 7 d;B:passaged cells(passage 3); C:MSCs transfected with pAd2-EGFP-RAMP1 for 72 h; D:MSCs transfected with pAd2-EGFP for 72 h.
圖1細(xì)胞培養(yǎng)及轉(zhuǎn)染圖片

Figure 2. Passage 3 of MSCs were analyzed by flow cytometry.The results showed that most of the cells expressed CD29 and CD90, while very few cells expressed CD45.
圖2P3MSCs表達(dá)CD29和CD90,極少量細(xì)胞表達(dá)CD45

Figure 3. The expression of CD31 and EGFP in the injuried blood vessel 28 d after MSCs transplantation(×400).
圖3細(xì)胞移植后28d損傷血管CD31和EGFP的表達(dá)
4組織形態(tài)學(xué)結(jié)果分析
血管成形術(shù)并細(xì)胞移植后7~28 d取材,各組均可見新生內(nèi)膜增生;細(xì)胞移植后7 d、14 d和28 d,hRAMP1-MSCs組和MSCs組的內(nèi)膜增生面積和內(nèi)膜增殖率均低于對照組(P<0.05),hRAMP1-MSCs組又低于MSCs組(P<0.05),血管正常頸動脈內(nèi)彈力板完整,內(nèi)膜為單層柱狀上皮,見圖5、6。
5血管損傷局部eNOS測定
應(yīng)用Western blotting檢測細(xì)胞移植后28 d eNOS蛋白表達(dá),結(jié)果顯示:hRAMP1-MSCs組和MSCs組eNOS蛋白表達(dá)較對照組明顯增多(P<0.05),尤以hRAMP1-MSCs組明顯(P<0.05),見圖7A、B。
6免疫組織化學(xué)分析
免疫組織化學(xué)方法檢測顯示:血管增生內(nèi)膜見內(nèi)皮細(xì)胞特征性標(biāo)記物CD31表達(dá),且沿著管腔內(nèi)膜分布,見圖8,內(nèi)皮化程度分析顯示細(xì)胞移植后7 d、14 d和28 d, hRAMP1-MSCs和MSCs組內(nèi)皮化程度均優(yōu)于對照組(P<0.05),尤以hRAMP1-MSCs組明顯(P<0.05),見圖9。PCNA 是一種參與增殖的核蛋白,反映細(xì)胞增殖狀態(tài)的指標(biāo),PCNA表達(dá)減少意味著細(xì)胞增殖活性下降,細(xì)胞移植后7 d 、14 d和28 d,損傷血管免疫組織化學(xué)方法檢測顯示: hRAMP1-MSCs和MSCs組增生內(nèi)膜細(xì)胞PCNA表達(dá)陽性率均低于對照組,見圖8。由此可見促進(jìn)損傷血管快速內(nèi)皮化可抑制細(xì)胞增殖活性。


圖4細(xì)胞移植后7d、14d和28d,MSCs歸巢及CD31陽性表達(dá)率

Figure 5. Neointima thickeness of the injuried blood vessel 14 d and 28 d after MSCs transplantation (×400).A:control group; B:MSCs group; C:hRAMP1-MSCs group.
圖5細(xì)胞移植后14d和28d損傷血管內(nèi)膜增殖


圖6細(xì)胞移植后14d和28d損傷血管內(nèi)膜增殖情況


圖7細(xì)胞移植后28d損傷血管eNOS蛋白的表達(dá)
7血清VEGF水平的檢測
細(xì)胞移植后7 d、14 d和28 d,hRAMP1-MSCs組和MSCs組血清VEGF水平均顯著高于對照組,尤以hRAMP1-MSCs 組更為顯著(P<0.05),見表1。
討 論
目前,經(jīng)皮冠狀動脈介入治療(percutaneous interventional therapy, PCI) 是治療心肌梗死的主要手段。但是,PCI術(shù)后再狹窄卻成為阻礙其遠(yuǎn)期療效的關(guān)鍵。基礎(chǔ)研究認(rèn)為,再狹窄主要與PCI手術(shù)過程中對病變血管的機械損傷,導(dǎo)致?lián)p傷動脈內(nèi)皮修復(fù)減弱或者內(nèi)皮功能喪失,因而引起中膜平滑肌細(xì)胞向內(nèi)膜下遷移和增殖并形成新生內(nèi)膜有關(guān)。所以行PCI同時促進(jìn)損傷血管早期快速再內(nèi)皮化是防止再狹窄的關(guān)鍵。本課題組先前的研究[6]及其它研究[7]均顯示,單純的MSCs移植可以通過自身分化為內(nèi)皮細(xì)胞或旁分泌機制促進(jìn)損傷動脈的內(nèi)皮化修復(fù),改善內(nèi)皮功能,降低再狹窄的風(fēng)險,但作用有限。近年來許多研究顯示通過基因修飾MSCs可以增強MSCs的功能,這些基因包括血管生成素[8]、血管內(nèi)皮生長因子[9]、CCX4[10]、前列腺素Ⅰ合酶[11]等,總體結(jié)果顯示其可以增強MSCs的生存能力、遷移能力,顯著改善心肌梗死后心肌重構(gòu)和心功能。但這些研究鮮有關(guān)注基因修飾的MSCs對心肌梗死罪犯血管和粥樣硬化動脈的內(nèi)皮修復(fù)和內(nèi)皮功能的影響。

Figure 8. The expression of PCNA and CD31 in the injuried blood vessel 28 d after MSCs transplantation (×200).
圖8細(xì)胞移植后28d損傷血管PCNA和CD31的表達(dá)


圖9細(xì)胞移植后7d、14d和28d損傷血管內(nèi)膜的內(nèi)皮化程度
表1細(xì)胞移植后不同時點各組血清VEGF水平
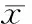

Group7d14d28dControl258.78±23.54292.43±53.04278.20±28.61MSCs569.86±53.20#448.45±28.61#323.51±33.76#hRAMP1-MSCs770.50±42.86#★547.07±49.53#★497.09±73.33#★
#P<0.05vscontrol group;★P<0.05vsMSCs group.
RAMP1是CGRP的受體活性亞單位之一,決定著該受體活性水平。CGRP通過RAMP1激活受體后,發(fā)揮血管舒張和調(diào)節(jié)內(nèi)皮功能的作用。Mishima等[12]研究顯示:增加CGRP效應(yīng)性能促進(jìn)大鼠缺血后肢體CD31和VEGF表達(dá),改善缺血后肢血流灌注。Toda等[13]研究也顯示:CGRP能調(diào)節(jié)VEGF生成,血管生成增加,促進(jìn)腫瘤在動物體內(nèi)快速生長。研究顯示外源RAMP1轉(zhuǎn)染增加CGRP效應(yīng)性。因此本研究觀察hRAMP1基因修飾的MSCs移植是否促進(jìn)粥樣硬化頸動脈球囊擴張術(shù)后內(nèi)皮修復(fù),以及其對內(nèi)膜增殖的影響。結(jié)果發(fā)現(xiàn),在頸動脈粥樣硬化狹窄并球囊成形術(shù)的兔模型中,與單純MSCs相比,hRAMP1基因修飾的MSCs移植治療可以顯著增加損傷頸動脈的CD31表達(dá),這表明hRAMP1基因修飾的MSCs較單純MSCs能進(jìn)一步促進(jìn)損傷動脈的再內(nèi) 皮化修復(fù);同時,血管形態(tài)學(xué)分析亦顯示hRAMP1-MSCs移植后新生內(nèi)膜形成顯著降低,這對于降低血管成形術(shù)后再狹窄發(fā)生是至關(guān)重要的。進(jìn)一步的組織免疫熒光檢測發(fā)現(xiàn),細(xì)胞移植后hRAMP1-MSCs組和MSCs組損傷動脈內(nèi)膜中均有EGFP表達(dá),但hRAMP1-MSCs組血管內(nèi)皮細(xì)胞標(biāo)志蛋白CD31表達(dá)率較MSCs組明顯。這提示hRAMP1基因修飾的MSCs同樣能遷移至損傷的血管內(nèi)膜部位并更能促進(jìn)損傷血管內(nèi)皮的修復(fù)。最近的Chrissobolis等[14]研究結(jié)果顯示,高表達(dá)RAMP1能增加CGRP誘導(dǎo)的腦血管舒張,對抗血管緊張素Ⅱ誘導(dǎo)的內(nèi)皮功能失調(diào),這提示hRAMP1本身的激活可能對內(nèi)皮功能有益。因此,hRAMP1基因修飾的MSCs移植中,MSCs和hRAMP1兩者均對損傷動脈內(nèi)皮修復(fù)和/或內(nèi)皮功能有益,不排除MSCs及RAMP1的直接或間接協(xié)同作用。
損傷動脈早期內(nèi)皮化和恢復(fù)內(nèi)皮功能對于抑制新生內(nèi)膜形成具有重要的意義。動脈球囊成形術(shù)導(dǎo)致內(nèi)皮剝脫,并使局部內(nèi)皮功能喪失;早期快速內(nèi)皮化和內(nèi)皮功能恢復(fù),可以阻斷或抑制血管中膜平滑肌細(xì)胞的激活,使平滑肌細(xì)胞增殖和遷移水平降低,進(jìn)而抑制新生內(nèi)膜形成。本實驗結(jié)果顯示,MSCs組和hRAMP1-MSCs組的內(nèi)皮型一氧化氮合成酶表達(dá)較對照組顯著增加,提示移植細(xì)胞在促進(jìn)損傷動脈修復(fù)過程中伴隨內(nèi)皮功能的恢復(fù)。同時,血漿VEGF水平增加,這可能與動脈損傷后血管內(nèi)皮功能激活、移植MSCs旁分泌作用等有關(guān),但VEGF水平增加可以有利于內(nèi)皮細(xì)胞增殖和再生,進(jìn)而促進(jìn)損傷動脈內(nèi)皮化。此外,本研究還觀察到在hRAMP1-MSCs組中,血管新生內(nèi)膜厚度顯著降低,且伴隨著CD31高表達(dá)以及代表細(xì)胞增殖水平的PCNA陽性率亦顯著降低,這可能是移植hRAMP1-MSCs通過促進(jìn)損傷動脈的快速內(nèi)皮化和內(nèi)皮功能恢復(fù),顯著抑制了與動脈損傷相關(guān)的VSMCs增殖的結(jié)果,最終導(dǎo)致新生內(nèi)膜生成減少。
總之,本研究在頸動脈粥樣硬化狹窄并球囊血管成形術(shù)后,移植hRAMP1基因修飾的MSCs通過促進(jìn)損傷動脈內(nèi)皮化,進(jìn)而抑制新生內(nèi)膜形成,這對臨床再狹窄的防治提供有益的借鑒和指導(dǎo)作用。
[1] 郭 艷, 石 蓓, 王正龍, 等. 外周血間充質(zhì)干細(xì)胞移植對球囊損傷兔血管平滑肌細(xì)胞凋亡的影響[J]. 中國生物醫(yī)學(xué)工程學(xué)報,2010,29(2): 288-294.
[2] Brain SD, Grant AD. Vascular actions of calcitonin gene-related peptide and adrenomedullin[J]. Physiol Rev,2004,84(3): 903-934.
[3] Haegerstrand A, Dalsgaard CJ, Jonzon B, et al. Calcitonin gene-related peptide stimulates proliferation of human endothelial cells[J]. Proc Natl Acad Sci U S A,1990,87(9): 3299-3303.
[4] Zhang Z, Dickerson IM, Russo AF. Calcitonin gene-related peptide receptor activation by receptor activity-modifying protein-1 gene transfer to vascular smooth muscle cells[J]. Endocrinology,2006,147(4): 1932-1940.
[5] 沈長銀, 石 蓓, 趙然尊, 等. 兔頸動脈粥樣硬化狹窄動物模型的制備[J]. 四川大學(xué)學(xué)報(醫(yī)學(xué)版),2009,40(5): 923-926.
[6] 許官學(xué), 趙然尊, 石 蓓, 等. 間充質(zhì)干細(xì)胞移植對兔頸動脈損傷后的內(nèi)皮修復(fù)作用研究[J]. 重慶醫(yī)科大學(xué)學(xué)報,2010,35(4): 530-534.
[7] Forte A, Finicelli M, Mattia M, et al. Mesenchymal stem cells effectively reduce surgically induced stenosis in rat carotids[J]. J Cell Physiol,2008,217(3):789-799.
[8] Ryu JK, Cho CH, Shin HY, et al. Combined angiopoietin-1 and vascular endothelial growth factor gene transfer restores cavernous angiogenesis and erectile function in a rat model of hypercholesterolemia[J]. Mol Ther,2006,13(4): 705-715.
[9] Samuel SM, Akita Y, Paul D, et al. Coadministration of adenoviral vascular endothelial growth factor and angiopoietin-1 enhances vascularization and reduces ventricular remodeling in the infarcted myocardium of type 1 diabetic rats[J]. Diabetes,2010,59(1): 51-60.
[10]Cheng Z, Ou L, Zhou X, et al. Targeted migration of mesenchymal stem cells modified with CXCR4 gene to infarcted myocardium improves cardiac performance[J]. Mol Ther,2008,16(3): 571-579.
[11]Lian WS, Cheng WT, Cheng CC, et al.Invivotherapy of myocardial infarction with mesenchymal stem cells modified with prostaglandin I synthase gene improves cardiac performance in mice[J]. Life Sci, 2011, 88(9-10):455-464.
[12]Mishima T, Ito Y, Hosono K, et al. Calcitonin gene-related peptide facilitates revascularization during hindlimb ischemia in mice[J]. Am J Physiol Heart Circ Physiol,2011,300(2):H431-H439.
[13]Toda M, Suzuki T, Hosono K, et al. Neuronal system-dependent facilitation of tumor angiogenesis and tumor growth by calcitonin gene-related peptide[J]. Proc Natl Acad Sci U S A,2008,105(36): 13550-13555.
[14]Chrissobolis S, Zhang Z, Kinzenbaw DA, et al. Receptor activity-modifying protein-1 augments cerebrovascular responses to calcitonin gene-related peptide and inhibits angiotensin II-induced vascular dysfunction[J]. Stroke,2010,41(10): 2329-2334.
EffectoftransplantationofhRAMP1gene-modifiedbonemarrowMSCsonpostangioplastyneointimaformationinrabbits
LONG Xian-ping, ZHAO Ran-zun, SHI Bei, XU Guan-xue
(DepartmentofCardiology,TheFirstAffiliatedHospital,ZunyiMedicalCollege,Zunyi563003,China.E-mail:shibei2147@163.com)
AIM: To explore the effect of transplantation of human receptor activity-modifying protein 1 (hRAMP1) gene-modified bone marrow mesenchymal stem cells (MSCs) on neointima formation after carotid balloon angioplasty in carotid atherosclerosis rabbits.METHODSMSCs were collected through density gradient centrifugation and adherent culture. MSCs were transfected with adenovirus vector carryinghRAMP1 gene to generatehRAMP1 gene-modified MSCs (hRAMP1-MSCs). All animals with carotid atherosclerosis and balloon angioplasty were randomly divided into hRAMP-MSCs group, MSCs group and control group. After the model was established, MSCs transfected with pAd2-EGFP-hRAMP1 or pAd2-EGFP and PBS were injected to the ear vein,respectively. The injured carotid arteries were harvested to detect the homing of MSCs,reendothelialization and neointima thickness 7 d, 14 d and 28 d after cell transplantation. The plasma samples were collected for detecting vascular endothelial growth factor (VEGF) by ELISA. The expression of endothelial nitric oxide synthase (eNOS) in injured carotid arteries was measured by Western blotting.RESULTSThe expression of CD31 and EGFP was observed in the neointima at different time points in hRAMP1-MSCs group and MSCs group. Compared to control group, the reendothelialization of carotid significantly increased in both hRAMP1-MSCs group and MSCs group at different time points (P<0.05), and that in hRAMP1-MSCs group showed better than that in MSCs group (P<0.05). The area of neointima and the rate of restenosis were lower in hRAMP1-MSCs group and MSCs group than those in control group, and those in hRAMP1-MSCs group were significantly lower than those in MSCs group. The plasma level of VEGF and the expression of eNOS in the injured carotid arteries were significantly higher in both hRAMP1-MSCs group and MSCs group than those in control group at different time points (P<0.05), and those in hRAMP1-MSCs group were better than those in MSCs group (P<0.05). In the injured carotid arteries, the expression level of proliferating cell nuclear antigen (PCNA) in hRAMP1-MSCs group was the lowest,with the middle level in MSCs group and the highest level in control group.CONCLUSIONThehRAMP1 gene-modified MSCs are better in promoting reendothelialization and attenuating neointima than natural MSCs. The recombinanthRAMP1 adenovirus vectors don’t affect the differentiation potential of MSCs into endothelial cells.These findings indicate that the modified stem cells have the potency of more effective reendothelialization to decrease restenosis after angioplasty.
Receptor activity-modifying protein 1; Mesenchymal stem cells; Neointima; Reendothelialization; Angioplasty
R543.5
A
10.3969/j.issn.1000-4718.2012.04.017

