新西蘭兔糖尿病腎病模型的建立方法*
陳小明, 黃丹丹, 李自成
(暨南大學附屬第一醫院心內科,廣東 廣州 510632)
1000-4718(2012)04-0765-04
2011-12-22
2012-02-24
廣東省醫學科學技術研究基金資助項目(No. WSTJJ20081120420111197405185045);暨南大學第一臨床醫學院重點學科基金項目(No.暨一臨[2010]4);廣東省科技計劃項目(No.2010-1096-136)
△通訊作者 Tel: 020-38688620; E-mail:zichengli@163.net
新西蘭兔糖尿病腎病模型的建立方法*
陳小明, 黃丹丹, 李自成△
(暨南大學附屬第一醫院心內科,廣東 廣州 510632)
目的探討小劑量四氧嘧啶(ALX)建立新西蘭兔糖尿病腎病(diabetic nephropathy,DN)模型的可行性。方法雄性新西蘭兔20只,8只為對照組,給予常規飼料,12只為糖尿病組,給予高糖高脂飲食(常規飼料加5%蔗糖、5%豬油和1%膽固醇)喂養2周,再加用小劑量ALX耳緣靜脈注射,分別檢測造模前與造模12周后兔血糖、血脂、尿蛋白和腎功能指標,并于12周后進行組織形態學觀察。結果建模成功動物具有“多飲、多食、多尿、體重減輕”的特點,并出現DN相應的形態及功能改變。結論高脂高糖飲食加ALX藥物誘導的方法,12 周時可成功制備新西蘭兔2型DN模型。
新西蘭兔; 糖尿病腎病; 四氧嘧啶; 模型,動物
糖尿病腎病(diabetic nephropathy,DN)是糖尿病常見的慢性并發癥之一,在糖尿病人群中的發生率為20%~40%。在西方國家人群中,DN已成為終末期腎功能衰竭(end-stage renal disease, ESRD)的主要原因,也是糖尿病致命的主要原因。我國DN發病率也呈逐年增多趨勢,越來越成為亟待解決的腎臟病。然而,糖尿病腎病的病因和發病機制極為復雜,迄今尚未完全明了[1-2]。在對DN進行機制研究時,比較生物學的方法是很重要的研究手段,因此,建立適當的動物模型,不僅為研究糖尿病腎病的病因、發病機制和病理生理改變提供重要線索,而且能促進藥物作用機制的研究和臨床藥物的開發。目前國內多用鼠類DN模型進行研究,而新西蘭兔較鼠類存活率高,模型穩定,重復性好,且抗病性強,利于反復采血,方便灌胃及靜脈注射藥物干預、便于進行組織器官影像學檢查。本實驗旨在應用高糖高脂飲食誘發胰島素抵抗,再以小劑量四氧嘧啶(alloxan, ALX)破壞兔胰島細胞形成糖尿病,探討新西蘭兔2型DN模型的建立方法。
材 料 和 方 法
1動物
清潔級雄性新西蘭兔20只(由廣東省實驗動物中心提供),許可證號為SCXK(粵)2008-0002。體重2.0~2.5 kg。隨機分成糖尿病組(A組,12只)和對照組(B組,8只)。
2主要試劑
ALX和膽固醇均購自Sigma,血糖測定采用強生公司One TouchⅡ血糖儀和試紙條。基礎飼料購自廣東省實驗動物中心,高脂飼料由廣東省暨南大學實驗動物中心加工形成。生化檢測由暨南大學附屬第一醫院檢驗科完成。
3方法
3.1飲食誘發胰島素抵抗 B組(對照組)喂以常規飼料(蛋白質31.10%,脂肪7.79%,其它61.11%),A組(糖尿病組)喂以高糖高脂飼料(常規飼料加5%蔗糖、5%豬油和1%膽固醇)。適應性飼養2周后,測空腹血糖(fasting blood glucose,FBG)及血脂、超敏C反應蛋白(high-sensitivity C-reactive protein, hs-CRP)、肌酐水平,血標本在耳緣靜脈采取。膽固醇和甘油三酯水平較空白組升高者考慮誘發胰島素抵抗[3]。在預實驗中兔進食含2%膽固醇、10%豬油和5%蔗糖的高脂飼料后有猝死或中風癱瘓,考慮到兔為草食性動物,且ALX造成胰腺損傷,不能適應高脂飼料,遂調整高脂配方為常規飼料加5%蔗糖、5%豬油和1%膽固醇。
3.2小劑量ALX注射誘導糖尿病 適應性喂養2周后,A組動物禁食水12 h后,耳緣靜脈注射ALX 50 mg/kg,隔天禁食水12 h后再耳緣靜脈注射ALX 100 mg/kg(均以注射用水配成5%濃度),注藥后24 h內因胰島細胞破壞,大量胰島素入血,動物會出現嚴重低血糖,注藥后48 h內給予10%葡萄糖水自由攝取,幫助其渡過低血糖期,注藥48~72 h后血糖即升高,第1周需要密切監測血糖,若有超過30 mmol/L者給予普通胰島素(1~2U/kg)皮下注射以幫助其渡過血糖紊亂期(視血糖波動情況調整用量)。B組動物僅注射等量注射用水。注射ALX 1周后,隨機血糖大于16.7 mmol/L者入選為糖尿病組,繼續原飼料喂養。
4指標與測定方法
分別于注射ALX前及注射ALX 12周后收集血尿標本,用自動生化儀檢測血糖、血甘油三酯、膽固醇、高密度脂蛋白、低密度脂蛋白、血肌酐(serum creatinine, SCr)、尿微量白蛋白等指標。注射ALX 12周后,處死動物,立即打開腹腔游離腎臟,于10%中性甲醛液中固定,脫水、包埋、切片。行HE染色,光鏡下觀察其形態學改變。
5判斷標準
2型DN兔需具備以下條件:(1)有“多飲、多食、多尿、體重減輕”癥狀,隨機血糖≥16.7 mmol/L;(2) 出現蛋白尿、腎功能異常及相應腎臟組織病理學特征。
6統計學處理
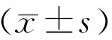
結 果
1新西蘭兔糖尿病模型建模
與空白組對比,糖尿病組兔注射ALX后出現三多一少、脫毛、活動減少等癥狀;其中1只兔在ALX注射后12 h死于低血糖,1只兔在實驗結束前死于感染;部份動物在注射ALX 1個月后血糖逐漸下降,可能與胰島細胞修復有關。全程給予5~10%葡萄糖水(濃度依個體血糖而定)自由飲用有利于保持模型穩定,2只兔在實驗結束時血糖低于16.7 mmol/L。實驗期間動物低血糖死亡率為8.3% (1/12),糖尿病模型建模率為91.7% (11/12),糖尿病成模后的死亡率為9%(1/11)。
2對比實驗中兔各項指標
可見糖尿病組兔在成模12周后血糖明顯升高(P<0.05),出現腎功能損害,尿蛋白異常,見表1。
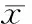
表1 兩組兔子血生化及尿蛋白測定結果
DM: diabetes mellitus; hs-CRP: high-sensitivity C-reactive protein; BUN: blood urea nitrogen; SCr: serum creatinine; UMA: urine microalbumin.*P<0.05vscontrol group (12 weeks);#P<0.05vsDM group (2 weeks).
3腎臟形態學改變
成模后12周空白組腎臟均未見病理改變;DM組腎小球毛細血管袢呈分葉狀,基底膜及系膜基質增生;腎小管部分基底膜增厚,上皮細胞腫脹、顆粒變性,見圖1。10只成模新西蘭兔腎組織均有病理改變,糖尿病腎病成模率為83.3% (10/12)。
討 論
目前DN建模方式[4]有:(1)化學藥物誘導的糖尿病腎病模型:STZ用于SD大鼠[5-7],或聯合高脂高糖飲食誘導胰島素抵抗[8],造模周期4~24周,期間模型的保持較難,動物容易死于血糖波動及感染。亦可單側腎臟切除后加重對側腎臟負擔,多因素綜合作用加速糖尿病腎病形成,但動物在術后死亡率較高,且術后使用到抗生素等藥物,可能對腎臟有額外影響。(2)自發性糖尿病腎病模型:NOD(non-obesity diabetes)小鼠和LETL大鼠均可作為1型DM的動物模型使用。2型DM自發性動物模型有db/db小鼠、KKAy小鼠、OLETF大鼠、Zucker鼠[9],db/db小鼠[10-11],此類動物種類有限,飼養條件要求高,發病率低,病程長,價格昂貴,但在一定程度上減少了人為因素,更接近自然的人類疾病。(3)基因工程糖尿病腎病模型:Smad3敲除小鼠[12]、eNOS敲除鼠,轉基因RAGE小鼠、轉基因OVE26小鼠等,制備該動物模型對技術要求高、價格昂貴等,限制了該類模型的應用,但用基因工程方法建立動物模型仍然是未來各種動物模型研究的方向。

Figure 1. Photomicrographs of renal tissues of New Zealand rabbits in the two groups (HE staing).The arrow indicates the dilation of renal tube.
圖1兩組兔腎臟病理HE染色結果
鼠類抗病性較差,不利于反復采血、灌胃及靜脈注射等干預手段,體積小不利于影像學檢查如臟器超聲檢查、血管介入檢查及干預等,部分模型造價極高,故如何科學簡便地制備糖尿病腎病動物模型就顯得越發重要。兔DN模型的建立方法值得探討。朱昆等[13]曾使用ALX 100 mg/kg誘發兔糖尿病模型并聯系胰島素管理8周建立糖尿病腎病模型,其低血糖率為20%,死亡率為10%,血糖升高率為83.3%,糖尿病成模后的死亡率為10%,糖尿病腎病成模率為63.3%。本文參考文獻報道,在此基礎上進行改進,先喂以高糖高脂飲食,誘發出胰島素抵抗,再繼以適量ALX注射,從而產生高血糖、形成腎臟病變。實驗期間動物低血糖死亡率為8.3%,血糖升高率為100%,糖尿病成模后的死亡率為9%,糖尿病腎病成模率為66.7%。本實驗改進點為:(1)注射ALX后24~48 h給予葡萄糖飲用,嚴重低血糖者需要靜脈注射50%葡萄糖液,避免低血糖引起死亡。(2)只在注射ALX后1周內使用胰島素管理。過多地使用胰島素對高血糖水平保持不利,血糖維持不到12周即下降。(3)糖尿病模型成立后根據個體血糖水平給予5%~10%葡萄糖水自由飲用,維持高糖高脂飲食,有利于高血糖的保持。(4)ALX分2次(ALX 50 mg/kg及隔日ALX 100 mg/kg)注射可以增加動物的適應性,保證血糖升高率。
盡管本實驗所建立的模型極力模仿2型糖尿病患者的病程及臨床特征,但作為一種尚處于實驗研究階段的新的動物模型,該模型腎臟形態學變化與人類2型DN對比未見典型腎小球結節,系膜基質增加及外周毛細血管滲出不明顯,有一定的差異。總體來說,該模型較好地模擬了2型糖尿病的發病過程,并出現了明顯糖尿病腎臟病變。作為一種較經濟的2型DN模型,可用于DN發病機制及其藥物治療學方面的研究。
[1] 孫愛麗,胡曉燕,關廣聚,等.尿胞外體亮氨酸氨基肽酶及二肽基肽酶在糖尿病腎病中的變化[J].中國病理生理雜志,2011,27(4):775-778.
[2] 李志杰,張 悅,劉煜敏,等.黃芪多糖對早期糖尿病腎病大鼠足細胞nephrin和podocin表達的影響[J].中國病理生理雜志,2011,27(9):1772-1776.
[3] 陸澤元,林懌昊,邵 豪,等.反映胰島素抵抗的最佳血脂指標探討[J].中國實用內科雜志,2005,25(6):512-513.
[4] 李志杰,張 悅. 糖尿病腎病動物模型的研究進展[J]. 生命科學, 2011,23(1):90-95.
[5] 楊亦彬,張 翥,蘇克亮.鏈脲佐菌素誘導大鼠糖尿病腎病模型的方法學探討[J].華西醫學,2005,20(2):299-300.
[6] 李 偉,張 紅,殷松樓.不同劑量鏈脲佐菌素誘導SD大鼠糖尿病腎病模型的研究[J].徐州醫學院學報,2006,26(1):52-55.
[7] Sun SZ,Wang Y,Li Q,et al.Effects of benazepril on renal function and kidney expression of matrix metalloproteinase-2 and tissue inhibitor of metalloproteinase-2 in diabetic rats[J].Chin Med J (Engl),2006,119(10):814-821.
[8] 李桂云,吳正治.STZ建立2型糖尿病大鼠模型的劑量探討[J].深圳中西醫結合雜志,2007,17(2):74-77.
[9] Reisin E,Ebenezer PJ,Liao J,et al.Effect of the HMG-CoA reductase inhibitor rosuvastatin on early chronic kidney injury in obese Zucker rats fed with an atherogenic diet[J].Med Sci,2009,338(4):301-309.
[10]Sharma K,McCue P,Dunn SR.Diabetic kidney disease in the db/db mouse[J].Am J Physiol Renal Physiol,2003,284(6):F1138-F1144.
[11]Huang Y,Border WA,Yu L,et al.A PAI-1 mutant,PAI-1R,slows progression of diabetic nephropathy[J]. Soc Nephrol, 2008,19(2):329-338.
[12]Wang A,Ziyadeh FN,Lee EY,et al.Interference with TGF-β signaling by Smad3-knockout in mice limits diabetic glom-erulosclerosis without affecting albuminuria[J].Am J Physiol Renal Physiol,2007,293(5):F1657-F1665.
[13]朱 昆, 潘洪濤, 羅 萍,等. 四氧嘧啶誘發兔糖尿病模型的胰島素管理及糖尿病腎病模型建立[J]. 吉林醫學,2006,27(9):1010-1011.
ConstructionofaNewZealandrabbitmodelofdiabeticnephropathy
CHEN Xiao-ming, HUANG Dan-dan, LI Zhi-cheng
(DepartmentofCardiology,TheFirstAffiliatedHospitalofJinanUniversity,Guangzhou510632,China.E-mail:zichengli@163.net)
AIM: To establish a method to produce animal model of diabetic nephropathy (DN) in New Zealand rabbits using alloxan (ALX).METHODSTwenty male New Zealand rabbits were randomly divided into 2 groups: 8 rabbits in control group were fed with conventional feed such as buffer solution;12 in diabetes milleuts (DM) group were fed with high-sugar and high-fat diet (conventional feed plus 5% sucrose, 5% pork fat and 1% cholesterol) for 2 weeks, then intravenous injection of ALX at 50 mg/kg was given, and another dosage of 100 mg/kg ALX was intravenously injected after 48 h. The levels of blood glucose, blood cholesterol, triglyceride, urine microalbumin, and serum creatinine were detected before and 12 weeks after the processes of modeling. After 12 weeks, the rabbits were sacrificed,and the kidneys were taken for pathological examination.RESULTSThe successful model of DN in the rabbits had the characteristics of high blood glucose, abundant urine microalbumin (P<0.01), and corresponding morphological and functional changes of the kidneys.CONCLUSIONRabbits with high-sugar and high-fat diet plus twice intravenous injection of ALX at a total dose of 150 mg/kg (50 mg/kg and 100 mg/kg, respectively) shows low mortality and stable diabetes mellitus state. This method induces a typical DN model in 12 weeks.
New Zealand rabbits; Diabetic nephropathies; Alloxan; Models,animal
R332
A
10.3969/j.issn.1000-4718.2012.04.035

