骨髓基質細胞及在神經系統疾病治療研究中的應用前景
謝三平,姚長江 (長江大學荊州臨床醫學院 荊州市中心醫院神經內科, 湖北 荊州 434020)
骨髓基質細胞及在神經系統疾病治療研究中的應用前景
謝三平,姚長江 (長江大學荊州臨床醫學院 荊州市中心醫院神經內科, 湖北 荊州 434020)
中樞神經系統損傷后的再生仍然是神經科學領域的難題,因此很多研究者開始探索干細胞移植治療神經系統疾病的可行性,而骨髓基質細胞因自身優勢,倍受研究者親睞,本文重點就骨髓基質細胞及其在神經系統疾病中的應用研究進展進行綜述。
骨髓基質細胞; 干細胞移植; 神經系統疾病
由于成熟的神經元是不可再生細胞,一旦受損后周圍神經組織對其修復能力將極其有限,故其相關功能將永久性缺省或缺失,所以中樞神經系統(central nervous system,CNS) 損傷性或退行性病變造成的神經功能障礙將會長期影響患者的生存及生活質量。如何治療修復受損的神經組織,恢復患者的神經功能一直是神經科學領域廣為關注和困惑的問題。自1987年Gensburger[1]從胚胎鼠中培養出神經干細胞后,揭開了神經干細胞移植治療神經系統疾病的序幕,從而為神經系統疾病的治療研究開辟了一條嶄新的途徑。目前,神經干細胞移植治療神經系統疾病的探索已成為神經科學領域研究的熱點。但由于作為細胞移植治療的神經干細胞都是來源于胚胎或胎兒的中樞神經系統,存在可用細胞數量有限、供體材料不易獲得、倫理道德等問題限制了其在臨床研究中的應用。來源于骨髓的間充質干細胞不僅無此限制,而且具有間充質-神經組織轉化的可塑性,因此備受神經學者的青睞。本文重點就骨髓基質干細胞及其在神經系統疾病中的應用研究進展進行綜述。
1 骨髓基質細胞的生物學特性及其分離方法
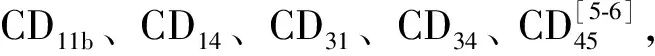
2 骨髓基質細胞的神經細胞分化潛能的體外研究
BMSCs分化為神經細胞的體外研究主要集中于化學試劑或是同神經組織細胞共同培養誘導。化學試劑誘導有抗氧化劑和神經生長因子誘導等,如全反式維甲酸(all-trans-retinoic acid,RA)、腦源性神經營養因子(Brain-Derived Neurotrophic Factor,BDNF)等。Sanchez-Ramos等[10]在研究BMSCs的神經細胞分化潛能時發現白細胞抑制因子(leucocyte inhibitory factor,LIF)可促使BMSCs向成纖維細胞分化,但不能誘導其分化為神經細胞,而BMSCs經RA和BDNF在體外共同誘導后發生了形態學的轉化,由大扁平細胞轉化成形態較小的紡錘形細胞,并形似神經細胞有長突起延伸于兩端,經免疫熒光檢測也證實有少量細胞表達神經細胞特異性表面標志nestin、NeuN和GFAP蛋白,細胞裂解物經Western blots檢測也發現有nestin、NeuN和GFAP蛋白的表達。這些現象說明BMSCs有可能經體外誘導可分化為具有神經細胞特異性表面標志的神經細胞。將β-半乳糖苷酶基因標記的BMSCs同胚鼠中腦神經細胞在含RA和BDNF的神經組織細胞培養液中共同培養2周后免疫組織化學檢測大約有2%~5%的β-半乳糖苷酶陽性細胞表達NeuN[10],明顯高于單獨培養出的BMSCs。同樣綠色熒光標記的BMSCs同胚鼠中腦神經細胞在含RA和BDNF的神經組織細胞培養液中共同培養1周后免疫組織化學檢測示骨髓基質來源的細胞中NeuN+細胞為2%~4%,GFAP+細胞為5%~8%,NeuN+細胞呈卵圓形或紡錘形,有雙極突起,形似未成熟的神經元樣細胞,位于微管締合蛋白-2(microtubule-associated protein-2,MAP-2)陽性的胚鼠中腦神經細胞周圍,但即使明確表達神經細胞標志的BMSCs也未見MAP2表達;大部分GFAP+細胞呈卵圓形或紡錘形,但其突起較NeuN+細胞的短,少部分GFAP+細胞形似神經膠質細胞呈不規則形[10]。BMSCs同胚鼠中腦神經細胞共同培養后NeuN+細胞和GFAP+細胞表達率均比單純化學誘導增加1倍以上,說明BMSCs在向神經樣細胞定向分化過程中,除細胞因子和營養因子的作用外,細胞間的相互作用也是不容忽視的。神經樣細胞不表達成熟神經細胞標志蛋白MAP2,可能是因誘導時間不夠,因為神經母細胞分化為功能性神經細胞需要數月時間。Abouelfetouh等[11]也同樣研究發現BMSCs同海馬組織碎片共同培養第3天,神經元樣細胞所占比例為31.4%±2.79%,軸突樣突起平均長56μ,但隨著培養時間的延長,神經元樣細胞所占比例逐漸降低,而軸突樣突起卻逐漸增長,第14天時神經元樣細胞所占比例為6.8%±0.8%,軸突樣突起已在細胞間交織成網很難測量,培養基中添加RA后可促進神經元樣細胞數的增加。免疫組織化學檢測發現一個有趣的現象,那些突起較長相對較成熟的細胞并不表達NeuN表面抗原,而那些突起較短未成熟的細胞卻NeuN表面抗原呈陽性,由BMSCs分化來的形態上類似神經元的細胞中9.6%±1.7%表達NeuN抗原,所有神經元樣細胞不表達膠質細胞特征抗原GFAP和Iba1,而且同時觀察到這種神經元樣細胞分化僅發生在海馬組織粹片邊緣。這也證實BMSCs具有神經細胞分化潛能,且分化動力受誘導因子及周圍微環境(與神經組織的直接接觸)雙重影響。在Wislet-Gendebien[12]將BMSCs與小腦顆粒細胞共同培養的實驗中發現成體骨髓基質細胞不僅能表達神經元特異抗原,還可與γ-氨基丁酸、甘氨酸、谷氨酸等神經遞質發生反應產生單程動作電位,說明BMSCs可分化為能產生動作電位具有功能性的神經樣細胞,但BMSCs分化為神經樣細胞需要兩個前提條件:①BMSCs表達nestin蛋白;② BMSCs與神經細胞直接接觸后產生的信號整合作用。Tseng等[13]同樣也證實,BMSCs在體外經生長因子和化學處理后,可向神經樣細胞分化,表達神經元特異標記如神經絲蛋白NF-H(35.7±8.1%)、β-微管蛋白Ⅲ(21.8±6.3%)、tau(90.4±7.5%),還有少量神經樣細胞(lt;0.1%)可分泌神經遞質γ-氨基丁酸(GABA)。關于BMSCs神經細胞分化潛能的很多研究都證實BMSCs可在體外誘導為神經樣細胞,并具有某些神經細胞樣功能如分泌神經遞質、與神經遞質反應產生動作電位等。
3 骨髓基質細胞在神經系統疾病中的研究應用
因為BMSCs具有神經細胞分化潛能,所以已經作為理想的種子細胞應用于神經系統疾病的治療研究中[14]。缺血性腦血管病是臨床常見疾病,具有較高的致死、致殘率,若發生不可逆性腦缺血將導致腦組織缺血、缺氧性壞死,造成受損腦組織相關神經功能永久性缺失,給患者的生存造成極大危害,因此如何修復受損腦組織恢復患者的神經功能是治療缺血性腦血管病的關鍵。Shen等[15]曾在探索BMSCs移植治療大腦中動脈閉塞 (middle cerebral artery occlusion MCAO)腦缺血的實驗研究中發現細胞移植治療2周后腦缺血動物模型的神經缺失癥狀開始得到改善,并且這種治療效應至少可持續1年,經原位雜交反應也證實移植后的細胞可在宿主腦內存活并部分(22.3%±1.95%)表達星形膠質細胞特異蛋白GFAP、部分(16.8%±2.13%)表達神經元特異蛋白MAP-2,可增加缺血組織周圍突觸囊泡蛋白表達明顯減輕突觸缺失。其結果提示BMSCs腦內移植后可分化為神經樣細胞,替代修復受損的神經組織。Chen等[16]研究BMSCs腦內移植治療短暫性大腦中動脈閉塞大鼠模型時也證實,移植后的BMSCs不僅能夠存活而且向損傷腦組織周圍遷移,并部分細胞表達神經膠質細胞特異標志物,減輕腦白質的損傷,促進腦皮質內β-Ⅲ-tubulin分泌,明顯改善MCAO造成的皮質功能缺失癥狀。BMSCs在移植治療腦缺血的實驗研究中顯現出的突出效果使其成為目前研究熱點。
帕金森病是老年人中一種常見的慢性、進行性中樞神經系統退行性疾病,其病理特征主要是黑質內多巴胺能神經元退行性變、數目減少,導致紋狀體內多巴胺遞質水平下降,引起震顫、肌強直和運動遲緩等錐體外系癥狀。Lu[17]等曾利用腺相關病毒載體將多巴胺生成限速酶-酪氨酸羥化酶(tyrosine hydroxylase,TH)基因導入BMSCs,然后將表達TH基因的BMSCs移植到帕金森病模型鼠的紋狀體內后觀察發現治療組阿撲嗎啡誘導的不對稱旋轉癥狀較對照組明顯減輕,6周后免疫組化檢測發現TH基因主要在移植點周圍表達,高效液相色譜儀及電化學檢測也證實TH基因修飾的BMSCs紋狀體內移植可明顯增加移植點周圍多巴胺遞質水平。證實BMSCs可作為帕金森病基因治療的有效載體細胞,為帕金森病的基因治療提供了前提條件。Zhang等[18]先將BMSCs經體外誘導為神經干細胞,然后利用基因整合技術將TH基因轉入其中,并移植入帕金森病大鼠模型腦室及紋狀體內,10周后觀察發現PD模型的不對稱旋轉癥狀明顯減輕且活動能力得到顯著改善,同對照組比較,紋狀體內移植組多巴胺水平提高46.6%,腦室內移植組巴胺水平提高33%,而且觀察到移植細胞沿著基底神經纖維發生遷移。這進一步證實了BMSCs作為種子細胞在帕金森病治療研究中的應用價值。而且還有實驗研究證實BMSCs具有多巴胺能神經元分化潛能[19]。所有這些實驗研究均為BMSCs作為干細胞移植治療帕金森病提供了理論依據。
阿爾茨海默病又名老年性癡呆,是引起老年人癡呆的最常見原因,其特征性病理改變主要有老年斑的形成、神經元纖維纏結及神經元缺失等。AD患者由于進行性智能障礙,最終導致完成喪失生活自理能力,給患者及家人造成嚴重影響,而目前又無有效的治療手段,所以設法阻止或延緩神經元的缺失,緩解患者的智能衰退是治療的關鍵。Wu等[20]將綠色熒光蛋白標記的BMSCs移植入β-淀粉樣蛋白所致AD大鼠模型海馬內,2周后水鏡迷津測驗證實BMSCs移植治療組的認知能力得到明顯改善,剛果紅著色顯示AD模型腦內神經元減少,海馬CA1區尤為明顯,而BMSCs移植治療后腦內神經元雖然不能達到正常但還是有所增加,熒光視蹤和免疫組織化學檢測發現移植細胞在腦內存活并遷移而且可能轉化為膽堿乙酰轉移酶(choline acetyl transferase,ChAT)陽性神經元。Lee等[21]也研究證實BMSCs腦內移植后,可促進腦內小膠質細胞吞噬活性,減少β-淀粉樣蛋白在急性誘導的AD小鼠模型腦內的存積,減輕β-淀粉樣蛋白對神經元的損傷,提示了BMSCs治療AD的可能性。
4 骨髓基質細胞治療神經系統疾病的可能機制
對于骨髓基質細胞的神經修復作用機制目前主要傾向于認為可能有兩方面原因:①分化為神經細胞替代修復缺損的神經組織,體內外實驗研究均證實BMSCs可向神經細胞分化[11,15],并可能分泌神經遞質[19]、與神經遞質發生反應產生動作電位[12]。Tropel等[22]也研究發現BMSCs不僅可分化為神經樣細胞,而且分化后的細胞具有神經元樣的功能,可與谷氨酸、藜蘆定堿反應增加胞質內鈣離子濃度,而且這種效應可分別被N-甲基-D-門冬氨酸受體阻斷劑、河豚毒素所阻斷,同樣發現BMSCs源性神經樣細胞可與多巴胺反應增加胞質內鈣離子濃度,所有這些均證實BMSCs源性神經樣細胞表達功能性神經遞質受體,可作為干細胞用于神經系統的治療。Cogle等[23]在一項BMSCs腦內移植后的臨床回顧性研究中發現,BMSCs可在腦內長期存活,并可轉化為神經元、星形膠質細胞和小膠質細胞,盡管發生轉化的細胞數量很少,但還是說明BMSCs有可能通過神經組織轉化來替代修復缺失的神經細胞,恢復其缺損的神經功能。②BMSCs可能通過自分泌或刺激周圍神經組織分泌各種神經營養因子,減輕神經細胞的損傷,促進神經細胞的存活和再生。Garcia等[24]體外培養BMSCs至第6代時提取總的RNA后加入特異引物,RT-PCR反應證實BMSCs表達NGF和GDNF。 Yaghoobi等[25]也研究證實BMSCs在分化為神經樣細胞前后均表達NGF和BDNF。Mahmood等[26]研究發現BMSCs通過靜脈移植后可向損傷腦組織處遷移,并明顯改善其神經功能,經酶聯免疫吸附測定(ELISA)證實BMSCs可增加腦組織內NGF和BDNF的表達,因而證明BMSCs有可能是通過增加腦組織內相關神經生長因子如NGF、BDNF等來保護受損的神經組織、降低神經功能缺損。
5 尚存的問題與展望
由于可取材于自體,來源方便,且增殖分化能力強,可避免細胞數量不足、免疫排斥、倫理道德的限制等自身優勢,同時又具有跨胚層分化潛能,可向神經細胞分化等特性,所以BMSCs已被作為理想的種子細胞應用于神經系統疾病的治療研究中。體內外大量實驗研究也證實BMSCs具有神經元、神經膠質細胞分化潛能,表現出某些神經細胞功能特征,如分泌神經遞質[19]、與神經遞質反應產生動作電位[12]等,且在神經系統疾病的治療研究中取得了理想的療效,對缺損的神經功能具有治療修復作用。但同時BMSCs應用于神經系統疾病的研究中還存在諸多問題尚未解決。首先,目前還未發現BMSCs的特異性標志,對BMSCs的鑒別主要依靠其形態、功能特征及培養中出現的分化表型來推斷,得到的細胞神經分化潛能各異,因此如何純化鑒定得到神經細胞分化潛能最強的單一的BMSCs還是一個有待解決的問題。其次,BMSCs移植后改善神經功能的確切機制還不清楚,并且關于BMSCs向神經細胞分化的研究也僅僅只是依靠其形態特征及少數神經細胞特異標志來鑒別,而BMSCs能否真正分化為神經細胞、發揮神經細胞功能、與宿主的神經組織發生有效整合、修復缺失的神經功能等還未得到充分證明[27]。再者,BMSCs的安全性問題還有待進一步證實,BMSCs體內移植后是否會發生基因突變,引起致瘤性[28]目前還無可靠證據。最后,利用BMSCs進行基因治療時也面臨著轉染效率、轉基因細胞的靶向性及基因表達的持續性和可控性等問題。盡管關于BMSCs治療神經系統疾病的研究還存在許多未知因素,但BMSCs在神經系統疾病的治療研究中顯示出來的客觀效果及隨著研究的不斷深入,BMSCs有望成為神經疾病患者的福音。
[1]Gensburger C,Labourdette G,Sensenbrenner M. Brain basic fibroblast growth factor stimulates the proliferation of rat neuronal precursor cells in vitro[J]. FEBS Lett, 1987, 217(1): 1-5.
[2]Friedenstein A J,Gorskaja J F,Kulagina N N.Fibroblast precursors in normal and irradiated mouse hematopoietic organs [J].Exp Hematol,1976,4(5):267-274.
[3]Prockop D J.Marrow stromal cells as stem cells for nonhematopoietic tissues[J].Science,1997,276(5309):71-74.
[4]Sergeeva N S,Sviridova I K, Kirsanova V A,et al.Study of growth parameters and potentialities of differentiation of multipotent mesenchymal stromal cells from rat bone marrow in vitro[J]. Bull Exp Biol Med, 2006, 141(4):530-535.
[5]Pittenger M F,Mackay A M,Beck S C,et al.Multilineage potential adult human mesenchymal stem cells[J].Science, 1999,284(5411):143-147.
[6 ]Wexler S A,Donaldson C,Denning-Kendall P, et al . Adult bone marrow is a rich source of human mesenchymal′stem′cells but umbilical cord and mobilized adult blood are not [J ]. Br J Haematol,2003, 121 (2) :368-374.
[7]Friedenstein A J,Latzinik N V,Gorskaya Y F,et al .Bone marrow stromal colony formation requires stimulation by hematopoietic cells[J].Bone Miner,1992,18(3):199-213.
[8]Yoo J U,Barthel T S,Nishi K,et al.The chondrogenic potential of human bone-marrow-derived mesenchymal progenitor cells[J].J Bone Joint Surg,1998,80(12):1745-l 757.
[9]Quirici N,Soligo D,Bossolasco P,et al.Isolation of bone marrow mesenchymal stem cells by anti-nerve growth factor receptor antibodies[J].Exp Hematol,2002,30(7):783-791.
[10]Sanchez-Ramos J, Song S, Cardozo-Pelaez F, et al. Adult Bone Marrow Stromal Cells Differentiate into Neural Cells in Vitro[J]. Exp Neurol, 2000,164(2):247-256.
[11]Abouelfetouh A, Kondoh T, Ehara K,et al . Morphological differentiation of bone marrow stromal cells into neuron-like cells after co-culture with hippocampal slice[J]. Brain Res, 2004, 1029(1):114-119.
[12]Wislet-Gendebien S,Hans G,Leprince P, et al .Plasticity of cultured mesenchymal stem cells: switch from nestin-ostive to excitable neuron-1ike phenotype[J].Stem Cells, 2005, 23 (3) :392-402.
[13]Tseng PY, Chen C J, Sheu C C, et al. Spontaneous differentiation of adult rat marrow stromal stem cells in a long-term culture. J. Vet[J]. Med. Sci, 2007, 69(2):95-102.
[14]Dezawa M,Hoshino M,Ide C.Treatment of neurodegenerative diseases using adult bone marrow stromal cell-derived neurons[J].Expert Opin BioI Ther, 2005,5(4):427-435.
[15]Shen L H, Li J, Chen J,et al. One-year follow-up after bone marrow stromal cell treatment in middle-aged female rats with stroke[J]. Stroke,2007, 38:2150-2156.
[16]Chen J R, Cheng G Y, Sheu C C, et al. Transplanted bone marrow stromal cells migrate, differentiate and improve motor function in rats with experimentally induced cerebral stroke[J]. J Anat, 2008, 213:249-258.
[17]Lu L, Zhao C, Liu Y, et al. Therapeutic benefit of TH- engineered mesenchymal stem cells for Parkinson’s disease [J]. Brain Res Brain Res Protoc, 2005, 15(1): 46- 51.
[18]Zhang S Z, Zou Z H, Jiang X D, et al. The therapeutic effects of tyrosine hydroxylase gene transfected hematopoetic stem cells in a rat model of Parkinso’s disease[J]. Cell Mol Neurobiol, 2008, 28:529-543.
[19]Trzaska K A, Kuzhikandathil E V, Rameshwar P. Specification of a dopaminergic phenotype from adult human mesenchymal stem cells[J]. Stem Cells, 2007, 25(11):2797-2808.
[20]Wu QY, Li J, Feng Z T, et al. Bone marrow stromal cells of transgenic mice can improve the cognitive ability of an Alzheimer's disease rat model. Neurosci Lett,2007,417(3) : 281-285.
[21]Lee J K, Jin H K, Bae J S. Bone marrow-derived mesenchymal stem cells reduce brain amyloid-β deposition and accelerate the activation of microglia in an acutely induced Alzheimer’s disease mouse model. Neurosci Lett, 2009, 450(2): 136-141.
[22]Tropel P, Platet N, Platel J C, et al.Functional neuronal differentiation of bone marrow-derived mesenchymal stem cells[J].Stem Cells, 2006, 24(12):2868-2876.
[23]Cogle C R, Yachnis A T, Laywell E D, et al. Bone marrow transdifferentiation in brain after transplantation: A retrospective study[J]. Lancet, 2004,363(9419): 1432-1437.
[24]Garcia R, Aguiar J, Alberti E, et al. Bone marrow stromal cells produce nerve growth factor and glial cell line-derived neurotrophic factors[J]. Biochem Biophys Res Commun, 2004, 316(3): 753-754.
[25]Yaghoobi M M, Mowla S J. Differential gene expression pattern of neurotrophins and their receptors during neuronal differentiation of rat bone marrow stromal cells[J]. Neurosci Lett, 2006, 397(1-2): 149-154.
[26]Mahmood A, Lu D, Chopp M. Intravenous administration of marrow stromal cells(MSCs )increases the expression of growth factors in rat brain after traumatic brain injury[J]. Neurotrauma, 2004, 21(1): 33-39.
[27]Raedt R, Pinxteren J, Van Dycke A. et al. Differentiation assays of bone marrow-derived Multipotent Adult Progenitor Cell (MAPC)-like cells towards neural cells cannot depend on morphology and a limited set of neural markers[J]. Exp Neurol, 2007, 203(2): 542-554.
[28]Burns J S, Abdallah B M, Guldberg P, et al. Tumorigenic heterogeneity in cancer stem cells evolved from long-term cultures of telomere[J]. Cancer Res, 2005,65: 3126-3135.
[編輯] 何 勇
10.3969/j.issn.1673-1409(R).2012.02.034
R741
A
1673-1409(2012)02-R068-05
2011-11-29
謝三平(1980-),男,湖北監利人,醫師,碩士,主要從事神經內科臨床工作。

