我院參麥注射液安全性再評價研究
李明
我院參麥注射液安全性再評價研究
李明
目的 綜合評價參麥注射液臨床使用過程中的安全性,探索中藥注射液上市后安全性再評價的方法和模式。方法 以2011年11月至2012年5月我院腫瘤病區應用參麥注射液的住院患者為研究對象,從用藥開始至出院,觀察記錄患者的藥品使用和不良反應發生情況,并進行數據統計分析。結果 472例患者中,發生不良反應3例,發生率為0.63%。結論 參麥注射液的不良反應發生率較低,臨床使用較安全。
參麥注射液;安全性;再評價
參麥注射液的主要成份為紅參、麥冬。具有益氣固脫,養陰生津,生脈之功效。由于其能提高腫瘤患者的免疫機能,與化療藥物合用時,有一定的增效作用,并能減少化療藥物所引起的毒副反應[1],臨床上常用于腫瘤患者的輔助治療。2009年,為提高中藥注射劑產品質量,降低安全隱患,國家藥監局全面啟動了中藥注射劑再評價工作,臨床應用較早的參麥注射液被列為第一批再評價品種,其安全性再評價工作也相繼展開[2,3]。我院為降低用藥風險,保障用藥安全,現對2011年11月至2012年5月腫瘤病區使用參麥注射液的患者的病歷資料做一系統總結分析,報告如下。
1 資料與方法
1.1 一般資料
選取2011年11月至2012年5月我院腫瘤病區使用神威藥業有限公司生產的參麥注射液的全部住院患者為再評價對象,觀察記錄患者的藥品應用和不良反應發生情況。
1.2 方法
1.2.1 再評價前期工作[3]方案首先經過我院藥事管理與藥物治療學委員會、醫院倫理委員會討論通過后方可實施。再評價工作開展前首先對參加研究人員進行培訓,培訓內容主要有:參麥注射液適應證、用法用量和不良反應;再評價方案具體實施步驟、《參麥注射液安全性再評價監測表》和《篩選卡》的填寫;不良事件處理措施。
1.2.2 開放式對照研究[3]①篩選組病例:根據患者情況,每例接受參麥注射液治療的住院患者均作為篩選組病例填寫篩選卡,無遺漏和重復。②觀察組病例:篩選組出現藥品不良反應,且懷疑該反應與參麥注射液有關的病例,納入觀察組,填寫監測表。③對照組病例:選擇篩選組未出現藥品不良反應的病例,與觀察組病例同期(+7 d)給予參麥注射液、且原患疾病與觀察組病例相同或相似的2個陰性病例填寫對照組監測表。
1.2.3 不良反應/不良事件觀察[3]從第一次用藥開始(即第1滴藥液進入人體),密切觀察30 min,觀測有無不良反應/事件發生,30 min后采取醫護人員定期檢查或由患者主動匯報的方法觀察,患者出院后電話回訪直至用藥后15 d,停止主動觀察。15 d后仍接受患者的主動匯報,并注意鑒別與用藥的相關性,加以記錄。出現嚴重不良反應/事件立即上報不良反應監測中心。
2 結果
2.1 患者基本情況
此次共填寫參麥注射液安全性再評價篩選卡472份(其中53份有藥物過敏史)。篩選病例分布于各個年齡段,患者32~85歲,中位年齡61歲,具體情況見表1。

表1 504例患者的年齡分布情況(例)
2.2 單次用藥劑量
參麥注射液的說明書規定用藥劑量為20~100 ml,臨床醫生根據臨床經驗及患者的情況,分別給予20、30、40、50 和60 ml5 種不同劑量,具體情況見表2。

表2 參麥注射液用藥劑量與不良反應發生率
2.3 溶媒選擇
參照參麥注射液說明書,選用5%葡萄糖注射液稀釋較為適宜,我院臨床使用較多的溶媒為5%葡萄糖注射液和0.9%氯化鈉注射液,具體情況見表3。
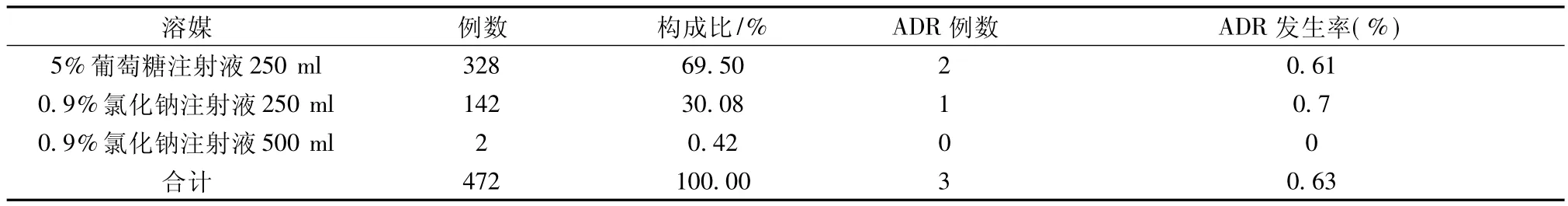
表3 參麥注射液溶媒選擇情況
2.4 不良反應觀察
472例病例中發生不良反應3例(0.63%)。2例表現為嘔吐、1例表現為心跳過速,均在短時間內好轉或痊愈,對原患疾病無影響。
3 討論
由于藥品上市前研究的局限性和上市后臨床應用的不合理性,決定了每種藥品的批準生產上市并不意味著對其評價的結束,而是表明已具備在社會范圍內對其進行更深入研究的條件[4]。通過對參麥注射液進行上市后安全性再評價,探討藥品不良反應發生率及其影響因素,為臨床合理應用提供科學依據。
我院腫瘤病區參麥注射液的使用劑量在20~80 ml之間,常用劑量為40 ml和60 ml。此次收集的數據顯示,發生不良反應的患者使用劑量均為60 ml,但由于60 ml組例數較少,不能較好的反映單次藥物用量與不良反應發生率之間的關系,建議臨床使用時劑量不宜過大。
參麥注射液藥品說明書中描述,該藥用5%葡萄糖注射液250~500 ml稀釋后應用。從表3可見,本次觀察中有142例使用0.9%氯化鈉注射液250 ml作溶媒,考慮可能與部分患者有或疑有糖尿病有關。觀察結果顯示,雖然兩種溶媒均出現不良反應,但不良反應發生率較低,與文獻報道一致[5]。
不良反應的發生,不僅與藥物本身有關,還與患者的病理生理狀態,尤其是遺傳、代謝、酶系統等密切相關。在此次研究中,共觀察472例使用參麥注射液患者,發生不良反應3例,主要分布在40~69歲年齡段,70歲以上的老年人不良反應發生率較低,可能與老年人對藥物的敏感性減低有關。
綜上,此次研究通過觀察參麥注射液在我院腫瘤病區的使用情況,發現臨床用藥基本合理。但由于不良反應病例數較少,不能較好表明藥物劑量、溶媒、個體差異等對不良反應的影響,仍需進一步觀察。
[1]國家藥典委員會編.中華人民共和國藥典臨床用藥須知中藥成方制劑卷2010版.北京:中國醫藥科技出版社,2011:469.
[2]王春勝,張伯賢,楊滿玲.參麥注射液上市后安全性再評價研究報告.天津藥學,2011,22(5):24-26.
[3]高寧,羅志琴,謝廣茹,等.參麥注射液上市后安全性再評價.醫藥導報,2011,30(7):961.
[4]朱舒兵,喻錦揚,唐曉紅,等.注射用炎琥寧上市后安全性再評價研究.中國藥房,2011,22(47):4491-4493.
[5]王欣眉,余永秀,錢放,等.參麥注射液在臨床應用中輸液載體的選擇分析.華西藥學雜志,2010,25(2):249-250.
243000 馬鞍山市人民醫院藥事科

