參附注射液對膿毒癥患者TNF-α、IL-6、IL-8水平的影響
莊育剛
(上海市第十人民醫院,上海 200072)
膿毒癥是臨床常見急危重癥,其發病率逐年遞增[1]。筆者觀察參附注射液對膿毒癥患者炎性因子腫瘤壞死因子-α(TNF-α)、白細胞介素-6(IL-6)、白細胞介素-8(IL-8)表達的影響,驗證其在膿毒癥治療及多器官功能障礙綜合征防治中的價值。現報告如下。
1 資料與方法
1.1 臨床資料 選擇上海市第十人民醫院2009年8月-2011年3月期間膿毒癥患者56例,根據入院順序編號隨機分成實驗組和對照組各28例。實驗組男性18例,女性10例;年齡26~60歲,平均41.50歲。對照組男性16例,女性12例;年齡30~64歲,平均44.50歲。兩組資料差異無統計學意義(P>0.05),具有可比性。
1.2 治療方法 對照組采用抗感染及對癥支持等常規治療方案。實驗組在常規治療基礎上另予參附注射液100mL加入5%葡萄糖注射液500mL靜脈滴注,每日1次。
1.3 觀察指標 所有患者均分別在入院后第2天 (治療前)及入院后第12天(治療后)空腹靜脈采血,檢測TNF-α、IL-6、IL-8。測定采用酶聯免疫吸附法(ELISA)檢測試劑盒進行測定,以波長450nm測定吸光度(A)值,從標準曲線查找樣品濃度以確定樣品的含量,均嚴格按說明書操作。3種試劑盒均購于R&D公司。
1.4 統計學處理 應用SPSS13.0統計學軟件。計量資料以()表示,采用 χ2檢驗、獨立樣本 t檢驗。P<0.05 為差異有統計學意義。
2 結 果
見表1。與治療前比較,實驗組治療后TNF-α、IL-6、IL-8均有明顯下降(P<0.05)。與對照組比較,實驗組治療后改善更明顯(P<0.05)。
表1 兩組治療前后TNF-α、IL-6、IL-8水平比較()
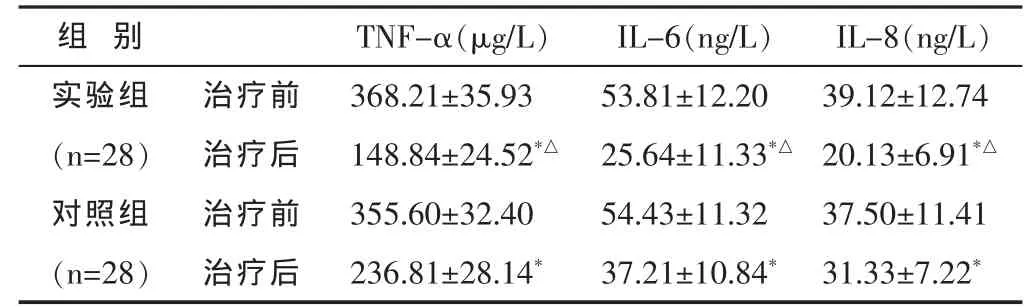
表1 兩組治療前后TNF-α、IL-6、IL-8水平比較()
與本組治療前比較,*P<0.05;與對照組治療后比較,△P<0.05。
組 別IL-8(ng/L)TNF-α(μg/L) IL-6(ng/L)實驗組 治療前 39.12±12.74(n=28) 治療后 20.13±6.91*△對照組 治療前 37.50±11.41 368.21±35.93 53.81±12.20 148.84±24.52*△ 25.64±11.33*△355.60±32.40 54.43±11.32(n=28) 治療后 31.33±7.22*236.81±28.14* 37.21±10.84*
3 討 論
膿毒癥的發生率及病死率較高,可引發多器官功能障礙綜合征進而導致死亡。免疫功能紊亂在膿毒癥發生發展過程中具有重要作用。在膿毒癥早期,血中促炎細胞因子如TNF-α、IL-6、IL-8等明顯增加,大量炎性反應因子造成機體循環功能障礙,進而促使膿毒癥病情惡化,如不及時處理,將引起多臟器衰竭,因此抑制炎癥反應是膿毒癥治療的重點[2]。
TNF-α是由單核細胞、巨噬細胞及T細胞分泌并在膿毒癥發病過程中起重要作用的一類促炎因子,其過度釋放可激發更多細胞因子的產生,進而誘發一系列炎癥連鎖反應。TNF-α引發的炎癥反應可增強血管通透性,使血流動力學紊亂,引發微循環及細胞功能障礙,進而導致多器官功能障礙綜合征的發生。因此TNF-α的血清質量濃度與病情的嚴重程度有密切關系[3]。IL-6主要由單核巨噬細胞、膠質細胞、T細胞、內皮細胞、纖維細胞及T細胞等產生。IL-6的靶細胞種類眾多,可發揮多種生物學效應。可促進B細胞增殖分化,并誘導其分泌抗體;可作為細胞刺激因子可誘導肝細胞合成急性反應蛋白,從而引起急性期反應;刺激T細胞,促進T細胞產生IL-2;做為致熱原刺激下丘腦體溫調節中樞引起發熱;促進早期骨髓造血干細胞的生長,影響粒細胞的分化過程。膿毒癥的病理過程中,IL-6可促進膿毒癥的進展[4-6]。IL-8是具有趨化作用的炎性因子之一,IL-1、IL-3、IL-7及免疫復合物等均可激發IL-8的產生。IL-8是介導中性粒細胞聚集,導致炎癥反應和組織損傷的重要介質之一,其不僅在中性粒細胞聚集中起重要作用,還參與了對病原菌的調理吞噬殺滅過程,可影響膿毒癥的發生發展[7-8]。
中醫對膿毒癥的治療理念提出了三證(熱毒證、瘀血證、急性虛證)對三法(清熱解毒法、活血化瘀法、扶正固本法),而參附注射液恰是以其扶正固本的功能應對膿毒癥的虛證,進而使臨床中膿毒癥的治療療效得到了進一步的提高。本觀察表明,參附注射液可明顯降低炎性因子TNF-α、IL-6、IL-8的血清質量濃度,從而避免炎癥反應失控后導致的多器官功能障礙綜合征發生,這對臨床治療膿毒癥有良好的意義。
[1]Angus DC,Linde-Zwirble WT,Lidicker J,et al.Epidemiology of severe sepsis in the United States:analysis of incidence,outcome,and associated costs of care[J].Crit Care Med,2001,29(10):1303-1310.
[2]俞森洋.嚴重膿毒癥和膿毒性休克的治療新進展[J].臨床肺科雜志,2009,14(4):427-429.
[3]Luzzani A,Polati E,Dorizzi R,et al.Comparison of procalcitoninand C-reactive proteinas markers of sepsis[J].Crit Care Med,2003,31(6):1737-1741.
[4]杜文斌,李毅,陳德昌,等.血清降鈣素原和白細胞介素6檢測在感染和非感染性全身炎癥反應鑒別診斷中的作用[J].中華醫學雜志,2002,16(12):1111-1114.
[5]Kocabas E,Sarikcioglu A.C-react iveprotein,interleukin-6,i nterleukin-8 and tumor necrosis factoral phainthe diagnosis of nenatal sepsis[J].Turk J Ped iatr,2007,49 (1):7-20.
[6]么國旺,殷宗福.MODS發病機制中IL-1、IL-6、IL-10陰陽相關屬性[J].中國中西醫結合外科雜志,2007,12(3):577-580.
[7]Caini S,Koldkjaer OG,Pederson C,et al.Procalcitonin,lipopo-lysaccharide-binding protein,interleukin-6and C-reactive proteinin community-acquired infections and sepsis:aprospectivestudy[J].CritCare,2006,10(2):R53.
[8]Vindenes H,Ulves t acl E,Bierknes R.Ncreased levels of circul at ing interleukin 8 in patient s with large burn:relat ion t o burn size and sepsis[J].J T rauma.1995, 39(5):635-640.

