腫瘤自噬效應及其在非小細胞肺癌分子靶向治療中的潛在應用
陳美娟,詹 瑧,張 旭,2
(1.南京中醫藥大學基礎醫學院中西醫結合基礎學科,2.江蘇省方劑研究重點實驗室,江蘇 南京 210046)
肺癌是嚴重危害人類健康的惡性腫瘤之一,其中非小細胞肺癌(non-smallcelllungcancer,NSCLC)約占肺癌的80%。目前臨床上常用的手術、放化療等治療手段其療效仍然相當不足,臨床治療失敗的主要原因是復發和發生重要器官的轉移,因此,迫切需要尋找其它治療手段以彌補目前治療的不足。
1 NSCLC分子靶向治療的主要方向及存在問題
隨著分子生物學的發展和對癌癥發生機制的深入研究,以特定分子為靶點的抗腫瘤藥物逐漸受到關注。例如表皮生長因子受體(epidermal growth factor receptor,EGFR),由于其在多種上皮腫瘤中均過度表達,而且在調節腫瘤細胞的生長、修復和生存及新生血管的生成、侵襲和轉移中具有重要的作用,因此成為抗腫瘤藥物的重要靶點之一。由于大多數NSCLC都表達EGFR及其天然配體,目前發現約62%的鱗癌和腺癌中存在EGFR的過度表達[1],并且EGFR的活化可進一步激活對腫瘤的發生、發展都起關鍵作用的Ras/MAPK、PI3K/Akt和 JAK/STATs等3 條信號通路[2],因此針對EGFR的分子靶向治療成為NSCLC臨床中治療的一個重要方向。以吉非替尼(gefitinib)和厄洛替尼(erlotinib)為代表的表皮生長因子受體酪氨酸激酶抑制劑(EGFR-TKI)和以西妥昔(cetuximab)為代表的EGFR單克隆抗體已應用于NSCLC的臨床治療,并且顯示出了一定的療效,但隨著天然或獲得性抵抗的發生,其療效會大大降低。據最新報道,這些藥物產生臨床耐藥性某種程度上和它們誘導腫瘤細胞產生自噬(autophagy)作用有關[3-4]。
2 自噬在腫瘤治療中的雙重作用
自噬是溶酶體對細胞內的部分細胞質、細胞器等進行一系列降解過程的統稱。其形態學的最主要特征是細胞內出現大量具有雙層膜的內部存在胞質及細胞器的吞噬泡。自噬在腫瘤的發生、發展中具有雙重的作用。在某些情況下自噬可能成為保護腫瘤細胞免受損傷的應激保護機制,如當腫瘤細胞缺乏營養供應時,尤其在腫瘤的中心地帶,細胞內自噬作用會增加,通過降解蛋白質和細胞器可以給其他腫瘤細胞供應氨基酸、脂肪酸和核苷酸等營養物質以提高其生存的機會和侵襲的能力[5]。因此,在某些情況下抑制自噬可以增加藥物的抗癌作用。如Wu等[6]發現在人惡性膠質瘤細胞中,抑制自噬會明顯降低膠質瘤細胞在營養被剝奪狀況下的生存能力,而通過過表達真核延長因子-2激酶(eEF-2K)提高自噬水平,可以提高腫瘤細胞在營養缺乏狀況下的生存能力,并且發現mTOR通路參與eEF-2K對自噬的調節。Amaravadi等[7]給動物接種缺少核p53基因從而能抵抗凋亡的腫瘤細胞造成淋巴瘤動物模型,發現動物整體水平通過它莫西芬誘導激活p53后,腫瘤先衰退,然后出現復發。進一步研究發現,p53的激活很快伴隨凋亡細胞的出現,但在存活的細胞中產生了自噬。而通過氯喹或針對Atg5進行shRNA干擾抑制自噬,會提高腫瘤細胞p53激活的水平和烷化劑誘導腫瘤細胞死亡的能力。Carew等[8]也發現,通過氯喹阻斷自噬,可以提高組蛋白脫乙酰酶抑制劑——SAHA誘導的過氧化物的產生水平,促進其重新定位,并明顯增加其在溶酶體蛋白酶內的含量,減少其底物硫氧還蛋白的表達,從而提高其抗癌活性。另外,在某些放化療治療中,自噬也成為腫瘤細胞逃避損傷的機制[9-10]。
與上述自噬保護腫瘤細胞的情況相反,許多研究發現自噬也可以在抗腫瘤方面發揮重要作用。因為自噬可以通過清除受損細胞器,避免有害自由基及突變的發生,從而避免更大范圍的損傷;還可以限制DNA損傷,維持基因組完整性;另外還能抑制細胞生長,誘發腫瘤細胞發生凋亡式程序性死亡。如Scott等[11]發現,Atg1高表達所誘導的自噬可使腫瘤細胞明顯縮小,從而控制其生長。同時發現自噬可誘發腫瘤細胞死亡,這種細胞死亡具有明顯的凋亡特征。在其他的療法或藥物抗腫瘤的過程中,也發現自噬過程發揮了積極作用,物理療法如Kessel等[12]報道的光動力療法;抗癌藥物如烷化劑——替莫唑胺(temozolomide)、順鉑;mTOR抑制劑——rapamycin、temsirolimus、everolimus;天然藥物——伴刀豆球蛋白A(Con A)、姜黃素、染料木黃酮(genistein)、維生素 D 類似物;NF-κB 抑制劑——BAY11-7082,Parthenolide;植物生物堿——紫杉醇、長春堿;甚至還有其他一些化合物如 As2O3、糖皮質激素、Nelfinavir等[13]。
3 自噬效應在非小細胞肺癌分子靶向治療中的潛在應用
在NSCLC臨床常用藥物gefitinib和erlotinib抗藥性產生機制的研究中,Han等[3]發現,gefitinib和erlotinib可通過抑制PI3K/Akt/mTOR信號通路誘導肺腺癌細胞A549和H1299發生較高水平的自噬,甚至在用siRNAs干擾降低EGFR的表達后,gefitinib、erlotinib依然能誘導自噬。而當用自噬抑制劑氯喹(chloroquine,CQ)或用siRNAs對自噬相關基因Atg5和Atg7進行干擾后,則會明顯增加gefitinib和erlotinib的細胞毒性。另外,Li等[4]也報道,西妥昔單抗的臨床抗藥性的產生也和其誘導自噬相關,其主要也是通過抑制PI3K/Akt/mTOR信號通路,誘導肺癌細胞產生自噬,細胞自噬的同時還伴隨HIF-1α和Bcl-2水平的降低。用PI3K-Ⅲ抑制劑3-MA可以抑制西妥昔單抗誘導的自噬,而敲除自噬調節基因beclin1或Atg7,或用溶酶體抑制劑氯喹處理細胞會增加西妥昔單抗誘導的細胞凋亡。
由此表明自噬作用在NSCLC的臨床治療中同樣是一個不可忽略的重要環節,在NSCLC治療的各個階段都應考慮到自噬作用的影響。
在腫瘤發生的早期階段,自噬可表現出抑制腫瘤的作用,因此在肺癌的早期診斷和治療中,應將自噬相關基因beclin1、p53等納入肺癌的臨床分型指標體系。其中,beclin1是自噬最主要的正調節因子,在多種人類癌細胞中發現beclin1的缺失[14]。此外,值得重視的是對自噬具有雙重調節能力的抑癌基因p53。在正常情況下p53為野生型(wt p53),而在大部分癌細胞包括肺癌細胞中,p53表現為突變型(mt p53)[15]。在NSCLC中,p53突變的比例約占50%,而且其發生水平在鱗癌中相對最高,在腺癌中較低[16-19]。p53對自噬的雙重調節作用主要表現在:在細胞核中,p53作為核轉錄因子,通過與 AMPK、DAPK-1、DRAM(damage-regulated autophagy modulator)、Bad、Bax、BNIP3、PUMA、Sestrin1/2和TSC2等自噬調節分子的基因啟動子區結合,可以促進相關基因的轉錄,從而促進自噬;而在細胞質中,p53不依賴于其核轉錄因子的角色,而主要是通過激活mTORC1,抑制自噬。而且,在營養缺乏或缺氧的情況下,增加的自噬可能促成p53缺失的癌細胞的生存[20]。
由于在腫瘤發展的后期,自噬可能對腫瘤的進展起促進作用,如處于腫瘤組織中心部位的腫瘤細胞可以通過自噬在低氧供應和低營養狀態下獲得生存;另外,自噬還可通過封閉凋亡通路以保護某些腫瘤細胞的抗癌治療。在該類情況下,則應該抑制自噬、激活凋亡,從而讓腫瘤細胞對治療手段變得敏感。
另外,還可以有針對性地探索一些單純誘導腫瘤細胞發生自吞噬式細胞死亡(即Ⅱ型程序性細胞死亡)的藥物和治療手段。尋找該類藥物的方向主要從調控自噬的相關信號通路和相關分子靶標入手。目前發現正向調節自噬的信號通路或相關分子主要有:Ras/Raf1/ERK1/2、ClassⅢPI3K/Beclin1、TRAIL-R(TNF-related apoptosis-inducing factor)/TNF-R/FADD(Fas-associated death domain protein),LKB1/AMPK、JNK、DAPK(death-associated protein kinase),DRP-1(death-associated related protein kinase-1);負向調節自噬的信號通路主要有:ClassIPI3K/AKT/mTOR/p70s6k、p38MAPK等(Fig 1)[21]。
其中,在負向調節自噬的信號通路中,mTOR是最主要的信號分子。mTOR是哺乳動物雷帕霉素的靶點,其對細胞的生長、增殖、存活都具有重要的調節作用。mTOR既可以與 Raptor、mLST8和 PRAS40組成 mTOR復 合 體 1(mTORC1),也可以和 Rictor、mSIN1和 Protor-1組成 mTOR復合體2(mTORC2),其中只有mTORC1對雷帕霉素敏感。
在mTORC1的上游,調節mTORC1的信號通路主要有3條:即 ClassIPI3K/AKT、Ras/Raf1/ERK1/2和 LKB1/AMPK。其中前兩條通路激活 mTORC1,最后一條通路抑制mTORC1。PI3K/Akt對mTOR的激活一是通過抑制TSC1/TSC2復合體來激活 Rheb,從而激活 mTORC1[22];二是通過磷酸化激活mTORC1的結合蛋白PRAS40,使其與mTORC1解離,同時結合 14-3-3蛋白,從而 mTORC1被激活[23]。LKB1(絲氨酸/蘇氨酸激酶11)下調mTORC1主要是在細胞遇到能量短缺壓力時,被PARP-1[poly(ADP-ribose)polymerase-1]激活的 LKB1首先將 AMPK磷酸化,然后活化的AMPK將TSC2磷酸化激活,活化的TSC2再激活 Rheb的GAP,從而抑制 mTORC1[24]。
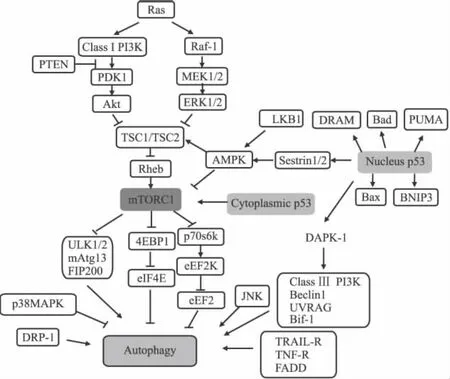
Fig 1 Diagram of autophagy signaling
在mTORC1的下游,mTORC1也通過3條途徑影響自噬:其一,通過阻止哺乳動物自噬相關蛋白13(mAtg13)和ULK的結合,導致 ULK穩定性下降,使依賴于 ULK的FIP200的磷酸化被抑制,從而誘導自噬;其二,通過促進4EBP1的磷酸化,利于其與真核翻譯起始因子4E(eIF4E)解離,從而上調cap依賴的翻譯過程,抑制自噬;其三,真核延長因子2(eEF2)可以促進肽鏈延長,但eEF2激酶(eEF2K)可磷酸化eEF2并使其失活,從而抑制肽鏈延長。但磷酸化的p70s6k可以磷酸化eEF2K,使上述活性失效,從而促進翻譯。因此mTORC1通過磷酸化p70s6k,促進翻譯,抑制自噬[25]。
4 結語
總之,在NSCLC的臨床治療中,應充分考慮并利用好自噬效應,適當情況下,可以將其作為NSCLC分子靶向治療的方向之一,從而一方面使各種治療手段的臨床療效得以提高,另一方面結合自噬相關信號通路,開發出新的靶標治療藥物,使得它們共同為NSCLC的臨床治療更有效地發揮作用。
[1]Hirsch F R,Varella-Garcia M,Bunn P A Jr,et al.Epidermal growth factor receptor in non-small-cell lung carcinomas:correlation between gene copy number and protein expression and impact on prognosis[J].J Clin Oncol,2003,21(20):3798-807.
[2]熊 飛,詹 瑧,唐于平,等.PI3K/Akt信號轉導通路在非小細胞肺癌中的作用[J].中國藥理學通報,2010,26(10):1264-7.
[2]Xiong F,Zhan Z,Tang Y P,et al.The effect of PI3K/Akt signal transduction pathway in non-small cell lung cancer[J].Chin Pharmacol Bull,2010,26(10):1264-7.
[3]Han W D,Pan H M,Chen Y,et al.EGFR tyrosine kinase inhibitors activate autophagy as a cytoprotective response in human lung cancer cells[J].Plos One,2011,6(6):e18691.
[4]Li X Q,Fan Z.The EGFR antibody cetuximab induces autophagy in cancer cells by downregulating HIF-1α and Bcl-2 and activating the beclin-1/hVps34 complex[J].Cancer Res,2010,70(14):5942-52.
[5]劉 暢,郝淑玲,于忠和.細胞自噬與肺癌關系研究進展[J].
臨床肺科雜志,2011,16(6):916-8.
[5]Liu C,Hao S L,Yu Z H.Research progresses on relationship between autophagy and lung cancer[J].J Clin Pulm Med,2011,16(6):916-8.
[6]Wu H,Yang J M,Jin S,et al.Elongation factor-2 kinase regulates autophagy in human glioblastoma cells[J].Cancer Res,2006,66(6):3015-23.
[7]Amaravadi R K,Yu D,Lum J J,et al.Autophagy inhibition enhances therapy-induced apoptosis in a Myc-induced model of lymphoma[J].J Clin Invest,2007,117(2):326-36.
[8]Carew J S,Nawrocki S T,Kahue C N,et al.Targeting autophagy augments the anticancer activity of the histone deacetylase inhibitor SAHA to overcome Bcr-Abl-mediated drug resistance[J].Blood,2007,110(1):313-22.
[9]Lomonaco S L,Finniss S,Xiang C,et al.The induction of autophagy by gamma-radiation contributes to the radioresistance of glioma stem cells[J].Int J Cancer,2009,125(3):717-22.
[10]O’Donovan T R,O’Sullivan G C,McKenna S.Induction of autophagy by drug-resistant esophageal cancer cells promotes their survival and recovery following treatment with chemotherapeutics[J].Autophagy,2011,7(6):509-24.
[11]Scott R C,Juhsz G,Neufeld T P.Direct induction of autophagy by Atg1 inhibits cell growth and induces apoptotic cell death[J].Curr Biol,2007,17(1):1-11.
[12]Kessel D,Vicente M G H,Reiners J J.Initiation of apoptosis and autophagy by photodynamic therapy[J].Autophagy,2006,2(4):289-90.
[13]Levy J M,Thorburn A.Targeting autophagy during cancer therapy to improve clinical outcomes[J].Pharmacol Therapeut,2011,131(1):130-41.
[14]Mizushima N,Levine B,Cuervo A M,et al.Autophagy fights disease through cellular self-digestion[J].Nature,2008,451(7182):1069-75.
[15]Vousden K H,Lane D P.p53 in health and disease[J].Nat Rev Mol Cell Biol,2007,8(4):275-83.
[16]Bodner S M,Minna J D,Jensen S M,et al.Expressionof mutant p53 proteins in lung cancer correlates with the class of p53 gene mutation[J].Oncogene,1992,7(4):743- 9.
[17]Takahashi T,Nau M M,Chiba I,et al.p53:a frequent target for genetic abnormalities in lung cancer[J].Science,1989,246(4929):491-4.
[18]Kishimoto Y,Murakami Y,Shiraishi M,et al.Aberrations of the p53 tumor suppressor gene in human non-small cell carcinomas of the lung[J].Cancer Res,1992,52(17):4799- 804.
[19]Tammemagi M C,McLaughlin J R,Bull S B.Meta-analyses of p53 tumor suppressor gene alterations and clinicopathological features in resected lung cancers[J].Cancer Epidem Biomar,1999,8(7):625-34.
[20]Gao W,Shen Z,Shang L,Wang X.Upregulation of human autophagy-initiation kinase ULK1 by tumor suppressor p53 contributes to DNA-damage-induced cell death[J].Cell Death Differ,2011,18:1598-607.
[21]Codogno P,Meijer A J.Autophagy and signaling:their role in cell survival and cell death[J].Cell Death Differ,2005,12:1509- 18.
[22]Sini P,James D,Chresta C,et al.Simultaneous inhibition of mTORC1 and mTORC2 by mTOR kinase inhibitor AZD8055 induces autophagy and cell death in cancer cells[J].Autophagy,2010,6(4):553-4.
[23]Li M,Jiang X,Liu D,et al.Autophagy protects LNCaP cells under androgen deprivation conditions[J].Autophagy,2008,4(1):54-60.
[24]Vander Haar E,Lee S I,Bandhakavi S,et al.Insulin signaling to mTOR mediated by the Akt/PKB substrate PRAS40[J].Nat Cell Biol,2007,9(3):316- 23.
[25]Wang S Y,Yu Q J,Zhang R D,Liu B.Core signaling pathways of survival/death in autophagy-related cancer networks[J].Int J Biochem Cell Biol,2011,43:1263-6.

