LNCaP凍融抗原致敏的樹突狀細胞誘導的CTL對LNCaP細胞的殺傷作用*
單 磊,郝建偉,王向陽
河南省人民醫院泌尿外科鄭州 450003
#通訊作者,男,1974年7月生,博士,主治醫師,研究方向:泌尿系腫瘤,E-mail:exwhao@126.com
LNCaP凍融抗原致敏的樹突狀細胞誘導的CTL對LNCaP細胞的殺傷作用*
單 磊,郝建偉#,王向陽
河南省人民醫院泌尿外科鄭州 450003
#通訊作者,男,1974年7月生,博士,主治醫師,研究方向:泌尿系腫瘤,E-mail:exwhao@126.com
樹突狀細胞;前列腺癌;免疫治療
目的:研究負載LNCaP凍融抗原的樹突狀細胞(DC)誘導的細胞毒性T淋巴細胞(CTL)對前列腺癌LNCaP細胞的殺傷效應。方法:采用反復凍融法獲得LNCaP細胞抗原,聯合應用rhIL-4、rhGM-CSF和TNF-α體外誘導人外周血單個核細胞為成熟DC,并用LNCaP細胞凍融抗原致敏,用該致敏DC體外誘導CTL,觀察CTL對LNCaP細胞的特異性殺傷作用,并采用ELISA法檢測致敏DC IL-12 p70的分泌量。以未致敏DC為對照。結果:凍融抗原致敏DC誘導的CTL對LNCaP細胞具較高殺傷率,該作用強于未致敏DC,且當效靶比為20∶1時效用最顯著(F組別=68.314,F效靶比=7.251,F交互=56.233,P<0.05);與未致敏DC相比,致敏DC IL-12 p70分泌量顯著增加(t=4.020,P=0.002)。結論:LNCaP凍融抗原致敏DC激活的CTL在體外具有更強的殺傷LNCaP細胞的作用。
前列腺癌是男性泌尿生殖系最常見的惡性腫瘤之一[1],目前對晚期前列腺癌仍沒有有效的治療方法,但免疫治療已逐漸受到人們的重視。樹突狀細胞(dendritic cell,DC)是功能最強的專職抗原呈遞細胞。在體外制備負載腫瘤抗原的特異性DC腫瘤疫苗,再注射回體內,激發機體產生主動性抗腫瘤免疫反應,是具有良好前景的腫瘤生物治療方案。作者用外周血單個核細胞(peripheral blood mononuclear cell,PBMC)誘導DC并負載LNCaP凍融抗原,用其刺激淋巴細胞,獲得特異性細胞毒性T淋巴細胞(cytotoxic T lymphocytes,CTL),觀察該效應細胞對前列腺癌LNCaP細胞活性的影響,報道如下。
1 材料與方法
1.1 材料 人外周血標本取自該院健康志愿者,年齡20~35歲,均在獻血后2 h內進行PBMC的分離。人前列腺癌細胞株LNCaP為該科室保存。胎牛血清及RPMI 1640培養液均為美國Gibco公司產品。Ficoll分離液購自上海試劑二廠。rhIL-4、rh-GM-CSF及rhTNF-α購自Peprotech EC公司。MTT試劑盒購自南京凱基生物科技發展有限公司。ELISA試劑盒為美國R&D公司產品。Bradford蛋白濃度測定試劑盒為TPI公司產品。
1.2 LNCaP細胞凍融抗原的制備 常規培養并收集對數生長期LNCaP細胞,用PBS調整密度為2× 106mL-1,于-80℃放置20 min,迅速于37℃放置10 min,反復凍融3次。經微孔濾膜過濾后即得可溶性LNCaP凍融抗原,按Bradford蛋白濃度測定試劑盒說明書所示方法測量、計算抗原的蛋白濃度,-20℃ 保存備用。
1.3 DC和T淋巴細胞的制備 取肝素抗凝的HLA-A2陽性健康志愿者外周血 50 mL,Ficoll-Hypaque密度梯度分離,制成PBMC懸液。調整細胞密度為2×106mL-1,在37℃、體積分數5%CO2條件下培養2 h。收集上清液,加入IL-2(200 kU/ L),37℃、體積分數5%CO2條件下培養3 d收集、純化T淋巴細胞。取貼壁細胞,加入50 μg/L rhIL-4、100 μg/L rhGM-CSF和體積分數10%胎牛血清,隔日更換培養基并加入細胞因子,第5日起加入100 μg/L TNF-α,第9天收獲細胞進行DC形態學鑒定、細胞毒性實驗。
1.4 LNCaP凍融抗原對DC的致敏 收集上述DC,以1×106mL-1接種于6孔板中,以DC與抗原(以凍融前腫瘤細胞的量計)的比例1∶3加入LNCaP凍融抗原,于37℃、體積分數5%CO2條件下過夜培養。
1.5 致敏DC誘導的CTL對LNCaP細胞的殺傷效應 收集致敏DC,與培養3 d的T細胞按50∶1的比例混合后于37℃、體積分數5%CO2培養24 h,所獲細胞即為CTL。分別以CTL、未負載凍融抗原的DC誘導的T細胞和IL-2誘導的T細胞為效應細胞,以LNCaP細胞為靶細胞,按效靶比20∶1、10∶1和1∶1共培養12 h,然后采用MTT法檢測細胞活性,酶標檢測儀檢測波長570 nm處的吸光度(A)值,按公式計算細胞殺傷率:殺傷率=(靶細胞A值-效應細胞A值)/靶細胞A值×100%。
1.6 DC的IL-12 p70分泌量的測定 分別收集致敏DC和未致敏DC,每組細胞設3個復孔。培養9 d后收集上清液100 μL,進行IL-12 p70檢測,按IL-12 p70 ELISA檢測試劑盒使用說明進行操作。
1.7 統計學處理 采用SPSS 11.5進行數據分析,采用析因設計的方差分析評估致敏DC誘導的CTL對LNCaP細胞的殺傷率,應用成組設計t檢驗比較致敏和未致敏DC IL-12 p70分泌量的差異,檢驗水準α=0.05。
2 結果
2.1 DC的形態學觀察 PBMC懸液培養3 h后收獲黏附細胞,加入細胞因子培養3 d后可見貼壁細胞有明顯的集落形成,同時懸浮細胞增多,體積增大,細胞形態不規則;隨著培養時間的延長,懸浮細胞逐漸增多,體積增大更明顯,細胞具有不規則細胞核并且胞膜可見毛刺狀或根須狀突起;第9天時,細胞體積進一步增大,毛刺狀突起增多,并且細胞多數呈集束樣懸浮或散在生長,呈多邊形,具有典型的分葉型細胞核和長的突起(圖1)。
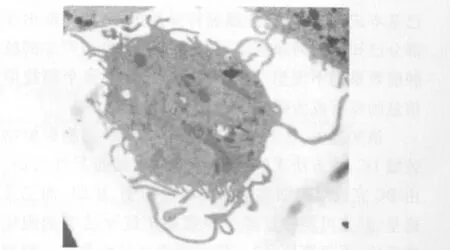
圖1 成熟DC的表現(電子顯微鏡,×3 360)
2.2 致敏DC誘導的CTL對LNCaP細胞的殺傷效應 LNCaP凍融抗原致敏DC誘導的CTL對LNCaP細胞具有較高的特異性殺傷效應,不同效靶比時的殺傷率見表1,可以看出,當效靶比為20∶1時CTL對腫瘤細胞的殺傷效應最為明顯。2.3 DC的IL-12 p70分泌量 致敏DC的IL-12 p70分泌量為(85.5±6.4)ng/L,未致敏DC分泌量為(63.4±5.5)ng/L,2者比較,差異有統計學意義(t=4.020,P=0.002)。
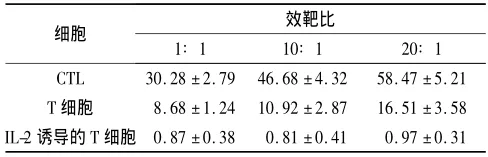
表1 DC誘導的CTL對LNCaP細胞的殺傷率(n=3)
3 討論
DC能顯著刺激初始型T細胞增殖,在機體抗腫瘤的作用中起關鍵的始動作用[2]。非成熟的DC捕獲抗原后分化為成熟DC,并將抗原肽遞呈給T淋巴細胞,誘導產生CTL,促進CTL分泌細胞因子(如IL-12、IFN-γ),產生Th1型免疫應答,發揮抗腫瘤作用[3]。在荷瘤患者體內存在抗原呈遞細胞數量不足和功能低下,以及腫瘤相關抗原性弱或具有抗原調變現象,這兩個重要原因均可導致機體無法識別和遞呈腫瘤抗原,不能激發有效的CTL抗腫瘤免疫反應,使腫瘤細胞逃避機體的免疫監視,導致腫瘤的形成和發展[4]。研究[5]表明,前列腺癌細胞可抑制DC的產生和成熟,并且前列腺癌組織中DC凋亡增加,致使DC減少。目前,體外培養、誘導DC的技術已基本成熟,但因前列腺癌特異性抗原較少,而由少部分已知的前列腺癌抗原制成的腫瘤疫苗產生的抗腫瘤效果仍不理想[6]。因此,負載瘤細胞全部抗原信息的疫苗成為研究熱點。
該實驗中,作者采用凍融的LNCaP細胞裂解物致敏DC,該方法無需分離鑒定腫瘤的特異性抗原,由DC完成對瘤細胞全部抗原的識別、攝取、加工及遞呈,并且可能激發多個腫瘤相關抗原的T細胞免疫反應,不僅簡便易行,還可增強抗腫瘤作用。細胞毒性實驗結果顯示,由LNCaP凍融抗原致敏DC誘導的CTL比未致敏DC誘導的T淋巴細胞能更明顯地殺傷LNCaP細胞,一方面間接說明前列腺癌LNCaP細胞凍融抗原能促進DC的成熟,另一方面也證實負載凍融抗原DC激活的CTL在體外能有效殺傷LNCaP細胞。
IL-12可由B細胞、肥大細胞、中性粒細胞產生,但主要來源于DC的分泌。IL-12 p70可作為DC功能成熟的指標,其具有增強DC呈遞抗原、活化T淋巴細胞產生抗原特異性免疫應答的能力[7]。該實驗結果顯示,負載腫瘤抗原DC的IL-12 p70分泌量明顯高于未負載抗原DC,說明LNCaP凍融抗原可以作為刺激信號上調DC分泌IL-12 p70的水平,促進DC的功能成熟。
綜上所述,負載前列腺癌細胞凍融抗原的DC具有很強的抗原遞呈作用,這種DC瘤苗可有效誘導特異性CTL,產生高效抗腫瘤效應,這為DC瘤苗用于治療前列腺癌及預防前列腺癌術后轉移和復發提供了理論依據。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J].CA Cancer J Clin,2009,59(4):225
[2]Turtle CJ,Hart DN.Dendritic cells in tumor immunology and immunotherapy[J].Curr Drug Targets,2004,5(1):17
[3]Jalili A.Dendritic cells and their role in cancer immunotherapy[J].Iran J Immunol,2007,4(3):127
[4]葉楓,陳懷增,謝幸,等.卵巢癌細胞株凍融抗原負載的樹突狀細胞誘導CTL抗卵巢癌免疫應答的體外研究[J].中華微生物學和免疫學雜志,2004,24(12):964
[5] Aalamian M,Pirtskhalaishvili G,Nunez A,et al.Human prostate cancer regulates generation and maturation of monocyte-derived dendritic cells[J].Prostate,2001,46(1):68
[6]Waeckerle-Men Y,Uetz-von Allmen E,Fopp M,et al.Dendritic cell-based multi-epitope immunotherapy of hormonerefractory prostate carcinoma[J].Cancer Immunol Immunother,2006,55(12):1524
[7]李東印,閔軍,褚忠華,等.抗原負載的樹突狀細胞體外誘導抗腫瘤免疫的研究[J].中華實驗外科雜志,2008,25(9):1146
Effects of cytotoxicity T lymphocyte activated by dendritic cell loaded with LNCaP cell line frozen-thawing antigen on LNCaP cell
SHAN Lei,HAO Jianwei,WANG XiangyangDepartment of Urology,Henan Provincial People’s Hospital,Zhengzhou 450003
dendritic cell;prostate cancer;immunotherapy
Aim:To investigate the immune responses of cytotoxic T lymphocytes(CTL)against prostate cancer cell LNCaP after activated by dendritic cell(DC)loaded with LNCaP frozen-thawing antigen in vitro.Methods:LNCaP cells were frozen and melt repeatedly 3 times,then tumor lysate was obtained.After separated from heparinized venous blood of healthy donors by Ficoll-Hypaque density-gradient centrifugation,peripheral blood mononuclear cells(PBMCs)were cultured and induced by rhIL-4 and rhGM-CSF and TNF-α to differentiate into DC.The cytotoxicity of CTL activated by DCs loaded with frozen-thawing antigen and cytokine release were measured by MTT assay and ELISA.Results:DCs could be harvested through healthy donors’PBMCs cultured in vitro.CTL activated by lysate-loaded DCs had more evident cytotoxicity against LNCaP cells in vitro(Fgroup=68.314,Fratio=7.251,Finteraction=56.233,P<0.05).The level of DCs excreting IL-12,which sensitized by LNCaP lysate,was higher than that of unsensitized DCs(t=4.020,P=0.002).Conclusion: CTL activated by DCs loaded with LNCaP frozen-thawing antigen exerts a remarkable killing activity on LNCaP cell in vitro.
R737.25
10.3969/j.issn.1671-6825.2012.06.023
*河南省衛生廳科技攻關基金資助項目 200903134
(2012-12-05收稿 責任編輯王 曼)

