豬口服免疫F18ac+非產(chǎn)腸毒素大腸桿菌疫苗候選株后小腸免疫細(xì)胞的組織形態(tài)學(xué)特征
董立偉,張江英 (摘譯)
(揚(yáng)州大學(xué)獸醫(yī)學(xué)院,江蘇 揚(yáng)州 225009)
1 材料和方法
1.1 細(xì)菌株 用于免疫的菌株為F18ac+非產(chǎn)腸毒素大腸桿菌疫苗候選株 2134(O157∶K119∶F18ac),攻毒使用 11-800/1/94 F4ac+ETEC 株(O149∶K91∶F4ac∶987P∶Hly+LT+STb+)。疫苗候選株通過(guò)特殊培養(yǎng)程序減毒。
1.2 單克隆抗體 詳見(jiàn)表1。
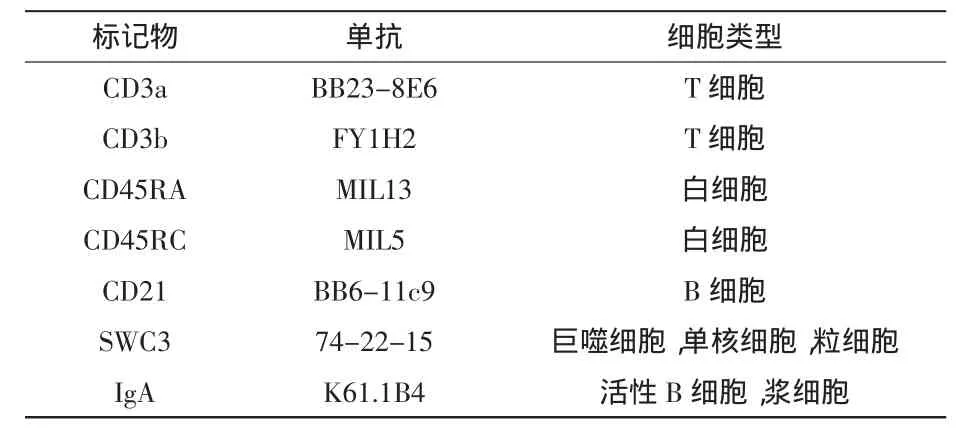
表1 用于在免疫組織學(xué)上顯示豬小腸內(nèi)淋巴樣和髓樣細(xì)胞亞群的豬白細(xì)胞CD/SWC抗原特異性單抗
1.3 豬種及試驗(yàn)設(shè)計(jì) 試驗(yàn)所用豬只為15只雜交豬(瑞典長(zhǎng)白×約克夏),未接種疫苗的對(duì)照組豬在第0d注射生理鹽水,而試驗(yàn)豬連續(xù) 3 d(-2,-1,0)肌內(nèi)注射2.5mg/kg免疫刺激劑量的左旋咪唑,或在連續(xù)3d(-2,-1,0)給予左旋咪唑的基礎(chǔ)上,在第0d通過(guò)灌胃接種60mL于TSB內(nèi)培養(yǎng)的1010CFU/mL F18ac+非ETEC疫苗候選株2143。7d后,用1010CFU/mL的F4ac+ETEC株11-800/1/94感染所有試驗(yàn)豬。第13d,在每組中選取3頭豬施行安樂(lè)死,并進(jìn)行免疫組織學(xué)取樣。
1.4 從糞便中分離疫苗株及攻毒株 在注射左旋咪唑前2d開(kāi)始以直腸拭子對(duì)每頭豬在疫苗接種和攻毒后第0d、第7d和13d進(jìn)行采樣。
1.5 取樣 每組豬中都觀測(cè)到了腹瀉現(xiàn)象(盡管強(qiáng)度、持續(xù)時(shí)間不同,且發(fā)生在每組不同編號(hào)的豬上),我們按照如下標(biāo)準(zhǔn)在每組挑選3頭豬施行安樂(lè)死并取樣:①腹瀉的有無(wú)(+或-);②腹瀉的程度(輕度為+,中度為++,+++為嚴(yán)重)。
1.6 免疫組化染色 施行安樂(lè)死后,其回腸和空腸的樣本用生物素-抗生物素復(fù)合物(ABC)法進(jìn)行染色。將鼠抗豬CD抗原特異性單抗(見(jiàn)表1)滴加在切片上并在室溫下培養(yǎng)1h。二抗采用生物素化的兔抗鼠IgG。采用標(biāo)準(zhǔn)免疫組織學(xué)技術(shù)脫水并封片。
1.7 形態(tài)測(cè)定 利用數(shù)字圖像分析(DIA)軟件程序Lucia G定量計(jì)數(shù)空腸、回腸黏膜內(nèi)淋巴樣和髓樣細(xì)胞亞群的免疫表型。利用t檢驗(yàn)分析數(shù)據(jù)得出P<0.05或更低,認(rèn)為試驗(yàn)組和對(duì)照組的細(xì)胞數(shù)之間有顯著差異。
2 結(jié)果
2.1 臨床觀測(cè) 試驗(yàn)期間,所有豬均沒(méi)有顯示大腸桿菌腸毒血癥的臨床癥狀,具體如表2所示。除了兩頭豬在第8d表現(xiàn)出中度的腹瀉外,所有其他豬在接受攻毒后都沒(méi)有產(chǎn)生腹瀉癥狀。由于腹瀉患豬是在第1d或第3d逐漸產(chǎn)生癥狀的,我們認(rèn)為其不是由接種原因產(chǎn)生的,而推斷為自然感染。
2.2 糞便樣品中的疫苗株及攻毒株 如表3所示,在試驗(yàn)處理前后通過(guò)直腸拭子對(duì)分離的E.coli株及其數(shù)量進(jìn)行評(píng)估。在試驗(yàn)的第13 d,從對(duì)照組及左旋咪唑+F18ac+非ETEC疫苗致敏組的仔豬中分離到了疫苗候選株(O157∶K119∶F18ac),菌落密度分別為1.0×106CFU/mL和8.0×105CFU/mL。從表3我們分析出,99.90%到99.92%的接種疫苗株(在第0d以1010CFU/mL濃度使用)不可能是特異性免疫后14d內(nèi)增殖的。注射了左旋咪唑的仔豬糞便中并不能分離到這種菌株。然而在試驗(yàn)的第13d,我們卻可以從這組中2/5的豬上分離出攻毒株(O149∶K91∶F4ac)。我們推測(cè),由于類似的農(nóng)場(chǎng)株(O8∶K87∶F4ac∶Hly)長(zhǎng)期存在于這些豬的胃腸道中,會(huì)導(dǎo)致攻毒后菌株更能迅速地通過(guò)腸道,因而在其他兩組豬上不能分離出攻毒株。在接種后第14 d和第7d可以分別在兩組豬中分離出少量的疫苗株(0.08%~0.10%)及攻毒株(0.55%)。由此看來(lái),攻毒株通過(guò)腸道的速率較疫苗株慢3倍。因此,較合適的免疫辦法是對(duì)仔豬自斷奶開(kāi)始至少連續(xù)接種疫苗候選株3d,并在斷奶時(shí)以較大劑量接種。
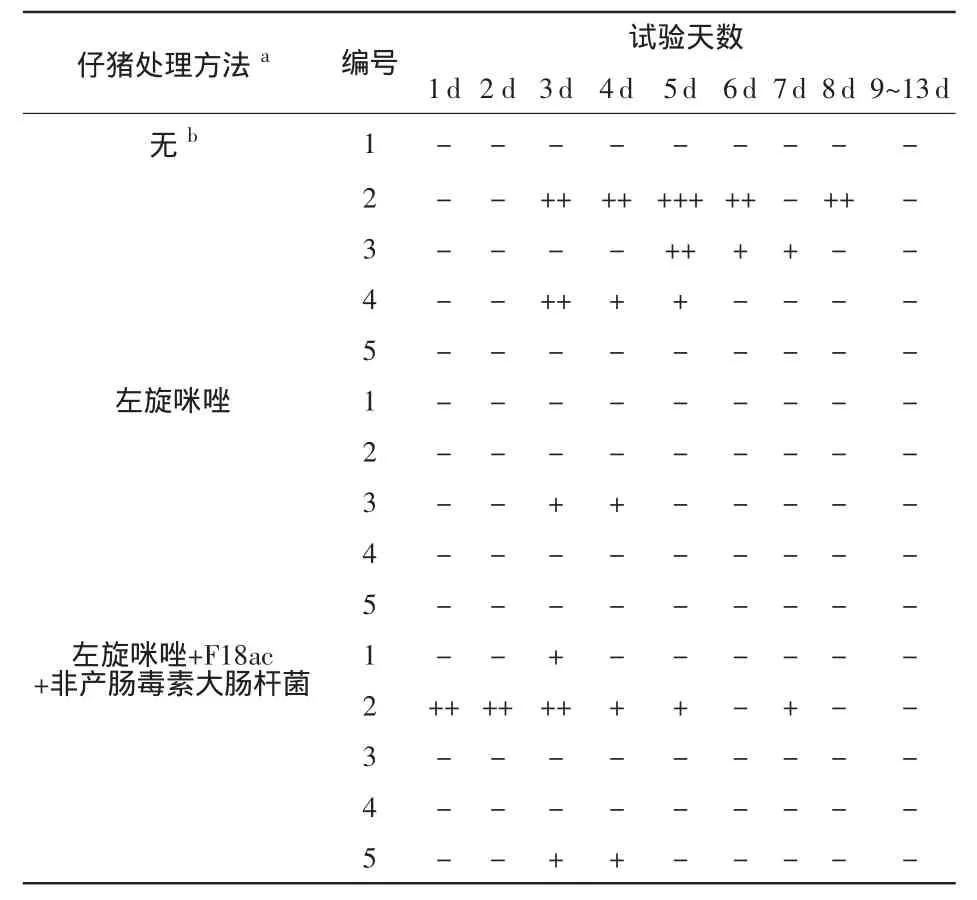
表2 基于糞便黏稠度評(píng)分的腹瀉程度
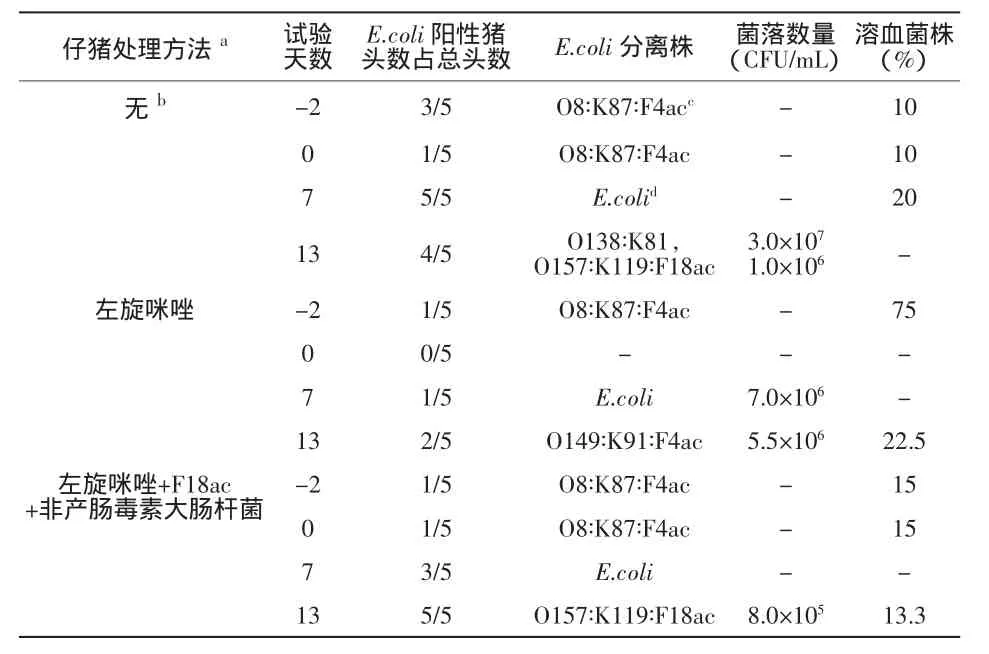
表3 直腸拭子中分離出的E.coli株及其數(shù)量
2.3 免疫組化數(shù)據(jù) 本試驗(yàn)中我們已經(jīng)證明了在腸絨毛上皮、腸固有層及回腸派伊爾氏小結(jié)中存在大量的CD3+T細(xì)胞。我們還在淋巴濾泡中發(fā)現(xiàn)少量該細(xì)胞,它們均勻地分布在隱窩及絨毛區(qū)域。而幼稚的CD45RA+淋巴樣細(xì)胞在隱窩區(qū)域分布的數(shù)量則更為龐大。這些細(xì)胞在派伊爾氏小結(jié)中占優(yōu)勢(shì)的同時(shí),在非淋巴濾泡區(qū)域內(nèi)的數(shù)量也很大。CD45RC+亞型多數(shù)位于絨毛固有層及淋巴濾泡間區(qū),在派伊爾氏小結(jié)內(nèi)很少發(fā)現(xiàn)。CD21+B細(xì)胞在絨毛及派伊爾氏小結(jié)的淋巴濾泡內(nèi)占據(jù)著數(shù)量上的優(yōu)勢(shì)。IgA+漿細(xì)胞最常在隱窩區(qū)域內(nèi)可見(jiàn);具有種屬特異性的SWC3+巨噬細(xì)胞大多分布在上皮絨毛正下方的固有層中,但在隱窩之間也有發(fā)現(xiàn)。這些細(xì)胞很少分布在回腸的派伊爾氏小結(jié)內(nèi)。
2.4 組織形態(tài)學(xué)數(shù)據(jù) 豬空腸和回腸中CD3+、CD21+、IgA+及 SWC3+淋巴樣和髓樣細(xì)胞的數(shù)量分別如表4和表5所示。定量的免疫表型分析顯示,注射左旋咪唑的豬與未注射的豬相比,其空腸內(nèi)CD3+、CD45RC+及 SWC3+細(xì)胞有顯著增加(P<0.05)(見(jiàn)表 4)。而在這些豬的回腸中,僅有CD21+細(xì)胞有顯著增加(P<0.01)(見(jiàn)表5)。接受左旋咪唑佐劑與試驗(yàn)疫苗聯(lián)合注射的豬,所檢測(cè)的小腸兩部分的所有細(xì)胞在數(shù)量上都有大幅增加(見(jiàn)表4及表5)。
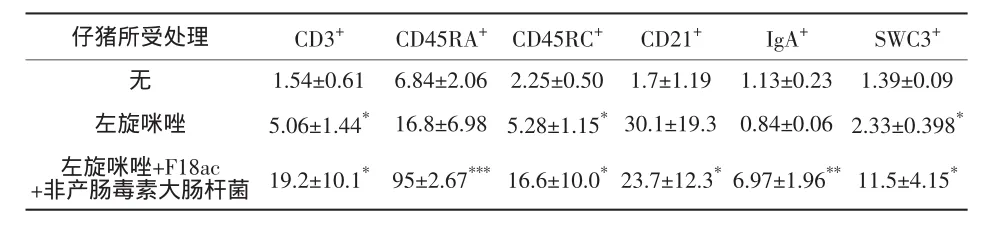
表4 定植于6周齡仔豬空腸黏膜上的淋巴細(xì)胞及髓細(xì)胞數(shù)量(平均數(shù),×10-5)

表5 定植于6周齡仔豬回腸黏膜上的淋巴細(xì)胞及髓細(xì)胞數(shù)量(平均數(shù),×10-5)
表4及表5中列出了僅免疫左旋咪唑的豬及用左旋咪唑+F18ac+non-ETEC疫苗候選株聯(lián)合免疫的豬其回腸內(nèi)淋巴樣及髓樣細(xì)胞亞群的形態(tài)學(xué)數(shù)據(jù)。結(jié)果用平均值及每1μm2組織切邊視野內(nèi)細(xì)胞數(shù)量的標(biāo)準(zhǔn)偏差表示;每個(gè)樣本中的細(xì)胞由12個(gè)隨機(jī)選取的視野(平均范圍為 672387,5μm2)來(lái)計(jì)數(shù)。
3 討論
由于遺傳變異性大及其創(chuàng)造新毒力因子或掩蓋表型特征的能力,某些腸道細(xì)菌往往可以逃脫宿主的腸道免疫。在斷奶后一段時(shí)間內(nèi)的應(yīng)激也會(huì)導(dǎo)致仔豬患病。Bertschinger等(2000)曾描述過(guò)注射腸道類疫苗的同時(shí)飼以低能量日糧這個(gè)做法的有效性,研究顯示,給斷奶仔豬口服包含F(xiàn)18菌毛抗原的活疫苗對(duì)腸道大腸桿菌感染有很好的保護(hù)力。
豬對(duì)大腸桿菌造成的腸毒血癥的抵抗力依賴于斷奶時(shí)因刺激產(chǎn)生的主動(dòng)黏膜免疫。目前的研究表明,含F(xiàn)18菌毛抗原的疫苗與左旋咪唑佐劑聯(lián)用可以顯著減少病菌的定植及感染產(chǎn)生的臨床癥狀。近期的試驗(yàn)已經(jīng)確證了該假說(shuō),即左旋咪唑?qū)嗄套胸i腸系膜淋巴結(jié)(MLN)的淋巴細(xì)胞及巨噬細(xì)胞的免疫刺激效果有助于抵抗大腸桿菌病。Bo?iê等(2003)認(rèn)為,左旋咪唑使得MLN中參與細(xì)胞免疫的免疫細(xì)胞擁有更強(qiáng)的增殖能力和活性。Snoeck等(2006)報(bào)告,空腸的派伊爾氏小結(jié)是豬在接受F4菌毛腸道免疫后,黏膜免疫應(yīng)答的主要誘導(dǎo)場(chǎng)所。
盡管口服活疫苗似乎較為有效,我們還是有必要對(duì)腸黏膜誘導(dǎo)和效應(yīng)場(chǎng)所內(nèi)的局部免疫反應(yīng)做出評(píng)估。通過(guò)組織形態(tài)學(xué)分析,我們研究了產(chǎn)生F18ac菌毛抗原的非ETEC株口服免疫對(duì)斷奶仔豬小腸黏膜淋巴樣和髓樣細(xì)胞定量及分布模式的影響。根據(jù)我們的結(jié)果,左旋咪唑的非特異性免疫刺激影響,以及它與F18ac+非ETEC疫苗候選株的協(xié)同效應(yīng)可能為斷奶仔豬提供了有效的、對(duì)抗試驗(yàn)誘發(fā)的大腸桿菌腸毒血癥的免疫保護(hù)。這些結(jié)果顯示,與左旋咪唑聯(lián)用的非ETEC疫苗候選株可以高度激發(fā)斷奶仔豬回腸及空腸固有層和派伊爾氏小結(jié)內(nèi)細(xì)胞的增殖,包括CD3+T淋巴細(xì)胞,幼稚的CD45RA+及記憶性CD45RC+淋巴樣細(xì)胞,CD21+B 淋巴細(xì)胞,IgA+漿細(xì)胞及 SWC3+巨噬細(xì)胞。
4 結(jié)論
將本試驗(yàn)結(jié)果與其他對(duì)斷奶仔豬口服免疫含F(xiàn)18菌毛抗原的活疫苗的研究結(jié)果進(jìn)行對(duì)比,顯示以左旋咪唑?yàn)樽魟┑腇18ac+非ETEC疫苗對(duì)宿主可能有相加的免疫刺激效應(yīng)。事實(shí)上,對(duì)于經(jīng)左旋咪唑預(yù)處理及F18ac+非ETEC疫苗候選株免疫的斷奶仔豬,這種效應(yīng)確實(shí)可以被所檢測(cè)到的腸道免疫細(xì)胞亞群表達(dá)的增強(qiáng)所證實(shí)。這兩種制劑可能在腸道免疫方面起協(xié)同作用,為斷奶仔豬對(duì)于試驗(yàn)引起的ETEC感染提供更好的保護(hù)。我們的數(shù)據(jù)顯示,通過(guò)對(duì)斷奶仔豬進(jìn)行雙重免疫,使得非ETEC疫苗候選株的同源抗原可以針對(duì)性地激活主動(dòng)黏膜免疫的誘發(fā)及效應(yīng)位點(diǎn),即回腸派伊爾氏小結(jié)和空腸或回腸固有層,從而獲得對(duì)豬F4ac+和(或)F18ac+ETEC株感染的有效免疫保護(hù)。
[1]Bertschinger HU,Nief V,Tschape H.Active oral immunization of suckling piglets to prevent colonization after weaning by enterotoxigenic Escherichia coli with fimbriae F18[J].Vet.Microbiol,2000,7:255-267.
[2]Bertschinger HU,Bachmann M,Mettler C,et al.Adhesive fimbriae produced in vivo by Escherichia coli O139∶K12 (B):H1 associated with enterotoxemia in pigs[J].Vet.Microbiol,1990,15:267-281.
[3]Bo?iê F,Biliê V,Valpotiê I.Levamisole mucosal adjuvant activity for a live attenuated Escherichia coli oral vaccine in weaned pigs[J].J Vet.Pharm Therap,2003,26:225-231.
[4]Bo?iê F,Biliê V,Valpotiê I.Modulation by levamisole of CD45RA and CD45RC isoforms expression in the gut[J].J Vet.Pharm Therap,2002,25:69-72.
[5]Cheng D,Sun H,Xu J,et al.Prevalence of fimbrial colonization factors F18ab and F18ac in Escherichia coli isolates from weaned piglets with edema and/or diarrhea in China[J].Vet.Microbiol,2005,110:35-39.
[6]Fairbrother JM,Nadeau E,Gyles CL.Escherichia coli post-weaning diarrhea in pigs:an update on bacterial types,pathogenesis,and prevention strategies[J].Anim.Health Res.,2005,6:17-39.
[7]GordonVM, WhippSC, MoonHW, etal.An enzymatic mutant of shiga-like toxin-II variant is a vaccinecandidateforoedema disease ofswine[J].Infect Immunity,1992,60:485-490.
[8]Jenkins EM,Hurdle C.Effect of levamisole on parenteral vaccine for swine dysentery[J].Brit.Vet.J,1989,145:565-572.
[9]Lackoviê G,Rode B,Toma1koviê M,et al.Distrib-ution of cytolytic and suppressor T cell subsets in the small intestine of pigs demonstrated by immunohistoch-emical methods[J].Per.Biol.,1997,99:437-440.
[10]McGhee JR,Mestecky J,Dertzbaugh MT,et al.The mucosal immune system from fundamental concepts to vaccine development[J].Vaccine,1992,10:75-88.

