駱駝蓬種子中一種具抗腫瘤活性蛋白的分離純化及鑒定
馬曉瑾,吳 婷,羅晶晶,王 燕,李 陽,劉東亮,孫素榮
新疆大學生命科學與技術學院新疆生物資源基因工程重點實驗室,烏魯木齊830046
脂轉移蛋白(lipid transfer proteins,LTPs)是一類分子量相對較小的堿性蛋白質,在植物、動物、酵母、真菌和一些細菌中均有發現[1]。在植物中僅發現有非特異性脂轉移蛋白(non-specific lipid transfer proteins,nsLTPs)。根據分子量的不同,植物脂轉移蛋白可分為三類。第一類是nsLTPI,分子量大約為9 kDa;第二類是nsLTPII,分子量大約為7 kDa;另外,還有一些研究發現了一些分子量大于10 kDa的脂轉移蛋白[2,3]。現已從多種植物中分離得到LTPs,如玉米[4]、水稻[5]、甜桔[6]、籮卜[7]、擬南芥[8]等。由于植物nsLTPs具有很強的抗真菌和細菌的活性,所以被列為植物防御蛋白系列。然而近年來一些研究還發現植物nsLTPs還具有較強的抗腫瘤活性,2007年Peng Lin[9]等人研究發現nsLTPs涉及細胞程序性死亡;蕓苔屬的脂轉移蛋白(LTP)能抑制肝癌細胞Hep G2和乳腺癌MCF 7細胞的增殖; 2008年Linda S.M.Ooi[10]等人從水仙花中分離出的脂轉移蛋白NTP能抑制急性前髓性白血病(HL-60)細胞的增殖。由于脂轉移蛋白表現出的多種生物學活性,目前已引起很多學者的廣泛關注。
本研究的實驗材料為駱駝蓬(Peganum harmala),是蒺藜科(Zygophyllaceae)駱駝蓬屬(Peganum)的一種多年生草本植物,已列入維吾爾藥衛生部藥品標準[11]。目前的研究表明,駱駝蓬富含多種生物堿,具有抗癌、消炎和抗病毒等多種藥理及殺蟲抑菌活性[12-14],但關于駱駝蓬活性蛋白的研究僅見于本課題組對其蛋白粗提物的活性研究[15],駱駝蓬活性蛋白的分離純化和活性的研究尚未見報道。因此,本文從駱駝蓬種子中分離純化出抗腫瘤作用較強的脂轉移蛋白并初步研究其抗腫瘤活性,可為進一步研究其抗腫瘤機制及抗腫瘤新藥的研制開發提供基礎資料。
1 材料與方法
1.1 材料
駱駝蓬種子采自烏魯木齊紅雁池水庫。宮頸癌HeLa、食管癌Eca109、肝癌BEL-7404、胃癌MGC-7和非洲綠猴腎細胞Vero細胞購自中科院上海細胞庫。CM陽離子交換層析柱,Superdex 75凝膠過濾層析柱購自GE公司,HPLC Columns購自Agilent公司。細胞培養基購自GIBCO公司,MTT購自SIGMA公司,Bradford蛋白檢測試劑盒,其他試劑為國產分析純。AKTA purifier蛋白純化儀購自GE公司,電泳設備購自北京六一儀器廠,CHRIST凍干和CO2培養箱購自北京五洲東方科技公司,生物安全柜購自HEAL FORCE,熒光顯微鏡為LEICA CTR6000,酶標儀購自美國Bio-Rad公司,高效液相層析儀購自日本Shima DZU公司。
1.2 方法
1.2.1 駱駝蓬蛋白的分離純化
稱取200 g干燥的駱駝蓬種子用粉碎機打成細粉,用預冷0.01 mol/L pH 7.2的PBS溶液2000 mL在4℃浸泡,磁力攪拌器攪拌12 h,5000 rpm,4℃離心15 min。上清液4層紗布過濾得棕色濾液,根據濾液體積加入硫酸銨調至飽和度為50%,去除蛋白沉淀,在澄清液中繼續加硫酸銨調至飽和度為80%進行鹽析。最后把沉淀分別溶于少量PBS,并移至透析袋中,以相同緩沖液為透析液在4℃下透析脫鹽(每4~8 h左右換一次透析液),直至用1%BaCl2檢測硫酸銨已完全除盡。最后將蛋白粗提液冷凍干燥,得到一定量的蛋白粗品干粉。
用0.01 mol/L,pH5.0的PBS緩沖液平衡CMSepharose柱。駱駝蓬蛋白粗品溶解過濾后,上柱,流速為0.5 mL/min。平衡緩沖液洗去未吸附的蛋白和色素,分別用包含0.1,0.2和1M NaCl的PBS緩沖液進行分步洗脫,流速為1 mL/min。穿流峰和洗脫峰經抑癌活性檢測,收集活性峰,保存于-20℃備用。活性峰樣品經濃縮后上樣于含0.15 mol/L NaCl的0.01 mol/L PBS(pH 7.2)預平衡的Superdex 75柱,流速為0.5 mL/min。收集活性峰,保存于-20℃備用。
1.2.2 分子量測定
將純化的各組分進行Tricine-SDS-PAGE電泳檢測其分子量[16]。考馬斯亮藍R-250的染色,脫色后用凝膠成像系統對電泳結果進行記錄并分析。高效液相色譜(HPLC)對駱駝蓬純化的蛋白組分進行純度和表觀分子量檢測。柱型號為 TSK-G4000 PWxl,柱溫25℃,測波長為280 nm,流動相為0.05 mol/L PBS(pH 7.2),溶劑為 0.05 mol/L PBS (pH7.2),進樣量為20 μL,流速為0.8 mL/min。分別取下列標準品作標準曲線方程:乳鐵蛋白71 kDa,卵清白蛋白44 kDa,碳酸酐酶29 kDa,β-乳球蛋白18 kDa,溶菌酶14 kDa。分析方法采用歸一法[17]。
1.2.3 N-端氨基酸序列測定
將純化蛋白進行Tricine-SDS-PAGE電泳,再轉至PVDF膜上,經考馬斯亮藍R-250染色后切膠,采用EDMAN降解法完成N-端氨基酸序列測定。將序列結果在蛋白質數據庫NCBI中作比對,進行同源序列分析。
1.2.4 增殖抑制活性檢測
取對數生長期細胞,加到96孔板中,每孔加入100 μL,細胞密度為5×104個/孔。在5%CO2,37℃繼續孵育12 h至細胞貼壁,將不同濃度的駱駝蓬蛋白用滅菌PBS溶解,過濾除菌,每孔加100 μL,設5個重復孔。5%CO2,37℃孵育不同時間后倒置顯微鏡下觀察。棄去各孔液體,每孔加入20 μL 5 mg/ mL MTT溶液和80 μL培養基,繼續培養4 h。終止培養,小心吸去孔內培養液。每孔加入100 μL二甲基亞砜,置搖床上低速振蕩10 min,使結晶物充分溶解。選擇 490 nm波長處測量各孔的吸光值(OD490)。細胞生長抑制率(%)=(陰性對照組OD490-空白組 OD490)-(實驗組 OD490-空白組OD490)/(陰性對照組 OD490-空白組 OD490)× 100%。根據藥物濃度與抑制率的反應曲線,用作圖法求出半數抑制濃度(IC50)[18,19]。
1.2.5 細胞凋亡形態觀察[20]
取對數生長期HeLa細胞接種于6孔板中,過夜培養貼壁后,加入濃度為40 μg/mL的純化的蛋白PhLTP,作用24 h后收集細胞,用PBS洗一次,離心1200 rpm×5 min,棄上清。以4%多聚甲醛1 mL加入各孔固定20 min,離心1200 rpm×5 min,棄上清,再加入1 mL Hoechst 33258染色液(終濃度為10 μg/mL),37℃避光孵育30 min,PBS洗三次,將6孔板置于LEICA DMI6000B型倒置熒光顯微鏡下隨機觀察5個視野,放大倍數為200倍并拍照。
1.2.6 數據處理
各組實驗數據測定均做3個平行實驗,結果取其平均值。各組數據之間采用單因素方差分析,用t檢驗進行組間均數的比較,使用SPSS 13.0進行數據分析。
2 結果與分析
2.1 駱駝蓬蛋白的分離純化
駱駝蓬蛋白粗提液經硫酸銨沉淀獲得80%飽和度下析出的蛋白,經透析除鹽后用CM陽離子交換層析分離得到4個組分,其中Co為穿流峰,Cx1、Cx2和Cx3(圖1)為不同鹽離子濃度線性洗脫峰。用MTT法檢測各分離組分(150 μg/mL)對HeLa細胞的抑制作用,選擇活性最強的洗脫峰Cx2進行下一步分離純化。洗脫峰Cx2經Superdex 75凝膠過濾層析再次分離后,得到2個分離組分,CX2S2(圖2)為活性較強的組分。收集該活性組分即為駱駝蓬純化蛋白PhLTP。從100 g駱駝蓬種子中經硫酸銨沉淀、CM陽離子交換層析和Superdex 75凝膠過濾層析分離純化得到的PhLTP脂轉移蛋白的得率為1.05及純化倍數為95.38(表1)。
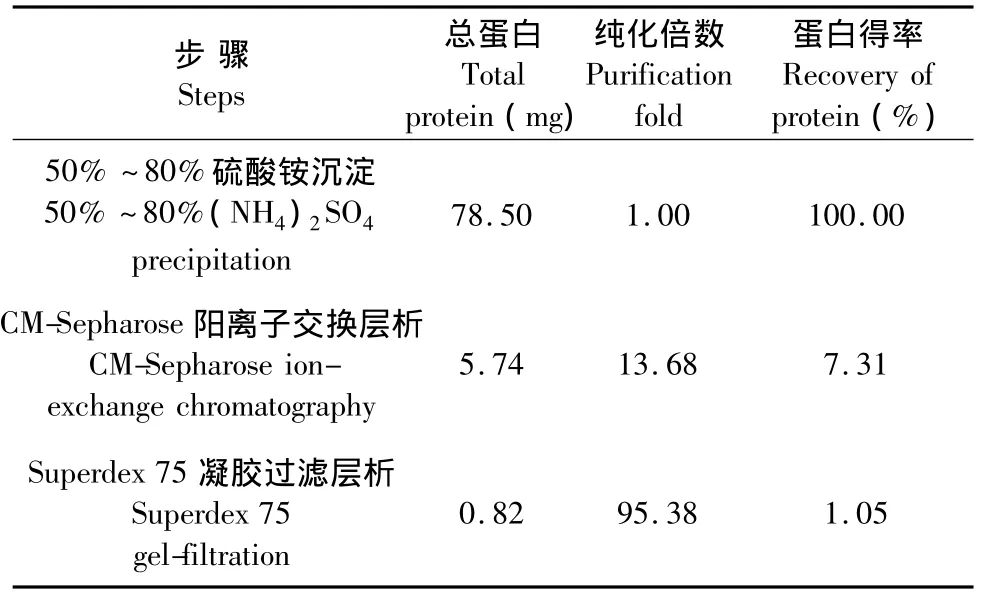
表1 駱駝蓬蛋白經不同純化步驟獲得的色譜成分的得率Table 1 Yields of chromatographic fractions obtained at different steps of purification of P.harmala protein
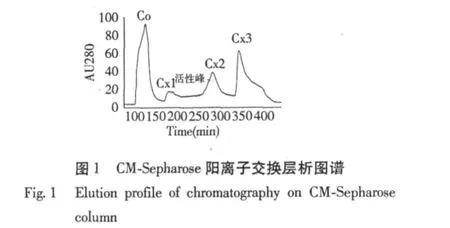
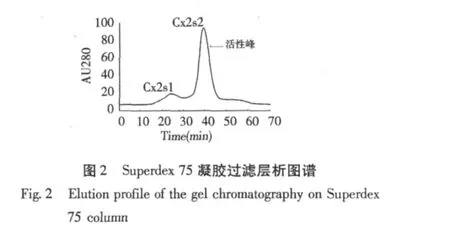
2.2 分子量測定
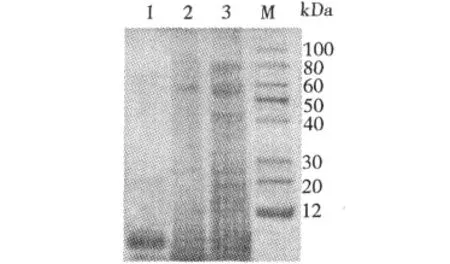
圖3 Tricine-SDS-PAGE圖譜Fig.3 Tricine-SDS-PAGE profile of PhLTP
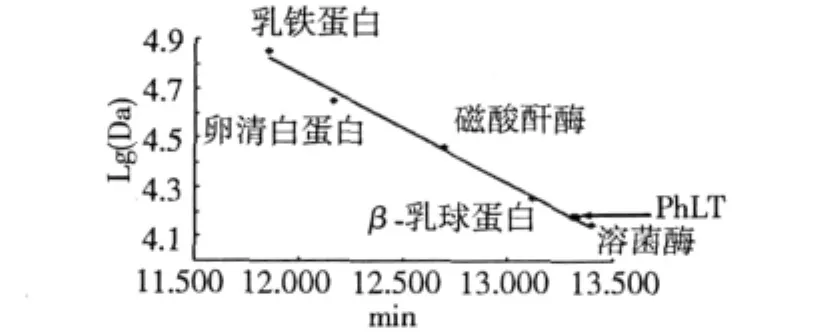
圖4 PhLTP的表觀分子量測定Fig.4 Native molecular mass estimation of PhLTP
將上步純化得到的駱駝蓬脂轉移蛋白經Tricine-SDS-PAGE鑒定,PhLTP在7.5 kDa左右處有單一條帶(圖3),采用高效液相層析(HPLC)檢測蛋白表觀分子量,按標準曲線方程計算PhLTP的分子量為14.8kDa(圖4)。
2.3 N-端氨基酸序列分析
PhLTP的 N-端 20個氨基酸的序列為ITCPQVTQSLAPCVPYLISG。采用BLAST法在NCBI數據庫進行比對,分析顯示該序列與與多種植物的脂轉移蛋白具有很高的同源性,其中與甜橙的N端序列同源性最高為75%,其次是大戟70%,油菜70%,歐洲板栗50%(表2)。因此,將該純化蛋白命名為駱駝蓬脂轉移蛋白(P.harmala lipid transfer proteins)。
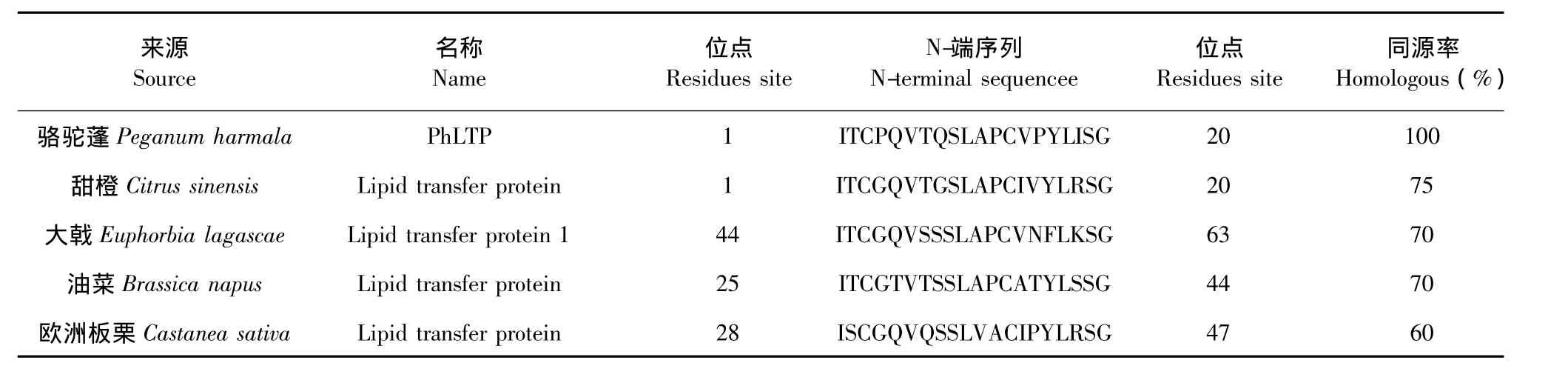
表2 PhLTP與其他脂轉移蛋白的N端氨基酸序列比較Table 1 N-terminal sequence of PhLTP with those of lipid transfer protein from other species
2.4 增殖抑制活性和誘導凋亡
不同濃度的PhLTP處理HeLa、Eca-109、MGC-9和BEL-7404細胞48 h后,計算其對幾種癌細胞的抑制率。表3結果顯示PhLTP對幾種癌細胞具有明顯的抗增殖的作用(P<0.01),并且呈劑量依賴性。相比Eca-109、MGC-9和BEL-7404細胞,該蛋白對HeLa細胞的抗增殖作用比較明顯,作用48 h時,其IC50為45 μg/mL。PhLTP對正常細胞Vero的影響較小。進一步研究PhLTP對HeLa細胞作用不同時間和不同濃度的影響,結果表明PhLTP對其對HeLa細胞的抑制作用具有時間和濃度依賴性(圖5)。
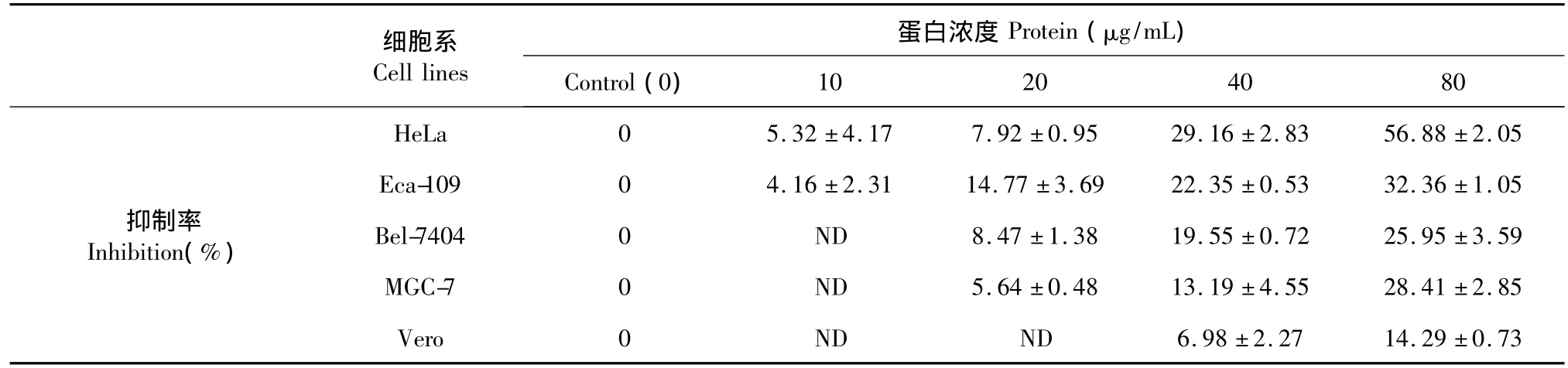
表3 PhLTP對五種細胞的增殖抑制Table 3 Inhibition of PhLTP towards five cell lines
熒光顯微鏡下觀察PhLTP對HeLa細胞的作用,從圖6可見陰性對照組的細胞平鋪貼壁生長,細胞之間排列緊密,呈現不規則多角形;而PhLTP處理組細胞數量少,形態輪廓變得不清晰,細胞明顯變圓,且皺縮變形,細胞間連接減少,細胞脫壁而至懸浮狀態。熒光顯微鏡觀察發現陰性對照組細胞核染色均勻,PhLTP處理組細胞核染色加深,核固縮,并有凋亡小體形成。說明PhLTP能夠誘導HeLa細胞的凋亡。
3 討論
目前,中藥抗腫瘤有效成分越來越多地被開發出來,據不完全統計,占抗癌藥的32.25%的是源于植物藥的抗癌制劑[20],相對于化療藥物,中藥抗腫瘤具有安全、低毒、副作用小、遺傳致突變率低[21]等優點。因此,從天然藥用植物中尋找具有抗腫瘤作用的新藥物,已成為抗腫瘤新藥研究和開發的一條重要途徑。本文從傳統維藥駱駝蓬種子中通過一系列生物化學方法篩選獲得了一種具有較強抗腫瘤活性的蛋白PhLTP。經SDS-PAGE和HPLC檢測,它由二個相同的亞基組成,表觀分子量大約為14.8 kDa。通過 N末端前20個氨基酸序列測定及與GenBank登錄的脂轉移蛋白氨基酸序列進行比對,發現駱駝蓬蛋白與甜橙、大戟,油菜和歐洲板栗等的脂轉移蛋白具有較高的相似性,說明該蛋白是一種新的脂轉移蛋白。本發現可為PhLTP基因的克隆提供一定的條件,為將來進一步將其研究開發成抗癌新藥或在農業上研制轉基因植物奠定基礎。

圖6 顯微鏡觀察PhLTP誘導HeLa細胞凋亡的形態學變化Fig.6 PhLTP-induced morphologic changes in HeLa cells observed by microscopy
本實驗純化的PhLTP具有一定的抗腫瘤活性,MTT實驗結果表明,PhLTP對多種癌細胞均具有抑制細胞增殖的作用,然而對正常細胞Vero的毒性較小,明顯低于其對腫瘤細胞的抑制率(P<0.01)。說明其對正常細胞Vero的影響較小,細胞毒作用較低,初步體現其毒副作用小的藥用價值。
近年來,對脂轉移蛋白的抗癌活性的研究越來越多,例如從紅刺露兜樹[22],芥藍[23]和水仙[10]等植物中得到的LTP都表現出抑制癌細胞增殖和誘導凋亡的作用。本研究結果證實PhLTP能誘導HeLa細胞產生凋亡小體,對HeLa細胞具有明顯的增殖抑制作用,而且具時間和濃度依賴性。目前的研究結果表明,凋亡誘導途徑主要包括以Caspase-8激活為代表的死亡受體途徑和以Caspase-9激活為代表的線粒體途徑[24],但有關脂轉移蛋白的抗腫瘤活性的分子機制以及抗腫瘤與轉脂功能之間的關系尚不清楚。因此,下一步我們將對PhLLTP的誘導凋亡機制進行深入的研究,這將對促進脂轉移蛋白相關的生物學功能的研究和進一步開發利用具有重要意義。
1 Guerbette F,Grosbois M,Croquin A,et al.Lipid-transfer proteins from plants:Structure and binding properties.Mol Cell Biochem,1999,192:157-161.
2 Kader JC.Lipid-transfer proteins in plants.Annu Rev Plant Physiol Plant Mol Biol,1996,47:627-654.
3 Wang SY(汪少蕓),Ye XY(葉秀云),Rao PF(饒平凡),et al.Research of Plant nonspecific lipid transfer protein.Bull Biol(生物學通報),2004,39(9):1l-13.
4 Gomar J,Petit MC,Sodano P,et al.Solution structure and lipid binding of a nonspecific lipid transfer protein extracted from maize seeds.Protein Sci,1996,5:565-577.
5 Samuel D,Liu YJ,Cheng CS,et al.Solution structure of plant nonspecific lipid transfer protein-2 from rice(Oryzasativa).J Biol Chem,2002,277:35267-35273.
6 Garcia-Olmedo F,Molina A,Segura A,et al.The defensive role of nonspecific lipid-transfer proteins in plants.Trends Microbiol,1995,3:72-74.
7 Sterk P,Booij H,Schellekens GA,et al.Cell-specific expression of the carrot EP2 lipid transfer protein gene.Plant Cell,1991,3:907-921.
8 Thoma S,Hecht U,Kippers A,et al.Tissue-specific expression of a gene encoding a cell wall-localized lipid transfer protein from Arabidopsis.Plant Physiol,1994,105:35-45.
9 Lin P,Xia LX,Wong JH.et al.Lipid transfer proteins from Brassica campestres and mung bean surpass mung bean chitinase in exploitability.Pept Sci,2007,13:642-648.
10 Ooi LS,Tian L,Su M,et al.Isolation,characterization,molecular cloning and modeling of anew lipid transfer protein with antiviraland antiproliferative activities from Narcissus tazetta.Peptides,2008,29:2101-2109.
11 Committee of Drug Standard of Ministry of Public Health of the Peoples Republic of China.Drug Standard of Ministry of Public Health of the Peoples Republic of China of Uygur volume(中華人民共和國衛生部藥品標準維吾爾分冊).U-rumchi:Xinjiang Science and Technology Publishing House,1998.80.
12 Cheng XM(程雪梅),Liu J(劉軍),Wang CH(王長虹).et al.Dynamic content variation of alkaloids in different parts of Peganum harmala L..Acta Univ Tradit Med Sin Pharm Shanghai(上海中醫藥大學學報),2007,21:69-71.
13 Chen Q,Chao R,Chen H,et al.Antitumor and neurotoxic effects of novel harmine derivatives and structure activity relationship analysis.Int J Cancer,2005,114:675-682.
14 Ning XF(寧雪飛),Chen LL(陳亮亮),Tang HS(唐海淑).Distribution,extraction and activities of the proteins from Peganum harmala L..Nat Prod Res Dev(天然產物研究與開發),2009,21:800-805.
15 Luo JJ(羅晶晶),Ma XJ(馬曉瑾),Ying XL(殷曉麗),et al.Study on the antitumor activity of protein extracts of Peganum harmala seeds in vitro.Biotechnology(生物技術),2010,20:32-34.
16 Zhang QH(張謙益),Wu HH(吳洪華).Analysis of beef zymolyte by Tricine-SDS-PAGE.Meat Ind(肉類工業),2006,30(7):21-22.
17 Yao Q,Wu CF,Luo P,et al.A new chitin-binding lectin from rhizome of Setcreasea purpurea with antifungal,antiviral and apoptosis-inducing activities.Process Biochem,2010,45: 1477-1485
18 Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays.J Immunol Methods,1983,65:55-63.
19 Wang XH(王曉紅),Fu LW(符立梧).Anticancer activity of a novel pyrazolone derivative and its mechanism.Sun Yat-Sen University(中山大學)PhD.2007.
20 Wang H(汪紅),Wang Q(王強),Yu GJ(余國奠).et al.Research progress of traditional Chinese medicine with antitumour activity.Chin Wild Plant Resour(中國野生植物資源),1999,1(3):7-10.
21 Han YY(韓玉英),Feng P(豐平),Wen ZY(文朝陽).Research progress of Chinese herbal medicine with Anticancer activity.Beijing J Tradit Chin Med(北京中醫藥雜志),2003,22(2):45.
22 Ooi LS,Wong EY,Sun SS,et al.Purification and characterization of non-specific lipid transfer proteins from the leaves of Pandanus amaryllifolius(Pandanaceae).Peptides,2006,27:626-632.
23 Lin P,Xia L,Ng TB.First isolation of an antifungal lipid transfer peptide from seeds of a Brassica species.Peptides,2007,28:1514-1519.
24 Tian AM(田愛梅),Cao JS(曹家樹).The plant non-speci? c lipid transfer proteins.Chin J Cell Biol(細胞生物學雜志),2008,30:483-488.

