E-鈣粘蛋白在胚胎停育患者絨毛和蛻膜中的差異性表達*
第四軍醫大學唐都醫院(西安710038) 李三陽 李 怡 苗 卓 張 哲 尹國武
胚胎停育是指妊娠早期胚胎發育自然終止、胚胎丟失的病理過程,其妊娠結局常常為稽留流產和不全流產[1]。近年來胚胎停育患者有增加趨勢,有研究表明滋養細胞增殖不良、浸潤異常可能是導致早期胚胎停育的原因之一[2]。E-鈣粘連蛋白(E-Cadherin,ECad)是一種鈣依賴粘附分子,廣泛表達于上皮細胞表面,其主要功能是介導特定組織或器官的同型細胞間粘附作用,維持上皮細胞層的完整性和極性,參與胚胎的發育及組織形成及細胞的轉移、侵蝕等活動,其表達水平的升高會導致細胞的遷移及浸潤能力下降,表達降低則會導致細胞遷移和浸潤能力增強[3]。研究發現E-Cad在滋養細胞中也有表達,可以影響滋養細胞的浸潤能力。我們應用熒光實時定量PCR(qRT-PCR)技術檢測胚胎停育患者絨毛和蛻膜中E-Cad mRNA水平的表達量,進一步研究E-Cad mRNA的表達水平和胚胎停育的關系。
對象與方法
1 研究對象 選自2010年4~12月間來我院婦產科門診就診的胚胎停育患者50例,臨床確診為胚胎停育(B超檢查宮腔內可見孕囊,未見胚芽或原始心管搏動)。所有對象均月經規律(月經周期28~32d),既往均無自然流產、死胎、死產史,無染色體、解剖、內分泌方面的異常以及感染、自身免疫性疾病史,且未采取任何藥物干預。選擇與胚胎停育組相同時期內到我院就診的孕期10周以內此次妊娠期間無先兆流產癥狀,B超證實胚胎發育一切正常,要求停止妊娠的正常婦女50例為正常對照組。兩組間年齡和孕周差異無統計學意義(P>0.05)。見表1。
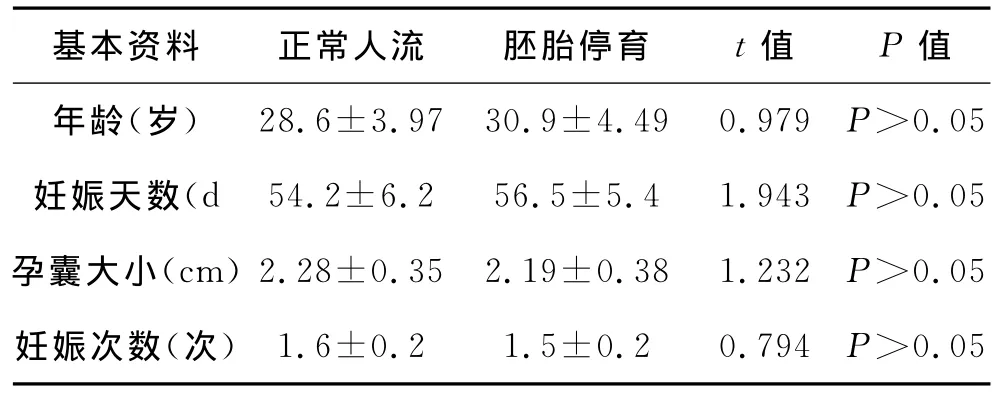
表1 絨毛和蛻膜標本詳細資料(n=50)
2 實驗方法 ①器械的準備:彎盤、鑷子等耐高溫物品180℃6h,消除RNA酶,凍存管,槍頭用0.1%DEPC水浸泡過夜,高壓蒸汽滅菌,烤干備用。②絨毛和蛻膜標本的采集:兩組患者于人流術后將吸出的組織倒入已消毒的彎盤中,用無菌生理鹽水反復漂洗絨毛和蛻膜組織,用無菌紗布吸干表面的水分放入事先準備好的凍存管中,標記好放入液氮,-80℃保存備用。③組織RNA的提取及反轉錄:組織RNA的提取按照RNA Plus(大連寶生)逆轉錄TAKARA(大連寶生)的試劑說明書進行操作。④熒光實時定量PCR(qRT-PCR):qRT-PCR 以 GAPDH 為內參照基因進行PCR擴增,每例樣品均設4個平行重復孔。引物序列見表2(引物有北京奧科合成)。
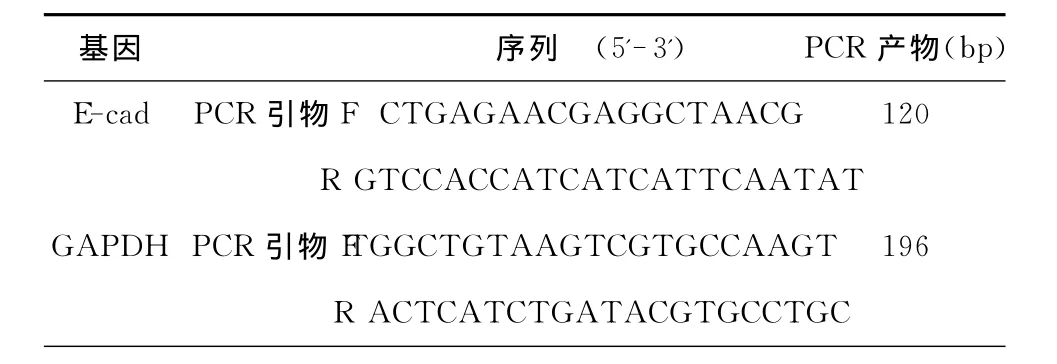
表2 qRT-PCR引物序列表
3 統計學方法 采用SPSS14.0統計軟件進行統計分析,數值均以±s表示,兩組間計量資料的比較采用t檢驗。
結 果
1 qRT-PCR結果 應用紫外分光光度計測定RNA在260nm及280nm的吸光值。OD值均在1.8~2.0之間,表明RNA的質量良好。在絨毛標本中,E-Cad mRNA在實驗組表達量高于對照組(t=29.24,P<0.05)。(見表3)。在蛻膜標本中,E-Cad mRNA在實驗組表達量高于對照組(t=19.76,P<0.05)。(見表4)。
2 qRT-PCR結果的驗證 qRT-PCR結果可能存在假陽性,我們對qRT-PCR產物用2%的瓊脂糖凝膠電泳,結果顯示E-cad在120bp,GAPDH在196bp處,目的條帶在預期條帶處。(胚胎停育患者與正常人流者絨毛和蛻膜qRT-PCR結果的驗證分別見附圖)。
表3 E-Cad在實驗組和對照組絨毛中的表達(±s)

表3 E-Cad在實驗組和對照組絨毛中的表達(±s)
注:與對照組相比*P<0.05
組 別 n E-Cad/GAPDH實驗組 50 0.875±0.07*對照組 50 0.337±0.11
表4 E-Cad在實驗組和對照組蛻膜中的表達(±s)
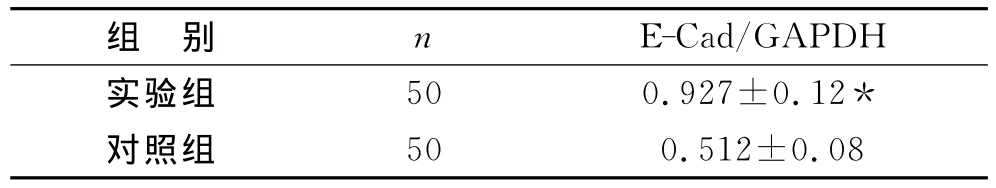
表4 E-Cad在實驗組和對照組蛻膜中的表達(±s)
注:與對照組相比*P<0.05
組 別 n E-Cad/GAPDH實驗組 50 0.927±0.12*對照組 50 0.512±0.08
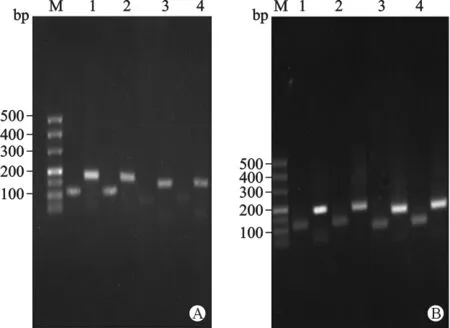
附圖 絨毛及蛻膜中qRT-RCP結果后驗證
討 論
人類的成功妊娠,需要來自胚胎的絨毛外滋養層細胞發揮類似腫瘤細胞浸潤的特性。正常妊娠胎盤的發育過程中一部分早期滋養細胞浸潤子宮蛻膜,分化成為具有侵蝕力的細胞表型,其深度可達子宮肌層內的1/3。妊娠早期,細胞滋養細胞(CTB)在胚泡植入子宮壁后即分化為絨毛滋養細胞和絨毛外滋養細胞(EVT)。其中EVT是具有浸潤能力的滋養細胞,其浸潤能力在滋養細胞正常侵入子宮肌層的過程中發揮重要作用[4]。因此,早期妊娠過程中滋養細胞對子宮肌層的適度浸潤是妊娠成功的關鍵。
絨毛主要由滋養細胞分化而來,其主要成分為絨毛外滋養細胞,具有浸潤功能。滋養細胞分化與浸潤能力決定胎盤能否正常發育。E-Cad是鈣依賴型細胞粘連糖蛋白,廣泛表達于上皮細胞表面,介導同種細胞間的黏附作用,并連接細胞內骨架,影響細胞的分化與浸潤能力。E-Cad介導的粘附系統是已被公認的“浸潤抑制系統”,有研究表明E-Cad的表達與滋養細胞的分化浸潤有一定的關系[5],妊娠早期任何部位的細胞滋養細胞(CTB)表面均有E-Cad的粘附與表達,有利于胚泡的粘附和植入[6]。近來研究表明,E-Cad等粘附分子參與母胎界面微環境的構成,在胚胎著床和生長發育過程中均發揮著重要作用[4]。隨著妊娠的進展,E-Cad在絨毛各部位的表達逐漸下降,這有利于滋養細胞的侵入,保證母胎之間正常生理功能的運行,封閉E-Cad可顯著提高滋養細胞的浸潤行為[7]。本研究發現胚胎停育絨毛中E-Cad在mRNA水平的表達低于正常人流者,研究結果與黃敬明相符。黃敬華等[8]用免疫組化的方法研究表明E-Cad在胚胎停育絨毛細胞滋養細胞表面表達增加。Shih等[9]研究發現升高E-Cad的表達水平后,發現滋養細胞的轉移和侵蝕能力下降。E-Cad的表達水平可以有效的反應滋養細胞的浸潤能力,表達水平過高則引起滋養細胞侵蝕能力不足,導致自然流產[10]。因此我們推測E-Cad在胚胎停育患者絨毛中的高表達引起滋養細胞浸潤能力下降,無法有效完成血管重鑄,造成胎盤淺著床,從而導致自然流產等妊娠結局。
蛻膜組織是子宮內膜間質受蛻膜化誘導因子刺激而增殖和再分化形成的一種特殊組織,子宮內膜的蛻膜和蛻膜功能的正常表達,對胚胎著床、妊娠建立與維持,以及分娩發動均起著極為重要的作用。E-Cad即為子宮內膜細胞表達的一種粘附分子,在鈣離子存在的條件下,通過胞外區結構域之間的相互作用介導細胞與細胞的粘附。本研究用qRT-PCR技術發現在胚胎停育蛻膜中E-Cad在mRNA水平的表達高于正常人流組。劉蕓等[11]證明在增殖期到分泌期,子宮內膜腺上皮細胞表達E-Cad逐漸增加,分泌晚期及蛻膜期表達降低,揭示E-Cad與胚泡的植入有密切關系。當滋養細胞需要進一步與子宮內膜相容時,如在分泌晚期和早孕期,上皮細胞表達E-Cad降低,使得細胞相互粘附力降低,有利于滋養細胞的侵入。結合本組實驗結果,推測E-Cad在組織蛻膜組織中的表達增高可能影響胚胎的著床、妊娠建立與維持,導致胚胎停育等妊娠結局。
胚胎的成功著床取決于絨毛滋養細胞的侵入性和子宮內膜的容受性[12]。E-Cad在胚胎停育患者絨毛中的高表達引起滋養細胞浸潤能力下降,無法有效完成血管重鑄,造成胎盤淺著床,可能導致自然流產等妊娠結局。E-cad在蛻膜組織中的高表達可能影響滋養細胞與子宮內膜的容受性,進而影響胚胎的著床、妊娠建立與維持,導致自然流產等妊娠結局。因此,E-Cad在絨毛和蛻膜中的高表達可能通過上述機制影響胚胎發育導致自然流產,本研究可能為胚胎停育的機制提供新的診斷思路。
[1] Kroon B,Harrison K,Martin N,et al.Miscarriage karyotype and its relationship with maternal body mass index,age and mode of conception[J].Fertil Steril,2011,95(5):1827-1829.
[2] Campbell S,Rowe J,Jackson CJ,et al.In vitro migration of cytotrophoblasts through a decidual endothelial cell monolayer:the role of matrix etalloproteinases[J].Placenta,2003,24:306-315.
[3] Stemmler MP.Cadherins in development and cancer[J].Mol Biosyst,2008,4(8):835-850.
[4] Bruni L,Ferretti C,Dangles-Marie V,et al.Changes in the maternal serum ncentration of proearly placenta insulin like growth factor peptide in normal vs abnormal pregnancy[J].Am J Obstet Gynecol,2007,197(6):el-e4.
[5] Red-Horse K,Zhou Y,Genbacev 0,et al.Trophoblast differentiation during embryo implantation and formation of the maternal-fetal interface[J].J Clin Invest,2004,114(6):744-754.
[6] Rabnama F,Shafiei F,Gluckman PD,et al.Epigenetic regulation of human trophoblastic cell migration and invasion[J].Endocrinolog,2006,147(11):5275-5283.
[7] Zhou Y,Fisher SJ,Janatpour M,et al.Human cytotrophoblasts adopt a vascular phenotype as they differentiate:a strategy for successful endovascular invasion[J].Clin Invest,1997,99:2139-215.
[8] 黃敬華,李紅發.早期自然流產患者母胎界面E-鈣粘素與B-連環素的異常表達[J].中國優生與遺傳雜志,2008,16(9):64-66.
[9] Shih IM,Hsu MY,Oldt RJ,et al.The Role of E-cadherin in the Motility and Invasion of Implantation Site Intermediate trophoblast[J].Placenta,2002,23 (10):706-7151.
[10] Revel A,Ophir I,Koler M,et al.Changing etiology of tubal pregnancy following IVF [J].Hum Reprod,2008,23(6):1372-1376.
[11] 劉 蕓,陳世嶺,邢福棋,等.鈣粘附蛋白在子宮內膜及蛻膜的表達[J].福州總醫院學報,2002,9(2):87-89.
[12] Kalluri R,Weinberg RA.The basics of epithelial-mesenchymal transition[J].ClinInvest,2009,119 (6):1420-1428.

