鏈霉菌的抗砷特性及其對蜈蚣草富集砷的作用
文一,廖曉勇,閻秀蘭
1.中國科學院地理科學與資源研究所 場地污染評估與修復中關村開放實驗室,北京100101
2.環境保護部環境規劃院,北京100012
砷是一種廣泛存在于環境中的類金屬元素,可導致人體患皮膚癌、肺癌以及糖尿病、皮膚病、神經和心血管類等非癌癥疾病[1]。砷污染已影響全世界數百萬人的健康,成為全球關注的環境問題[2]。世界上有19 個國家和地區爆發過嚴重的砷污染危害事件,中國是遭受砷毒害最為嚴重的國家之一,已發生的砷中毒涉及到全國8 個省和37 個縣[3]。砷污染治理是國際上面臨的亟待解決的重要環境課題,在我國的《重金屬污染綜合防治“十二五”規劃》中已將砷作為重點防治對象。
傳統的砷污染土壤治理方法包括填埋法、固化/穩定化、化學淋濾等方法,近年來基于超富集植物蜈蚣草(Pteris vittata L.)的砷污染土壤植物修復技術被認為是應用前景廣闊、修復成本低、且二次風險少的方法[4]。蜈蚣草的砷累積量可占總生物干質量的2.3%[5],能提取土壤中不同形態的砷(非專性吸附態、專性結合態、無定型水合氧化態、結晶水合氧化態以及殘渣態砷),其中對無定型水合氧化態砷的提取可占提取總砷的67%~77%[6]。
借用強化手段,進一步提升蜈蚣草富集砷的能力是近期國內外研究的重點。微生物可通過自身或其代謝產物促進植物根系發育、增加生物量,提高植物對不同環境壓力的耐受力,改變土壤中重金屬的形態,增加重金屬的生物可利用性,來強化植物的修復效率[7]。例如,接種細菌后,能增加植物生長促生長素及1-氨基環丙烷-1-羧酸(ACC)脫氨酶的生成,促進油菜對砷、銅、鎳的吸收[8];細菌還能通過促進植物根系發育,增加生長素(IAA)、鐵運載體的分泌,促進芥菜對鉻、鋅及鉛的吸收[9]。本文以從高砷土壤中生長的的蜈蚣草根際土壤中篩選出菌株——鏈霉菌(Streptomyces sp.)作為供試微生物,研究其抗砷性能及其對蜈蚣草富集砷的作用,從菌株對根際環境影響的角度探討其對砷在土壤-超富集植物根際系統中轉運的影響。
1 材料與方法(Materials and methods)
1.1 實驗材料
1.1.1 供試盆栽土
取自湖南郴州鄧家塘砷污染土壤(北緯24°53'~26°50',東經112°50'~114°14',海拔344 m),其基本理化性質為:pH 值為7.34,有機質含量為18.4 g·kg-1,陽離子交換量(CEC)為26 cmol·kg-1,總砷含量為115.74 mg·kg-1,全磷為22.95 g·kg-1,全氮為1.61 g·kg-1。土壤為細砂土,砂粒體積分數為59.9%,粉粒為24.7%,粘粒為15.4%。供試土壤室內自然風干,磨碎,過2 mm 篩,混勻,備用。
1.1.2 供試植物
蜈蚣草為湖南郴州無砷污染土壤的野生植株,選擇株高5 ~10 cm、4 ~5 片羽葉、根莖大小一致的植株。每盆移栽1 株蜈蚣草。溫室溫度控制在22℃~25℃之間,室內相對濕度控制在75%~80%。
1.1.3 供試菌株及菌液制備
供試菌種篩選自砷含量為90 ~300 mg·kg-1污染土壤中的土著鏈霉菌(Streptomyces sp.),經鑒定其含有參與砷還原轉化的arsC 基因。利用胰蛋白胨大豆肉湯培養基(TSB)培養基,在30℃、220 r·min-1下振蕩培養36 h,制備發酵液。在4℃、6 000 r·min-1下離心10 min,棄去上清液,沉淀用無菌去離子水清洗2 次。用無菌去離子水配制成菌懸液。將Streptomyces sp.菌液的濃度調整為3×106cfu·mL-1,取800 mL 的發菌液在高壓滅菌鍋中于121℃、15 min 下處理制成滅活菌液。
1.1.4 試劑
砷酸鈉(Na3AsO4·12H2O)等化學試劑為國產分析純試劑。TSB 培養基購自美國BD 公司。
1.2 實驗方法
(1)菌株抗砷性能的測定:取在600 nm 吸光值為0.8 的菌液1 mL,接種于含100 mL TSB 培養基的500 mL 三角錐形瓶中,24 h 后,在菌液中加入不同濃度的砷酸鈉(用無菌水配置,并過無菌濾膜,保證無菌),配制成含0、20、40、60、80 和100 mmol·L-1砷酸鈉的發酵液。在30℃、220 r·min-1下水浴振蕩培養。24 h 后,收獲菌液,4℃、7 000 r·min-1下離心,用蒸餾水洗滌2 次,在80℃烘至恒重,稱取菌絲質量。每個處理3 個重復。
(2)菌株砷還原能力的測定:取在600 nm 吸光值為0.8 的菌液1 mL,接種于含100 mL TSB 培養基的500 mL 三角錐形瓶中,培養24 h 后加入砷酸鈉(用無菌水配置,并過無菌濾膜,保證無菌),配制成75 mg·L-1的砷酸鈉發酵液,用含相同砷酸鹽濃度的滅活菌液作為對照。每隔6 h,從活性菌液和對照組菌液中各取出4 mL,7 000 r·min-1下離心,測定上清液中As(Ⅲ)和As(Ⅴ)的含量。每個處理3 個重復。
(3)盆栽實驗共設4 個處理,分別是不添加菌的空白對照處理組(CK)、不添加菌但種植蜈蚣草的植物對照處理組(CK+P)、Streptomyces sp.菌液處理組(S)、施加Streptomyces sp.菌液并種植蜈蚣草處理(S+P),每個處理設4 個重復。蜈蚣草移栽7 d 確保成活后,在CK、CK+P 處理組中施入100 mL 滅活菌液,在S 和S+P 處理組中施入100 mL 活性菌液,菌液采用針頭,通過根際灌注和表層噴灑的方式施加,添加后適當翻動表層土壤,使菌液在表層土壤(0 ~10 cm)混合均勻。60 d 時收獲植物和土壤,利用晃動根部,獲得非粘附的土壤,作為非根際土。用軟毛刷刷下粘附在根際的土壤作為根際土。土壤樣品分成3 份,一份在室內自然風干,用于測定總砷、砷結合態;一份保存在4℃,用于測定可溶性有機碳(DOC);一份保存在-80℃,用于測定砷形態。植物先用自來水沖洗干凈,然后用去離子水洗滌3 遍。植株上的水珠用濾紙吸干,稱取植物生物質量,將植物分為地上部、地下部在烘箱烘干,用于總砷測定。
1.3 檢測方法
采用硝酸-雙氧水消煮土壤樣品,硝酸-高氯酸消煮植物樣品,用原子熒光分光光度計測定總砷含量[10]。用的磷酸抗壞血酸提取土壤中砷[11],用1∶1 甲醇水提取植物樣品中的砷[12],用液相色譜-原子熒光光譜聯用(LC-AFS)測定砷形態。土壤砷結合態分析采用武斌等分級方法連續提取[13]。定量稱取10 g 土壤,置于150 mL 三角瓶中,加入50 mL 超純水;連續振蕩2 h,3 500×g 下離心15 min,過0.45 μm水系濾膜;取10 mL 水樣,利用TOC 分析儀測定[14]。選用水土比1∶2,混勻后放置15 min,利用pH 計測定。
1.4 數據處理
所獲數據利用Excel 和SPSS13.0 軟件進行統計分析及差異顯著性檢驗。
2 結果(Results)
2.1 Streptomyces sp.的抗砷及還原砷能力
由圖1 可見,當砷酸鹽濃度從0 增加到40 mmol·L-1時,Streptomyces sp.的菌絲干質量隨砷酸鹽濃度的增加大幅度下降,但隨著砷酸鹽濃度的進一步升高(40 ~100 mmol·L-1),菌絲的干質量變化不大,由此可見,雖然砷能抑制Streptomyces sp.的正常生長,但該菌仍表現出極強的耐砷能力。
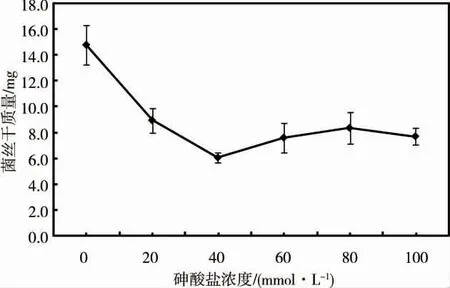
圖1 不同濃度砷酸鹽中Streptomyces sp.的生長情況Fig.1 Growth of Streptomyces sp.in different concentrations of arsenate
在有氧條件下,Streptomyces sp.能有效地將As(V)還原為As(III),在培養48 h 后,活性菌液處理組中的As(III)濃度達到60.08 mg·L-1,還原率達到96.5%。48 h 后As(III)的濃度變化漸趨平緩。微生物失活的對照組培養液中未檢測出As(III),該結果表明As(V)還原主要是菌劑Streptomyces sp.的作用(圖2)。
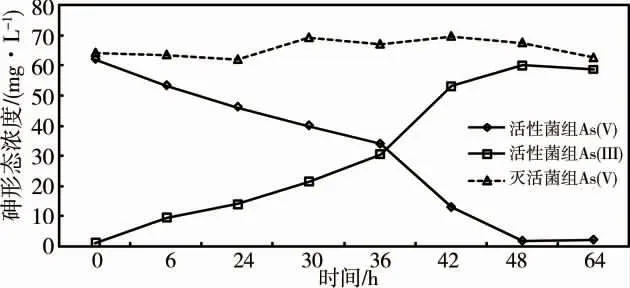
圖2 Streptomyces sp.對砷酸鹽的還原能力Fig.2 Arsenate reduction ability of Streptomyces sp.
2.2 Streptomyces sp.對蜈蚣草生長的影響
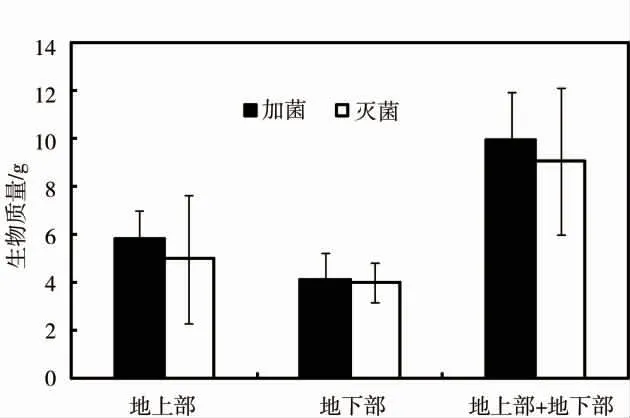
圖3 Streptomyces sp.對蜈蚣草生長的影響Fig.3 Effect of Streptomyces sp.on growth of P.vittata
施用Streptomyces sp.對蜈蚣草生長的影響見圖3。施加Streptomyces sp.的處理組中蜈蚣草地上、地下部分質量和生物總質量均高于施用滅菌處理的對照組,分別升高了16.91%、2.84%和10.04%。但統計結果無顯著性差異。
2.3 添加Streptomyces sp.對蜈蚣草砷富集的影響
施加Streptomyces sp.對蜈蚣草砷吸收的影響見圖4A。添加Streptomyces sp.處理組蜈蚣草的地上部砷含量為930 mg·kg-1,顯著高于對照組(CK+P)的地上部砷含量(P <0.05),為對照組的1.76 倍。添加Streptomyces sp.的處理組中蜈蚣草的轉運系數為2.22,是對照組的2.05 倍,表明添加Streptomyces sp.能顯著提高蜈蚣草地上部對砷的吸收,促進蜈蚣草對砷從地下到地上部的轉運。施用Streptomyces sp.處理后,蜈蚣草地下部砷濃度比對照組低14.41%,但未達顯著性差異。添加Streptomyces sp.后對蜈蚣草砷累積的影響見圖4B。與對照組相比,施用菌劑Streptomyces sp.能顯著提高蜈蚣草地上部砷累積量(P <0.05),蜈蚣草地上部累積量是對照組的2.09 倍。施菌處理后,由于地下部生物量以及施菌對砷轉運的影響,Streptomyces sp.地下部砷累積量較對照組降低了38.19%,差異顯著(P <0.05)。以上結果表明,供試微生物Streptomyces sp.能強化蜈蚣草提取土壤砷,促進砷從蜈蚣草地下部向地上部轉運,它可以作為強化植物砷修復的微生物材料。
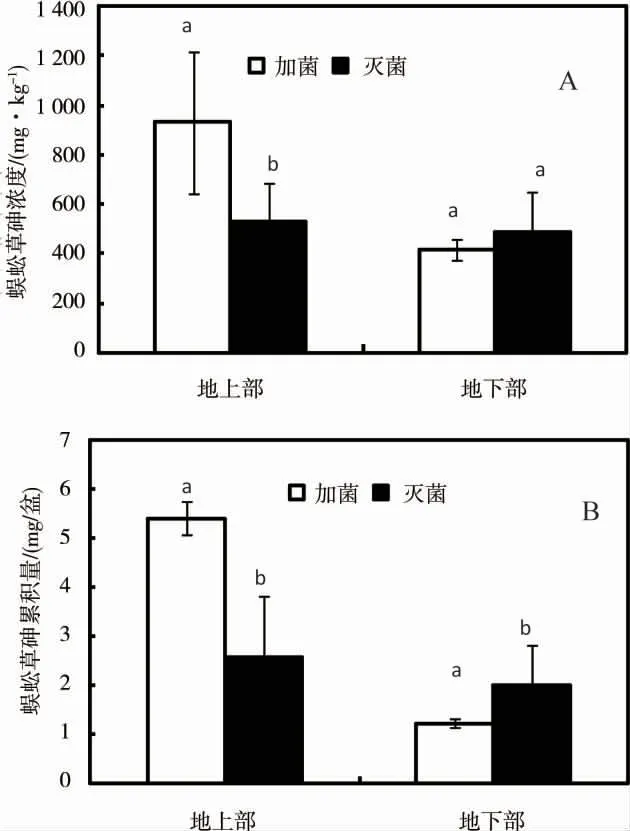
圖4 Streptomyces sp.菌對蜈蚣草砷累積的影響注:A,蜈蚣草砷濃度;B,蜈蚣草砷累積量。Fig.4 Effect of Streptomyces sp.on As accumulation of P.vittata
2.4 Streptomyces sp.對土壤總砷含量的影響
添加抗砷菌Streptomyces sp.后,蜈蚣草根際土壤的總砷濃度較其他各組均有顯著下降(P <0.05)。與不種植物的對照組(CK)及菌土(S)組相比,分別降低了32.93%和33.99%;與對照組(CK+P)根際土壤相比,下降了22.06%。由于蜈蚣草對砷的超富集作用,CK+P 組的根際土壤砷含量與CK 和S 組比較,表現為顯著降低(P <0.05),分別降低了18.93% 和18.06%,其砷含量下降量低于施加Streptomyces sp.菌處理(S+P)的蜈蚣草根際土壤。將蜈蚣草和微生物作為影響土壤總砷含量變化的因素,對根際土壤進行考慮交互作用的雙因素方差分析,分析表明:施用Streptomyces sp.和種植蜈蚣草對土壤總砷含量的影響無明顯的交互作用(F=1.80,P=0.21)。由表1 可見,Streptomyces sp.能有效增強蜈蚣草對根際土壤砷的去除能力,但在本實驗條件下,Streptomyces sp.和蜈蚣草對于根際土壤砷去除能力未出現交互作用,表現為相加作用。
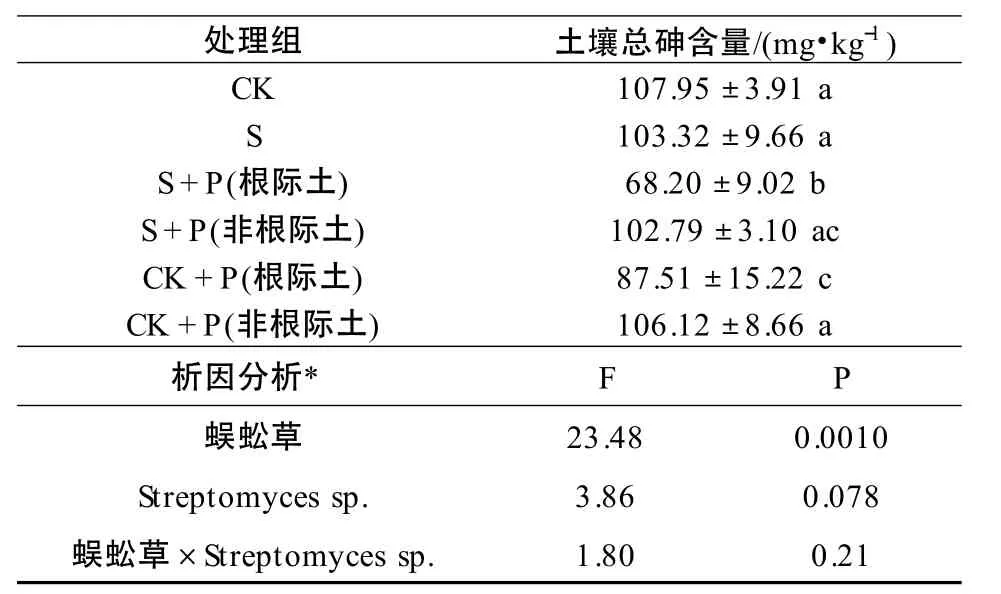
表1 Streptomyces sp.對土壤中砷濃度的影響Table 1 Effect of Streptomyces sp.on As concentration in soil
2.5 Streptomyces sp.對土壤中砷形態及價態的影響
添加Streptomyces sp.各處理組土壤砷形態結果見表2。各處理組中的土壤均能檢測到As(Ⅴ)和As(Ⅲ),其中以As(Ⅴ)為主,占土壤總砷的86.30%~99.43%,As(Ⅲ)中占土壤總砷的0.56% ~8.15%,S 組及S+P 組土壤中As(Ⅲ)濃度較高。由表2 可知,Streptomyces sp.菌土組(S 組)中的As(Ⅲ)濃度是CK 組的2.03 倍,具有顯著性差異(P <0.05),表明Streptomyces sp.在盆栽條下能促進土壤中As(Ⅴ)的還原。施加Streptomyces sp.后,蜈蚣草根際土壤的As(Ⅲ)濃度顯著高于其他處理組(P <0.05),是CK 的7.23 倍,是CK+P 組根際土壤的5.33 倍。將蜈蚣草和微生物作為影響土壤As(Ⅲ)變化的因素,對根際土壤進行考慮交互作用的雙因素方差分析,蜈蚣草和Streptomyces sp.對根際土壤中As(Ⅲ)具有顯著交互作用(P <0.05),能顯著增加根際土壤中的As(Ⅲ)濃度。以上結果表明,加入Streptomyces sp.菌后,能促進根際土壤中As(Ⅴ)還原成As(Ⅲ),Streptomyces sp.和蜈蚣草對于這一過程具有協同作用。
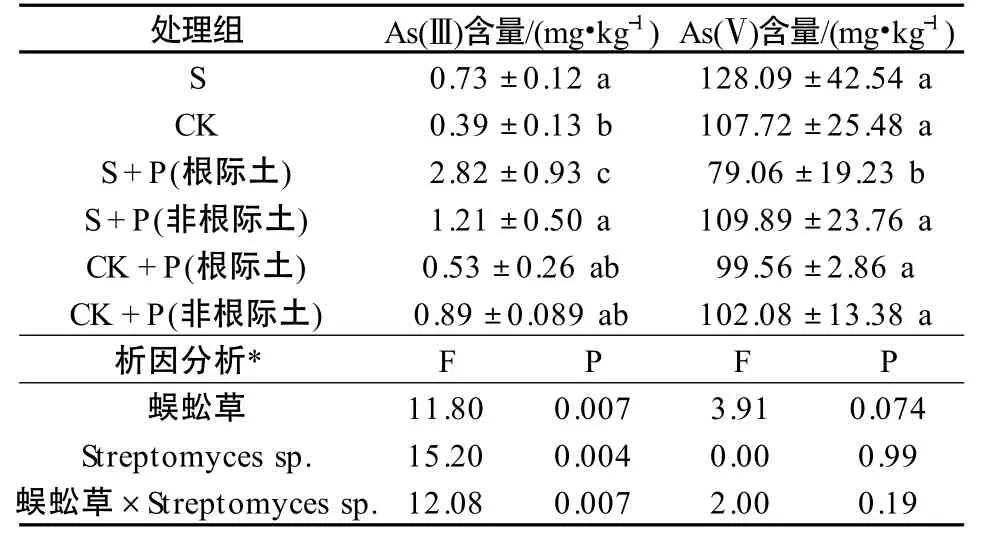
表2 Streptomyces sp.對土壤中砷價態的影響Table 2 Effect of Streptomyces sp.on As speciation in soil
Streptomyces sp.對土壤砷結合形態的影響見表3,添加Streptomyces sp.菌液的土壤的殘渣態砷(O-As)顯著低于CK,下降了24.49%(P <0.05),表明抗砷菌Streptomyces sp.在土壤中可促進土壤中生物有效性最低的殘渣態砷的轉化。與CK 比較,S+P 處理組根際土壤松散態結合砷(L-As)、鋁結合態砷(Al-As)、鐵結合態砷(Fe-As)和殘渣態砷(O-As)等4 種砷形態的含量均顯著降低(P <0.05),分別下降了86.16%、67.79%、49.48%和40.29%,其中OAs 從48.15 mg·kg-1下降至28.75 mg·kg-1,占S+P處理組根際土壤總砷含量下降的49.74%。與CK+P 相比,S+P 處理組的蜈蚣草根際土壤的Al-As、Fe-As 和O-As 含量均顯著降低(P <0.05),分別下降了50.82%、38.39%和45.64%。這說明,抗砷菌Streptomyces sp.能通過增強蜈蚣草對根際土壤的Al-As、Fe-As 以及O-As 等生物有效性低的砷形態的吸收利用,提高蜈蚣草對根際土壤砷的提取作用。
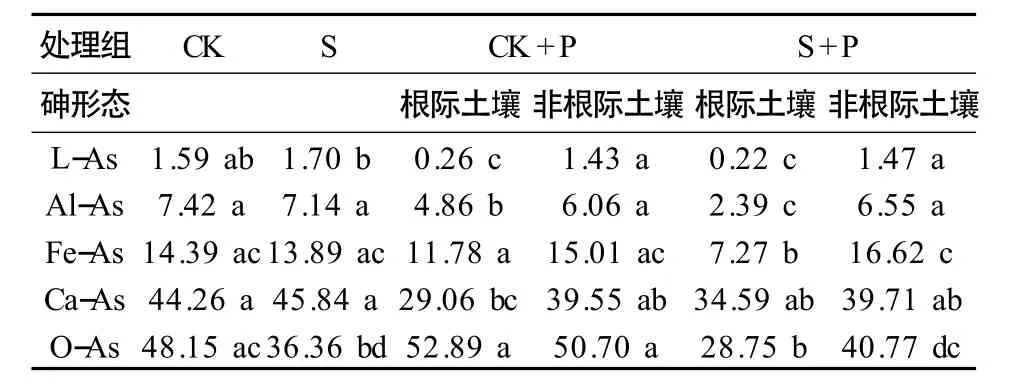
表3 Streptomyces sp.對土壤砷結合形態的影響Table 3 Effect of Streptomyces sp.on As fractions in soil(mg·kg-1)
2.6 Streptomyces sp.對土壤中根際環境的影響
圖5 為施加Streptomyces sp.處理后蜈蚣草根際和非根際水溶液中的pH 值。結果表明,非根際土壤溶液的pH 值為7.83 ~7.85,根際土壤溶液pH值為8.30 ~8.32,均呈弱堿性。CK+P 和S+P 處理組的蜈蚣草根際土壤均高于非根際土壤的pH值,可增加至0.47 個單位。施加Streptomyces sp.后根際和非根際土壤均比施加滅活菌液處理組的pH值增加了0.02 個單位。這表明施加Streptomyces sp.可影響土壤pH 值,從而引起根際環境的變化。
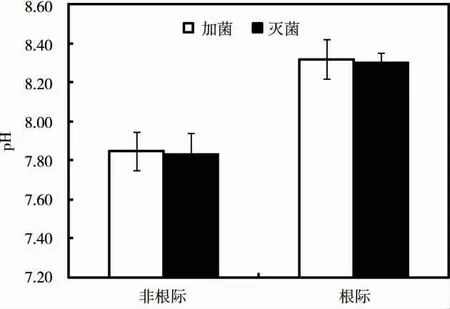
圖5 Streptomyces sp.對根際pH 值的影響Fig.5 Effect of Streptomyces sp.on pH in rhizosphere soil
添加Streptomyces sp.對蜈蚣草土壤中DOC 的影響見表4。S+P 處理組的根際土壤中DOC 的含量高于其他各組,與CK+P 根際土壤相比,增加18.10%,但未達顯著性差異(P >0.05);較S 和CK 組分別增加27.91%和83.70%,具有顯著性差異(P <0.05)。CK+P 組由于植物根際分泌物的作用,其根際DOC 的含量仍然高于S 和CK 處理組,但增加量較S+P 組的根際土壤低,分別增加8.34%和54.46%。對根際土壤DOC 含量進行交互作用分析,結果表明:蜈蚣草和Streptomyces sp.共同作用對根際土壤DOC 濃度不存在交互作用,聯合作用呈相加作用。
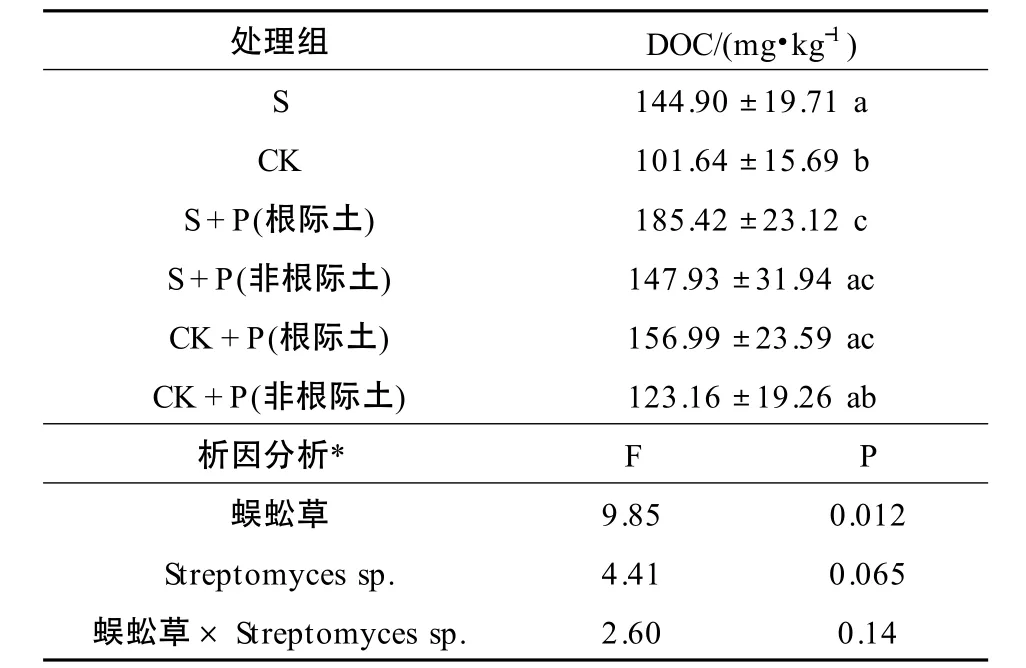
表4 Streptomyces sp.對土壤中DOC 的影響Table 4 Effect of Streptomyces sp.on DOC in soil(mg·kg-1)
3 討論(Discussion)
植物修復技術被認為是治理土壤砷污染最經濟有效的途徑之一[15],然而植物修復砷的效率常受到植物生長速度和生物量、砷含量及砷的生物有效性等因素限制。筆者近年來一直探索利用微生物強化植物修復砷污染土壤,本研究結果表明,在蜈蚣草中添加抗砷微生物Streptomyces sp.后,蜈蚣草地上部砷濃度比同期對照組高75.52%,蜈蚣草總砷累積量比同期對照高45.07%,應用Streptomyces sp.能有效強化蜈蚣草對砷的吸收與富集,從而提高蜈蚣草修復砷污染土壤的效率。Ghosh 等[16]從蜈蚣草根際土壤中分離假單胞菌、叢毛單胞菌和寡養單胞菌等抗砷菌株,水培實驗結果表明,菌株能有效促進蜈蚣草的生長,增加蜈蚣草砷含量,可達對照組的1.96 倍。曾東等[17]從湖南某砷污染地區蜈蚣草根系及根系新鮮土中篩選出11 組抗砷菌,盆栽實驗結果表明,抗砷菌在一定程度上能夠刺激蜈蚣草的生長,提高蜈蚣草的生物量,促進砷由蜈蚣草的地下部向地上部轉運。Liu 等[18]發現在蜈蚣草根部中接種叢枝菌根真菌可以增加蜈蚣草生物量,促進蜈蚣草砷吸收。課題組前期研究發現,在蜈蚣草中加入Streptomyces sp.可促進蜈蚣草生物量呈顯著增加[10],本實驗中施用含有參與砷還原轉化的arsC 基因抗砷菌Streptomyces sp.后也能促進蜈蚣草的生長,其較對照組高出10.04%。微生物通過促進植物生長,提高植物生物總量,從而增加植物對砷的積累,這是微生物提高植物修復效率的重要途徑之一。
土壤中砷主要以As(Ⅴ)為主,As(Ⅴ)通過化學吸附和(或)表面沉淀作用在土壤及粘土礦物上吸附,其移動性和生物活性都低于As(Ⅲ)[19]。已有研究表明,環境中的異化砷還原微生物可將吸附在礦物或沉積物上的As(Ⅴ)還原為具移動性和毒性更強的As(Ⅲ),將砷從固相釋放到液相中[20]。Yamamura 等[21]將異化砷還原菌添加到含砷的土壤中,發現其可將土壤中As(Ⅴ)轉化為移動性更強的As(Ⅲ),他認為,該種微生物為促進植物砷吸收提供了可能。本實驗研究發現,施加抗砷菌Streptomyces sp.后,蜈蚣草根際土壤中As(III)含量較植物對照組提高了4.3 倍,并且根際土壤中Al-As、Fe-As 以及O-As含量均顯著降低,為蜈蚣草提供了更多的可利用態砷。根際環境是植物根系在生理過程下形成的不同于原土的,具有特殊物理、化學和生物學性質的動態微型生態系統,其根際環境中的pH 值、根系分泌物等直接影響重金屬的固定和活化狀態,從而影響到重金屬在土壤-植物過程中的遷移轉化行為[22]。土壤pH 值變化受根系分泌物的種類與數量、微生物數量或活性影響,是影響土壤中砷吸附的重要因素。土壤pH 值影響砷的有效性,pH 值越高,土壤中的鐵、鋁氧化物易帶負電荷,有利于土壤砷的溶出,土壤有效態砷含量增加[23]。Fitz 等[24]根據已有的植物根際研究結果,推測了砷在根際中的可能變化,他認為,根際pH 值升高會造成As(Ⅴ)可溶性增加,反之則會降低。本研究結果證實了這一推測,添加抗砷菌Streptomyces sp.使蜈蚣草根際土壤的pH 值有所增加,根際As(III)含量增加,土壤中鐵、鋁結合態及殘渣態含量降低。
可溶性有機質是控制砷的遷移和轉換過程中的重要因素[25]。在有氧條件下,有機質含量可以促進微生物代謝,進一步影響砷的氧化還原作用,從而影響砷在土壤中的移動性及生物可利用性[26]。Balasoiu 等[27]報道了在鉻化砷酸銅(CCA)污染土壤中,隨著有機質含量增加,土壤中As(III)比例增加。本實驗結果表明:加入Streptomyces sp.后蜈蚣草根際DOC 含量較植物對照組增加18.10%,蜈蚣草根際As(III)較植物對照組顯著性增加。可溶性有機質可以通過競爭吸附作用減少砷在土壤表面的吸附,進而增加難溶態砷的轉化和增強砷的移動性[28]。Tu等[29]發現蜈蚣草在砷脅迫下分泌出大量的可溶解有機碳,可促進土壤中砷酸鐵(Fe-As)和砷酸鋁(Al-As)礦物溶解及砷的釋放。本研究中添加Streptomyces sp.后,隨著蜈蚣草根際DOC 含量增加,土壤中Al、Fe 結合態和殘渣態砷含量顯著降低,與Tu的研究結果一致。
綜上所述,抗砷微生物Streptomyces sp.可作為強化蜈蚣草砷修復的微生物材料,其表現出了較好的促植物砷吸收作用,Streptomyces sp.通過影響蜈蚣草根際環境,增加蜈蚣草根際土壤pH、DOC 含量促進砷形態變化,增加砷生物可利用性,從而促進蜈蚣草對砷的富集。
[1] Vahter M E.Interactions between arsenic-induced toxicity and nutrition in early life[J].The Journal of Nutrition,2007,137(12):2798-2804
[2] Nordstrom D K.Worldwide occurrences of arsenic in ground water[J].Science,2002,296(5576):2143-2145
[3] Sun G.Arsenic contamination and arsenicosis in China[J].Toxicology and Applied Pharmacology,2004,198(3):268-271
[4] 廖曉勇,陳同斌,謝華,等.磷肥對砷污染土壤的植物修復效率的影響:田間實例研究[J].環境科學學報,2004,24(3):455-462 Liao X Y,Chen T B,Xie H,et al.Effect of application of P fertilizer on efficiency of As removal from Ascontaminated soil using phytoremediation:Field study[J].Acta Scientiae Circumstantiae,2004,24(3):455-462(in Chinese)
[5] Ma L Q,Komar K M,Tu C,et al.A fern that hyperaccumulates arsenic[J].Nature,2001,409(6820):579
[6] Silva Gonzaga M I,Santos J A G,Ma L Q.Arsenic chemistry in the rhizosphere of Pteris vittata L.and Nephrolepis exaltata L.[J].Environmental Pollution,2006,143(2):254 -260
[7] Wu G,Kang H,Zhang X,et al.A critical review on the bio-removal of hazardous heavy metals from contaminated soils:Issues, progress, eco-environmental concerns and opportunities[J].Journal of Hazardous Materials,2010,174(1-3):1-8
[8] Khan M S,Zaidi A,Wani P A,et al.Role of Plant Growth Promoting Rhizobacteria in the Remediation of Metal Contaminated Soils:A Review[M]//Lichtfouse E.Organic Farming,Pest Control and Remediation of Soil Pollutants.New York:Springer,2010:1,319
[9] Glick B R.Using soil bacteria to facilitate phytoremediation[J].Biotechnology Advances,2010,28(3):367-374
[10] 趙根成,廖曉勇,閻秀蘭,等.微生物強化蜈蚣草累積土壤砷能力的研究[J].環境科學,2010,31(2):431-436 Zhao C G,Liao X Y,Yan X L,et al.Enhancement of As-accumulation by Pteris vittata L.affected by microorganisms[J].Environmental Science,2010,31(2):431-436(in Chinese)
[11] Garcia-Manyes S,Jiménez G,Padróc A,et al.Arsenic speciation in contaminated soils[J].Talanta,2002,58(1):97-107
[12] Zhang W H,Cai Y,Tu C,et al.Arsenic speciation and distribution in an arsenic hyperaccumulating plant[J].Science of the Total Environment,2002,300(1-3):167-177
[13] 武斌,廖曉勇,閻秀蘭,等.石灰性土壤中砷形態分級方法的比較及其最佳方案[J].環境科學學報,2006,26(9):1467-1469 Wu B,Liao X Y,Yan X L,et al.Comparison of five methods for fractionation of calcareous soil contaminated with arsenic [J].Acta Scientiae Circumstantiae,2006,26(9):1467-1469(in Chinese)
[14] Silva Gonzaga M I,Ma L Q,Santos J A G,et al.Rhizosphere characteristics of two arsenic hyperaccumulating Pteris ferns[J].Science of the Total Environment,2009,407(16):4711 -4716
[15] Cunningham S D,Ow D W.Promises and prospects of phytoremediation[J].Plant Physiology,1996,110(3):715-719
[16] Ghosh P,Rathinasabapathi B,Ma L Q.Arsenic-resistant bacteria solubilized arsenic in the growth media and increased growth of arsenic hyperaccumulator Pteris vittata L.[J].Bioresource Technology,2011,102(19):8756-8761
[17] 曾東,許振成.抗砷菌對蜈蚣草生長及其砷吸收能力的影響[J].環境污染與防治,2010(5):43-46 Zeng D,Xu Z C.Effect of arsenite-resistent bacteria on growth and arsenite adsorption capacity of Pteris vittata L[J].Environmental Pollution&Control,2010(5):43-46(in Chinese)
[18] Liu Y,Christie P,Zhang J,et al.Growth and arsenic uptake by Chinese brake fern inoculated with an arbuscular mycorrhizal fungus[J].Environmental and Experimental Botany,2009,66(3):435-441
[19] 羅磊,張淑貞,馬義兵.土壤中砷吸附機理及其影響因素研究進展[J].土壤,2008,40(3):351-359 Luo L,Zhang S Z,Ma Y B.Advance in research on arsenic sorption and its affecting factors in soils[J].Soil,2008,40(3):351-359(in Chinese)
[20] 陳倩,蘇建強,朱永官.微生物砷還原機制的研究進展[J].生態毒理學報,2011,6(3):225-233 Chen Q,Su J Q,Zhu Y G.Advances in mechanisms of microbial arsenate reduction[J].Asian Journal of Ecotoxicology,2011,6(3):225-233(in Chinese)
[21] Yamamura S,Watanabe M,Yamamoto N,et al.Potential for microbially mediated redox transformations and mobilization of arsenic in uncontaminated soils[J].Chemosphere,2009,77(2):169-174
[22] 徐衛紅,黃河,王愛華,等.根系分泌物對土壤重金屬活化及其機理研究進展[J].生態環境,2006,15(1):184-189 Xu W H,Huang H,Wang A H,et al.Advance in studies on activation of heavy metal by root exudates and mechanism[J].Ecology and Environment,2006,15(1):184-189(in Chinese)
[23] Masscheleyn P H,Delaune R D,Patrick Jr W H.Effect of redox potential and pH on arsenic speciation and solubility in a contaminated soil[J].Environmental Science&Technology,1991,25(8):1414-1419
[24] Fitz W J,Wenzel W W.Arsenic transformations in the soil-rhizosphere-plant system: Fundamentals and potential application to phytoremediation[J].Journal of Biotechnology,2002,99(3):259-278
[25] 劉廣良,蔡勇.環境中砷與溶解有機質的絡合作用[J].環境化學,2011,30(1):51-53 Liu G L,Cai Y.Complexation of arsenic with dissolved organic matter in the environment[J].Environmental Chemistry,2011,30(1):51-53(in Chinese)
[26] Dobran S,Zagury G J.Arsenic speciation and mobilization in CCA-contaminated soils:Influence of organic matter content[J].Science of the Total Environment,2006,364(1-3):239-250
[27] Balasoiu C F,Zagury G J,Deschênes L.Partitioning and speciation of chromium,copper,and arsenic in CCAcontaminated soils:Influence of soil composition[J].Science of the Total Environment,2001,280(1-3):239-255
[28] Wang S,Mulligan C N.Effect of natural organic matter on arsenic release from soils and sediments into groundwater[J].Environmental Geochemistry and Health,2006,28(3):197-214
[29] Tu S,Ma L,Luongo T.Root exudates and arsenic accumulation in arsenic hyperaccumulating Pteris vittata and non-hyperaccumulating Nephrolepis exaltata[J].Plant and Soil,2004,258(1):9 -19

