α平滑肌肌動蛋白紅色熒光蛋白報告基因載體的構建及其在細胞中的表達
蔡 琳 宋 卉 阮志燕
廣東食品藥品職業學院,廣東廣州 510520
特發性肺間質纖維化(idiopathic pulmonary fibros,IPF)是一種慢性彌漫性肺間質疾患,發病原因不明,組織學表現為尋常型間質性肺炎(usual interstitial pneumonitis, UIP)[1]。IPF是最常見的特發性間質性肺病,預后差,生存中值只有4年[1-3]。IPF主要發病人群年齡為50~70歲,分布沒有人種易感性,男性年發病率為7/10萬,女性年發病率為11/10萬[4]。IPF的組織學特征包括:肺泡上皮細胞不均一性的損傷活化、特征性的成纖維細胞灶存在和大量細胞外基質沉積[5]。雖然目前對其發病機制有一定的認識,但是其病因和具體的細胞分子機制還未明了。值得注意的是,肺纖維化目前還缺乏有效的治療手段,患者最后的轉歸均為呼吸衰竭和死亡。
成纖維細胞灶的形成是IPF關鍵的病理改變,其主要效應細胞是成肌纖維細胞[6]。目前大多數學者認為,損傷的肺泡上皮細胞通過上皮細胞-間質轉分化(epithelial to mesenchymal transition,EMT)是肌纖維細胞的主要來源[6]。EMT 的過程表現為上皮細胞標志物的消失,轉而表達間質細胞標志蛋白 α 平滑肌肌動蛋白(α smooth muscle actin,α-SMA)[7]。
α-SMA基因表達的異常激活與調控在肺泡上皮細胞向成肌纖維細胞轉分化的過程中占有極為重要的地位,在EMT過程中細胞如何啟動和調控α-SMA基因的表達尚未明了。為了探討肺泡上皮α-SMA基因在肺纖維化微環境下的轉錄激活,本課題組構建了由α-SMA啟動子驅動的紅色熒光蛋白報告載體,并在肺泡上皮細胞中進行表達和定位。
1 材料與方法
1.1 試劑和儀器
人肺泡上皮細胞A549細胞株、大腸桿菌DH5α、VSMp8質粒(含小鼠α-SMA啟動子序列)由本校實驗室保存;質粒微量提取試劑盒、凝膠回收試劑盒(優晶公司);紅色熒光蛋白報告質粒空載體pDs-Red(Clontech公司);限制性核酸內切酶(寶生物公司);Lipofactine 2000轉染試劑(Invitrogen 公司);重組人 TGF-β1(R&D 公司);倒置熒光顯微鏡(德國Leica公司);凝膠成像系統(美國Kodak公司)。
1.2 實驗方法
1.2.1 α-SMA啟動子紅色熒光報告載體pDs-Red-SMAp的構建 已知α-SMA啟動子區是插入在質粒VSMp8多克隆位點BamHⅠ和sphⅠ之間,用BamHⅠ和sphⅠ內切酶酶切VSMp8得到啟動子序列,將其插入pGEM-7Zf質粒的BamHⅠ和sphⅠ位點之間;然后用BamHⅠ和ApaⅠ內切酶酶切再次得到α-SMA啟動子序列;繼而將啟動子序列亞克隆于pDs-Red的BamHⅠ和ApaⅠ位點之間;最終得到重組質粒pDsRed-SMAp。重組子經BamHⅠ和ApaⅠ雙酶切鑒定、測序鑒定無誤后,擴增備用。
1.2.2 細胞培養 A549細胞株培養在含10%胎牛血清的低糖DMEM培養基中,常規培養于5%的CO2、37℃人工培養箱。
1.2.3 質粒轉染 轉染前1天,將A549細胞以1.5×104/mL細胞密度接種于24孔板,待24孔培養板中細胞融合至70%~80%時,依照Lipofectine 2000轉染試劑的操作指南進行轉染。
1.2.4 實驗分組和TGF-β1刺激 實驗分為4組,A組:轉染對照空載體質粒pDsRed組;B組:轉染對照空載體質粒pDsRed+TGF-β1組;C組:轉染重組質粒 pDsRed-SMAp組;D組:轉染重組質粒pDsRed-SMAp+TGF-β1組。需用TGF-β1刺激的組,分別于轉染后12 h加入終濃度為10 μg/L的TGF-β1刺激4 h,在熒光顯微鏡下觀察細胞內紅色熒光蛋白表達。上述實驗重復3次。
2 結果
2.1 pDsRed-SMAp重組載體的酶切鑒定
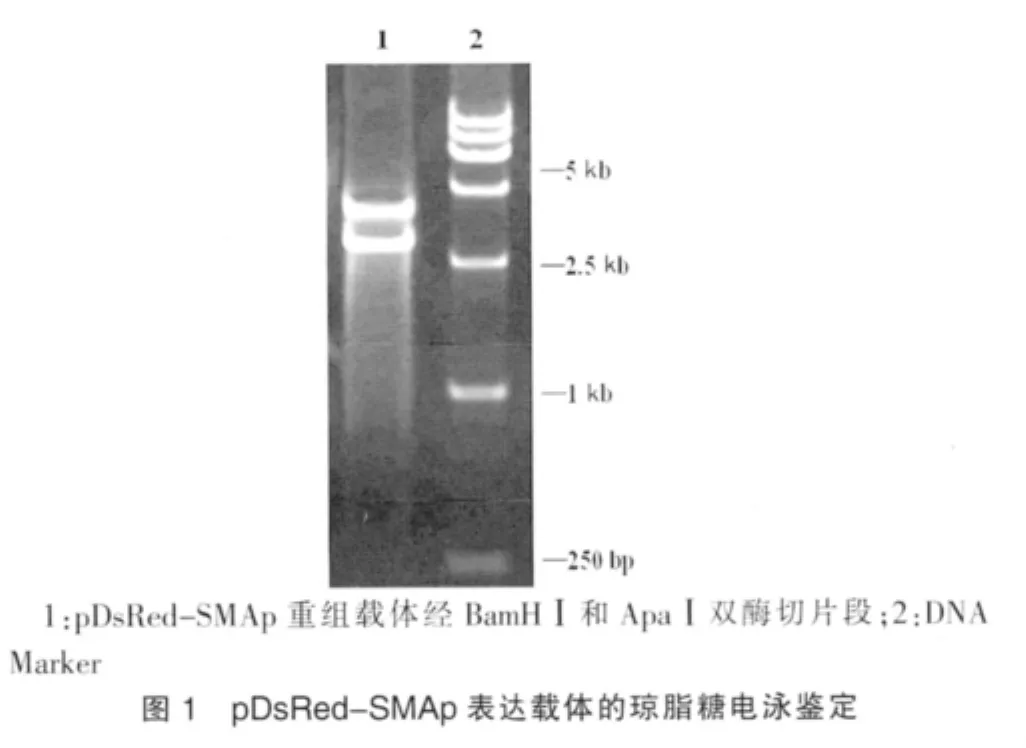
pDsRed-SMAp重組載體經BamHⅠ和ApaⅠ雙酶切,凝膠電泳可見切出約4.1 kb和3.7 kb的兩個片段,所得酶切片段與設計相符(圖1)。
2.2 pDsRed-SMAp重組載體的測序鑒定
經上海生工生物工程有限公司T7通用引物測序,結果與預期序列完全一致,DNA序列和讀碼框完全正確。
2.3 pDsRed-SMAp紅色熒光報告載體在上皮細胞中的表達
A組細胞轉染紅色熒光蛋白表達空載體質粒pDs-Red,在熒光顯微鏡下該組肺泡細胞中未觀察到紅色熒光蛋白(圖2A)。B組為轉染了空載體質粒pDs-Red的細胞在TGF-β1刺激4 h以后,依然不能在熒光顯微鏡下觀察到紅色熒光 (圖2B)。C組細胞是轉染α-SMA啟動子驅動的紅色熒光蛋白報告質粒pDsRed-SMAp,在鏡下后可見到少量而微弱的紅色熒光,但是表達熒光的細胞數量少,細胞呈顆粒狀,缺少正常細胞形態(圖2C)。D細胞在轉染α-SMA啟動子紅色熒光報告載體12 h后加TGF-β1刺激4 h,在熒光顯微鏡下則可觀察到細胞發出高亮度的紅色熒光,表達紅色熒光的細胞數量較多,細胞形態呈鋪路石狀貼壁生長,與正常的肺泡上皮細胞形態一致(圖2D)。上述實驗共重復3次,結果一致。
3 討論
傳統的觀點認為特發性肺纖維化是由慢性炎癥引起的,因此予以皮質激素和細胞毒性藥物治療IPF,可以抑制炎癥造成的肺組織損傷,從而減輕和治療肺纖維化[8-9]。但是臨床治療表明,使用糖皮質激素和細胞毒性抗炎治療對于IPF無明確的療效,并且許多確診為IPF的病例中發現其病理組織炎性反應較輕微。近年來的研究表明,IPF的病理改變是由肺泡上皮細胞的損傷造成,反復的損傷刺激導致肺泡上皮細胞轉分化為表達α-SMA的成肌纖維細胞,發生EMT。成肌纖維細胞由于其表達間質細胞標志物α-SMA,從而具有了收縮性,并且可以分泌大量的細胞外基質(ECM)沉積在肺組織中,成為IPF的主要效應細胞[10]。

TGF-β被認為是誘導器官纖維化(包括肺纖維化)的“總開關”,是促EMT作用最強的細胞因子,可以啟動并完成整個EMT過程[10]。無論是離體實驗或在體實驗均證實,過表達的TGF-β能促進肺泡上皮細胞轉分化,表達間質細胞標志蛋白α-SMA,加重肺纖維化[11-13]。因此,深入研究TGF-β誘導作用下上皮細胞α-SMA的分子調控機制對闡明IPF過程中肺泡上皮細胞發生EMT的病理機制非常重要。
紅色熒光蛋白 (red fluorescent protein,RFP)是海葵中分離出來的一種生物發光蛋白,能夠在紫外線激發下發出紅色熒光[14]。而本研究所采用的DsRed是Clontech公司商業化的一種低毒、低寡聚化及成熟快的紅色熒光蛋白突變體[15]。由于熒光蛋白基因可以在未受任何損壞的活體細胞中檢測其表達,DsRed被廣泛地應用于報告基因的研究。報告基因技術是將一段順式調控序列插入報告基因上游以控制報告基因的表達,從而直觀地“報道”該順式調控序列的表達調控以及與其相關信號轉導通路的活動[16]。DsReD具有很高的消光系數和熒光量子產量,用作報告基因具有熒光亮度高的優勢;DsReD發射熒光的強度要比羅丹明B等染料和最好的GFP突變體高得多;DsReD具有較強的抵御光漂白的能力;另外,DsReD對pH值不敏感,pH范圍4.5~12時仍保持穩定,這使其使用范圍更加廣泛。同時,DsReD除了可在活體細胞連續觀察的優點,較少受到外來熒光干擾,靈敏度與信噪比高[17]。
本研究構建的α-SMA啟動子紅色熒光報告載體pDsRed-SMAp是將α-SMA啟動子序列插入紅色熒光報告基因上游,通過紫外線激發檢測紅色熒光的強弱,從而示蹤α-SMA啟動子在活體細胞中的活化情況,對啟動子的表達調控進行評估。本研究將成功構建的pDsRed-SMAp重組質粒在人肺泡上皮細胞內進行轉染后發現,在靜息的上皮細胞可見到少量而微弱的紅色熒光,但是表達熒光的細胞數量少,細胞呈顆粒狀,缺少正常細胞形態,因此可以推測這些微弱的熒光并非由活體的上皮細胞發出,有可能是死亡細胞產生的非特異性熒光。說明在肺泡上皮細胞中缺乏α-SMA的表達,與既往研究結果一致。而在10 μg/L的TGF-β1刺激4 h后,可在熒光顯微鏡下觀察到由α-SMA啟動子驅動的紅色熒光蛋白基因高水平表達,發出高亮度的紅色熒光,表達紅色熒光的細胞數量較多,細胞形態呈鋪路石狀貼壁生長,與正常的肺泡上皮細胞形態一致。表明在TGF-β1的刺激下誘導了α-SMA啟動子活化,所構建的α-SMA啟動子驅動的紅色熒光報告基因系統具有完整的細胞內功能。
綜上所述,本研究成功構建了α-SMA啟動子紅色熒光報告載體pDsRed-SMAp,具有穩定性好、熒光持續時間長、不破壞細胞結構及直接觀察等優點,為研究肺纖維化EMT病理過程中α-SMA的基因調控提供了有效的工具。
[1]Gross TJ,Hunninghake GW.Idiopathic pulmonary fibrosis[J].N Engl J Med,2001, 345(7):517-525.
[2]Gribben J,Hubbard RB,Le-Jeune I,et al.Incidence and mortality of idiopathic pulmonary fibrosis and sarcoidosis in the UK [J].Thorax,2006,61(11):980-985.
[3]Bjoraker JA,Ryu JH,Edwin MK,et al.Prognostic significance of histo pathologic subsets in idiopathic pulmonary fibrosis[J].Am J Respir Crit Care Med,1998,157(1):199-203.
[4]Kim DS,Collard HR,King TE.Classification and natural history of the idiopathic interstitial pneumonias[J].Proc Am Thorac Soc,2006,3(4):285-292.
[5]Kamp DW.Idiopathic Pulmonary fibrosis the inflammation hypothesis revisited[J].Chest,2003,124(4):1187-1190.
[6]Willis BC,DuBois RM,Borok Z.Epithelial Origin of Myofibroblasts during Fibrosis in the Lung[J].Proc Am Thorac Soc,2006,3(4):377-382
[7]De Wever O,Westbroek W,Verloes A,et al.Critical role of N-cadherin inmyofibroblastinvasionandmigrationinvitrostimulatedbycolon-cancer-cell-derived TGF-β or wounding[J].J Cell Sci,2004,117(20):4691-4703.
[8]Mason RJ,Schwartz MI,Hunninghake GW,et al.Pharmacological therapy for idiopathic pulmonary fibrosis:past,present,and future[J].Am J Respir Crit Care Med,1999,160(5):1771-1177.
[9]Katzenstein AL,Myers JL.Idiopathic pulmonary fibrosis: clinical relevance of pathologic classification [J].Am J Respir Crit Care Med,1998,157(4):1301-1315.
[10]Futagawa T,Akiba H,Kodama T,et al.Expression and function of 4-1BB and 4-1BB ligand on murine dendritic cells [J].Int Immunol,2002,14(3):275-286.
[11]Sime PJ,Xing Z,Graham FL,et al.Adenovector-mediated Gene Transfer of Active Transforming Growth Factor-β1 Induces Prolonged Severe Fibrosis in Rat Lung[J].J Clin Invest,1997,100(4):768-776.
[12]Kalluri R,Neilson EG.Epithelial-mesenchymal transition and its implications for fibrosis[J].J Clin Invest,2003,112(12):1776-1784.
[13]Yao HW,Xie QM,Chen JQ,et al.TGF-beta1 induces alveolar epithelial to mesenchymal transition in vitro [J].Life Sci,2004,76(1):29-37.
[14]Matz MV,Fradkov AF,Labas YA,et al.Fluorescent proteins from nonbioluminescent anthozoa species[J].Nat Biotechnol,1999,17(10):969-973.
[15]Sumner JP,Westerberg NM,Stoddard AK,et al.DsRed a highly sensitive,selective,and reversible fluorescence-based biosensor for both Cu(+)and Cu(2+)ions[J].Biosens Bioelcctron,2006,21(7):1302-1308.
[16]Massoud TF,Paulmurugan R,De A,et al.Reporter gene imaging of protein-protein interactions in living subjects[J].Curr Opin Biotechnol,2007,18(1):31-37.
[17]Dmitrienko DV,Vrzheshch EP,Drutsa VL,et al.Red fluorescent protein DsRed:parametrization ofits chromophore as amino acid residue for computer modeling in the OPLS-AA force field[J].Biochemistry(Mosc),2006,71(10):1133-1152.

