電針對局灶性腦缺血再灌注大鼠神經生長相關蛋白-43和Nogo-A表達的影響①
韓永升,韓詠竹,徐磊,劉向國,徐銀
電針對局灶性腦缺血再灌注大鼠神經生長相關蛋白-43和Nogo-A表達的影響①
韓永升1,韓詠竹1,徐磊2,劉向國3,徐銀1
目的探討電針對局灶性腦缺血再灌注模型大鼠神經功能恢復和腦組織神經生長相關蛋白-43(GAP-43)、Nogo-A表達的影響。方法48只健康成年雄性Sprague-Dawley大鼠分為假手術組、模型組和電針組,每組16只。采用線栓法制作大鼠大腦中動脈缺血再灌注模型。電針組于造模成功90 min后電針刺雙側內關、水溝、三陰交和百會30 min,每天1次。假手術組和模型組不進行任何干預治療。各組大鼠在造模后7 d、14 d各取8只進行神經功能評估及免疫組化SP法觀察腦組織GAP-43、Nogo-A的表達。結果假手術組大鼠無神經功能缺損癥狀;7 d時,模型組和電針組神經功能評分無顯著性差異(P>0.05),14 d時,電針組神經功能優于模型組(P<0.05)。假手術組各時間點未見GAP-43陽性細胞表達。7 d時,模型組缺血灶周圍腦組織出現GAP-43陽性細胞,14 d時減少;電針組GAP-43陽性細胞各時間點較模型組明顯增加(P<0.01)。假手術組僅見少量Nogo-A表達,模型組腦缺血區7 d、14 d時Nogo-A表達明顯增多(P<0.01),電針組Nogo-A表達在各時間點較模型組明顯減少(P<0.01)。結論電針能通過促進局灶性腦梗死大鼠腦組織內GAP-43表達、抑制Nogo-A表達,改善大鼠的神經功能。
缺血/再灌注;電針;神經功能;神經生長相關蛋白-43;Nogo-A;大鼠
[本文著錄格式]韓永升,韓詠竹,徐磊,等.電針對局灶性腦缺血再灌注大鼠神經生長相關蛋白-43和Nogo-A表達的影響[J].中國康復理論與實踐,2013,19(2):119-123.
缺血性腦血管病(ischemic cerebral vascular disease,ICVD)是指因腦血液供應障礙引起局部腦組織缺血、缺氧導致的壞死或軟化,由于發病率、患病率、死亡率、致殘率和復發率高,已成為威脅人類健康的重大疾病[1]。目前,關于ICVD的治療僅組織型纖溶酶原激活物(tissue type plasminogen activator,t-PA)有循證醫學證據證明有效,但臨床只有3%~5%的急性缺血性腦卒中患者得到t-PA治療;神經保護是缺血性腦卒中的常用治療方法之一,但效果甚微[2-3]。傳統針刺療法治療缺血性腦血管病在臨床中應用廣泛,其中“醒腦開竅”針刺療法,經近萬例的臨床實踐,總有效率達98.56%[4]。
神經生長相關蛋白-43(growth associated protein-43,GAP-43)對神經的生長、發育、再生以及突觸功能的維持和遞質的釋放都起著重要作用,是神經再塑、再生的分子標志物[5]。Nogo-A是一種神經軸突生長相關蛋白,與中樞神經再生的關系最為密切,廣泛表達于中樞神經系統中,在抑制神經軸突再生表達過程中起重要作用。當神經組織受損發生重建時,Nogo-A的表達可再次增強[6-8]。本研究觀察電針對局灶性腦缺血再灌注大鼠腦組織中GAP-43和Nogo-A表達的影響。
1 材料與方法
1.1材料
1.1.1實驗動物健康成年雄性Sprague-Dawley大鼠48只,體重250~280 g,由上海西普爾-必凱實驗動物中心提供,許可證號:SCXK(滬)2008-0016。常規飼養,預適應環境1周后進行實驗。
1.1.2主要儀器和試劑G6805電針儀:上海醫療用品廠有限公司;德國LEICA RM2016輪轉式切片機:上海徠卡儀器有限公司;日本Olympus BX51顯微鏡:日本Olympus光學工業株式會社;免疫組化試劑盒SP-9000:北京中杉金橋生物技術有限公司;GAP-43抗體、Nogo-A抗體:北京博奧森生物技術有限公司。
1.2方法
1.2.1動物分組大鼠隨機數字法分為假手術組、模型組、電針組,每組16只。
1.2.2造模參考Longa[9]方法并加以改進。大鼠以10%水合氯醛(350 mg/kg)腹腔麻醉。切開右側頸部,逐層分離暴露右頸總動脈,結扎翼腭動脈和頸外動脈,將預先制備好的末端圓鈍、直徑約0.25~0.28 mm尼龍線經頸總動脈插入約18~20 mm至大腦中動脈近端,阻斷大腦中動脈血供120 min后,拔出尼龍線。假手術組只分離動脈,不結扎、插線。大鼠蘇醒后參照Longa[9]方法評分:0分:未見神經病學征象,無神經功能缺損癥狀;1分:大鼠被提尾倒懸時,病灶右側前肢屈曲、抬高,不能伸展右側前爪;2分:行走時對側旋轉轉圈;3分:行走困難并向對側傾倒;4分:不能自發行走,意識水平呈下降狀態。達到1~3分為造模成功,采用差額補充的方法補足每組的實驗動物數。
1.2.3電針干預電針組于造模成功后用自制鼠夾固定,不麻醉。根據華興邦等制定的大鼠針灸穴位圖譜[10],選雙側內關、水溝、雙側三陰交、百會,用華佗牌毫針(蘇州醫療用品廠有限公司),直徑0.2 mm,針身0.25~0.5寸,直刺雙側內關1 mm至筋間,鼻中隔下向上斜刺水溝1 mm,直刺三陰交5 mm,向前或向后斜刺百會2 mm,留針30 min;留針期間將內關、三陰交穴針柄分別連接G6805電針儀,施以疏密波,頻率2/100 Hz,電壓2~4 V,強度逐漸加大到大鼠針刺部位輕微抖動。首次針刺在動物造模成功后90 min進行,其后每天上午針刺1次。模型組和假手術組常規飼養于籠內,不進行任何干預。
1.3觀察指標
1.3.1神經功能評定參照Longa神經功能評分標準評分[9],于造模后7 d、14 d分別進行神經功能評分。
1.3.2免疫組織化學染色各組大鼠分別于造模后7 d、14 d隨機取8只。10%水合氯醛(350 mg/kg)腹腔注射麻醉,固定于手術臺,剪開胸腔,仔細剪開心包膜,暴露心臟,在心尖處剪一小切口,用9號針頭插入左心室,灌注生理鹽水,待右心耳膨起,剪開右心耳讓血液流出;至右心耳流出液無色透明時,改用4%多聚甲醛灌注固定。立即開顱取腦,在視交叉處切開,冠狀切取2 mm厚包含梗死灶區域及左右半球的組織塊浸于4%多聚甲醛中。在梗死區取約0.5 mm厚腦組織50%、75%、85%、95%、100%乙醇梯度脫水;二甲苯透明;浸蠟包埋。連續冠狀切片,厚5 μm。
石蠟切片常規脫蠟脫水,浸入0.01 mol/L枸櫞酸鹽緩沖液(pH=6.0)中,電爐加熱至沸騰后斷電,間隔5 min后再加熱至沸騰,反復2次;冷卻至室溫后,0.1 mol/L PBS洗滌2次;置3%H2O2去離子水孵育10 min;PBS沖洗3次,每次3 min;滴加正常山羊血清,室溫孵育15 min,傾去;分別滴加1∶200的GAP-43、Nogo-A一抗,4℃過夜;PBS沖洗3次,每次3 min;滴加生物素標記山羊抗兔IgG,37℃孵育15 min,PBS沖洗3次,每次3 min;滴加辣根酶標記鏈酶卵白素工作液,37℃孵育15 min,PBS沖洗3次,每次3 min;滴加DAB顯色試劑,室溫顯色,顯微鏡下控制反應時間,顯色后,蒸餾水洗滌終止反應。蘇木素輕度復染,自來水水洗;1%鹽酸酒精稍分色后蘭化片刻;常規脫水、透明、中性樹膠封片。用正常山羊血清替代一抗作陰性對照。Olympus BX51顯微鏡觀察并攝片,采用JD801形態學圖像分析系統對圖像進行分析。
1.4統計學分析
2 結果
2.1神經功能評分
假手術組大鼠無神經功能缺損癥狀。模型組和電針組比較,造模后7 d,神經功能評分無顯著性差異(P>0.05),14 d時電針組神經功能評分優于模型組(P<0.05)。見表1。
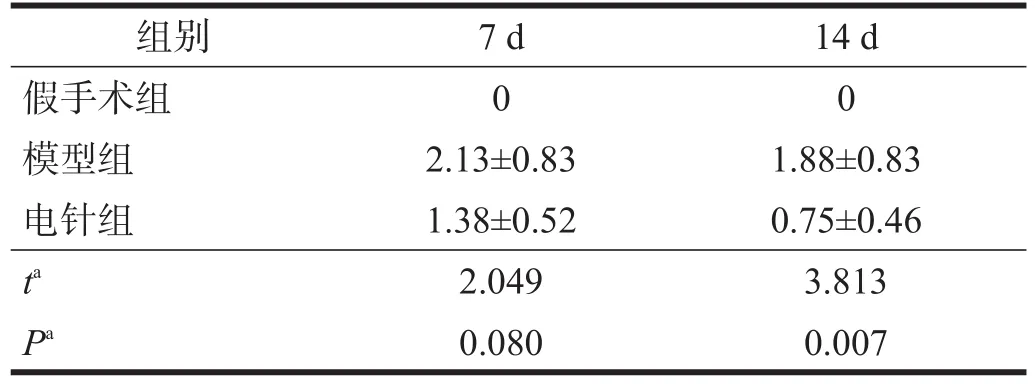
表1 各組大鼠缺血再灌注后神經功能評分
2.2GAP-43
假手術組中未見GAP-43陽性細胞表達。造模后7 d,模型組腦缺血區出現GAP-43陽性細胞,14 d時減少。電針組在各個時間點GAP-43陽性細胞表達較模型組顯著增加(P<0.001)。見表2、圖1。
2.3Nogo-A
假手術組大鼠大腦可見少量Nogo-A表達。造模后7 d,模型組腦缺血區Nogo-A表達增加,14 d時繼續增加,與假手術組比較有非常高度顯著性差異(P<0.001)。電針組在各個時間點Nogo-A表達均較模型組顯著減少(P<0.001)。見表3、圖2。
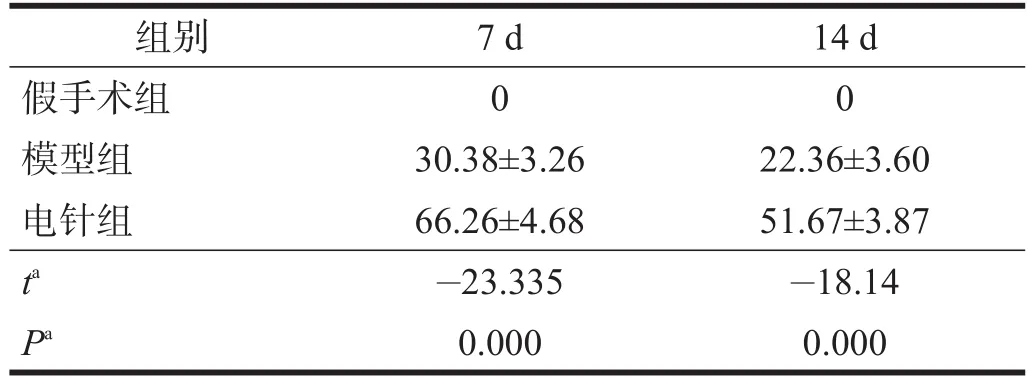
表2 各組大鼠腦內GAP-43陽性細胞數比較
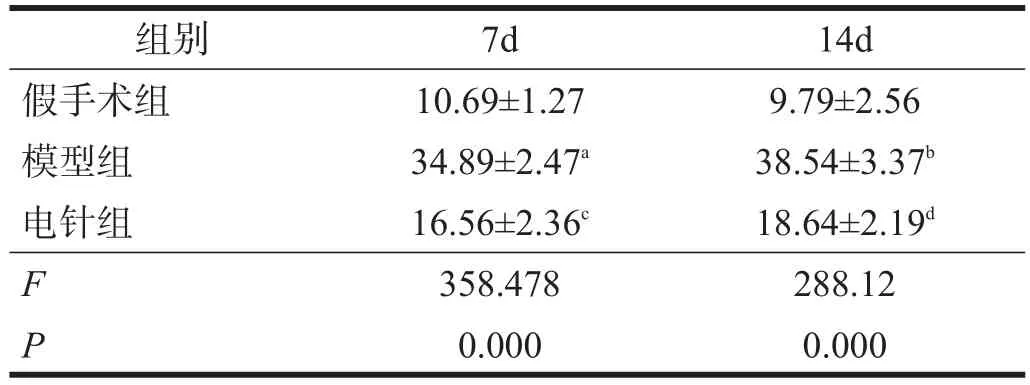
表3 各組大鼠腦內Nogo-A陽性細胞數比較
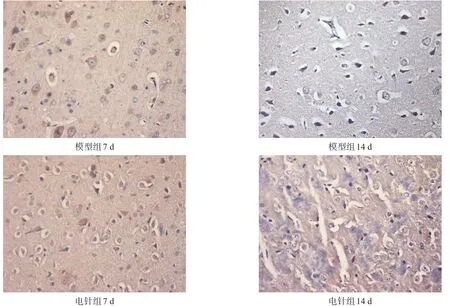
圖1 模型組、電針組大鼠腦組織GAP-43免疫組織化學染色(400×)
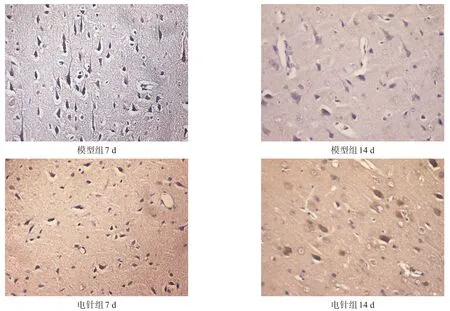
圖2 模型組、電針組大鼠腦組織Nogo-A免疫組織化學染色(400×)
3 討論
GAP-43是一種膜磷酸蛋白,是再生相關基因(regeneration associated gene,RAG)表達的產物蛋白,它不均勻地存在于腦組織中,在生長、再生的軸突末端含量極高,在指導軸突生長和調控新的軸突連接中發揮重要作用。GAP-43被認為是神經元生長的內在調節因子,可作為神經生長和再生的分子標志物[11]。
在突觸重建過程中,新生發芽末梢中GAP-43含量非常高。只要有突觸重建,即使無軸突延伸,GAP-43也會高水平表達;一旦突觸重建完成,GAP-43及GAP-43 mRNA含量下降,甚至呈微量或無陽性表達。
Nogo是中樞神經系統一種抑制軸突生長的因子,有Nogo-A、Nogo-B、Nogo-C 3種主要異構體,腦缺血損傷后,能抑制神經錐再生的病理過程,引起神經突起生長錐的崩解[12]。其中Nogo-A與中樞神經再生的關系最為密切,廣泛表達于中樞神經系統中,在抑制神經軸突再生表達過程中起重要作用[13]。
GAP-43作為一種載體蛋白的標記物,既促進神經元可塑性再生,又間接抑制Nogo-A表達,從而阻止細胞凋亡,是神經再生表達過程中的一個典型特征,可隨損傷的時空表象呈動態表達變化。本研究選取GAP-43和Nogo-A作為神經元標志蛋白進行觀察。
針刺法選用石學敏院士創立的“醒腦開竅”針法。臨床證實,醒腦開竅針刺法在降低患者的殘疾率、減少患者神經功能缺損程度方面療效確切,對于提高患者日常生活質量有顯著意義。“醒腦開竅”針法的主要穴位水溝、內關、三陰交相配可促進腦的代謝和修復,改善大腦的生理功能,達到“醒神開竅”之功。百會穴屬督脈,為手足三陽、督脈之匯,具有醒腦開竅、安神定志、升陽舉陷的作用,對腦卒中偏癱患者大腦皮層的中樞生物電有良好的調節作用。本實驗選取水溝、內關、三陰交為主穴,百會為配穴。
Zhou等通過不同的參數刺激實驗大鼠的水溝穴和百會穴,發現當電針刺激強度為1.0~1.2 mA、刺激頻率為5~20 Hz時能夠顯著恢復缺血性腦梗死,改善神經功能及死亡率,同時能使腦血流量增加100%[15]。王世軍等發現,電針刺激內關穴可顯著增加腦缺血區微血管數目,并且能減少神經細胞的死亡率[16]。因此本研究選用電針方法以量化針刺強度。
腦缺血時,神經細胞凋亡是腦缺血再灌注損傷后腦細胞死亡的重要途徑之一,是神經功能損害及梗死灶擴大的重要因素。減輕局灶性損傷程度和范圍,對搶救半暗帶區神經細胞,阻斷細胞凋亡的發生、發展尤為重要[17]。相關實驗研究顯示,腦缺血再灌注2 h后,GAP-43呈基礎表達,6~48 h明顯增高,7 d達高峰,之后表達逐漸降低,14 d呈最低表達。神經損傷后再生時,軸突內GAP-43的含量可增加20~100倍[18-19]。
成年時,大部分腦區GAP-43表達水平很低;當腦組織損傷時,損傷周圍的神經元通過側支發芽和反應性軸突再生進行功能代償,這些區域GAP-43水平再次升高,且隨著損傷修復時間的延長而逐步回落[20]。本實驗結果顯示,假手術組未見GAP-43陽性細胞,模型組GAP-43陽性細胞數在缺血7 d、14 d后增多,電針可以促進GAP-43表達,進一步促進大鼠腦缺血損傷區軸突的生長和再生,對損傷神經的恢復有一定效果。
Nogo-A是目前發現作用最為強烈的神經纖維再生抑制物質,在大鼠發育階段的前腦表達明顯;神經發育成熟后,Nogo-A在腦內呈低水平表達。當神經組織受損發生重建時,Nogo-A的表達可再次增強。腦梗死后,Nogo-A的表達增強會使受損神經元的軸突再生受限,損傷后功能恢復不理想。本研究顯示,假手術組大鼠腦組織中的Nogo-A處于較低的表達水平,模型組大鼠梗死灶周圍Nogo-A在梗死后表達增高,電針可以下調腦梗死灶周圍Nogo-A的表達,有效解除神經再生抑制,促進神經元軸突再生,從而促進腦缺血大鼠的運動功能恢復。
電針組大鼠神經功能恢復優于模型組,證實電針內關、水溝、三陰交、百會穴能夠促進大鼠腦缺血再灌注后神經功能恢復。其機制可能涉及很多方面,其中上調GAP-43表達,下調Nogo-A表達,從而促進神經再生,增強神經可塑性可能是重要機制之一。
[1]羅祖明,丁新生.缺血性腦血管病學[M].北京:人民衛生出版社,2011:1001.
[2]Taussky P,Tawk RG,Wilson P,et al.Medical therapy for ischemic stroke:review of intravenous and intra-arterial treatment options[J].World Neurosurg,2011,76(6S):S9-S15.
[3]Young AR,Ali C,Duretête A,et al.Neuroprotection and stroke:time for a compromise[J].J Neurochem,2007,103: 1302-1309.
[4]石學敏.“醒腦開竅”針刺法治療中風病9005例臨床研究[J].中醫藥導報,2005,11(1):3-5.
[5]Benowitz LI,Routtenberg A.GAP-43:an intrinsic determinant of neuronal development and plasticity[J].Trends Neurosci, 1997,20(2):84-91.
[6]Mingorance-Le Meur A,Zheng B,Soriano E,et al.Involvement of the myelin-associated inhibitor Nogo-A in early cortical development and neuronal maturation[J].Cereb Cortex, 2007,17:2375-2386.
[7]Tsai SY,Markus TM,Andrews EM,et al.Intrathecal treatment with anti-Nogo-A antibody improves functional recovery in adult rats after stroke[J].Exp Brain Res,2007,182:261-266.
[8]Schwab ME,Mir A,Rouiller E,et al.Intrathecally infused antibodies against Nogo-A penetrate the CNS and downregulate the endogenous neurite growth inhibitor Nogo-A[J].Mol Cell Neurosci,2006,32:161-173.
[9]Longa EZ,Weistein PR,Calson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke, 1989,20(1):84-91.
[10]華興邦,周浩良,李辭榮,等.大鼠穴位圖譜的研制[J].實驗動物與動物實驗,1991,1:1-5.
[11]Denny JB.Molecular mechanisms,biological actions,and neuropharmacologyofthegrowthassociatedprotein GAP-43[J].Curr Neuropharmaeo1,2006,4(4):293-304.
[12]Brittis PA,Flanagan JG.Nogo domains and a Nogo receptor: implications for axon regeneration[J].Neuron,2001,30(1): 1-14.
[13]Niederost B,Oertle T,Fritsche J,et al.Nogo-A and myelin-associated glycoprotein mediate neurite growth inhibition by antagonistic regulation of RhoA and Racl[J].J Neurosci,2002, 22(23):10368-10376.
[14]唐衛東,陳偉,陳紅.醒腦開竅針刺法治療中風后偏癱的臨床療效觀察[J].贛南醫學院學報,2009,4(29):570-571.
[15]Zhou F,Guo JC,Cheng JS,et al.Electroacupuncture increased cerebral blood flow and reduced ischemic brain injury: dependence on stimulation intensity and frequency[J].J Appl Physiol,2011,111:1877-1887.
[16]王世軍,崔可密,盧巖,等.針刺對MCAO大鼠海馬CA3區微血管數目及神經元死亡率的影響[J].山東中醫藥大學學報, 2005,29(1):59-60.
[17]劉亞軍.局灶性腦缺血再灌注細胞凋亡發生機制的研究進展[J].醫學綜述,2002,8(5):253-254.
[18]Tolner EA,Van Vliet EA,Holtmaat AJ,et al.GAP-43 mRNA and protein expression in the hippocampal and parahippocampal region during the course of epileptogenesis in rats[J].Eur J Neurosci,2003,17(11):2369-2380.
[19]Carrasco J,Penkowa M,Giralt M,et al.Role of metal lothionein2 III following central nervous system damage[J].Neurobiol Dis,2003,13(1):22-36.
[20]Kotulska K,Marcol W,Larysz Brysz M,et al.Impaired regeneration of Bcl-2 lacking peripheral nerves[J].Neurol Res, 2005,27(8):843-849.
Effects of Electroacupuncture on Expression of Growth Associated Protein-43 and Nogo-A after Focal Cerebral Ischemia/Reperfusion in Rats
HAN Yong-sheng,HAN Yong-zhu,XU Lei,et al.Institute of Neurology,Anhui Traditional Chinese Medical College,Hefei 230061,Anhui,China
ObjectiveTo investigate the effect of electroacupuncture on expression of growth associated protein-43(GAP-43)and Nogo-A in brain after focal cerebral ischemia/reperfusion in rats.Methods48 male Sprague-Dawley rats were randomly divided into sham group,model group and electroacupuncture group,and the latter two were modeled as middle cerebral artery occlusion and reperfusion with nylon monofilament suture.Electroacupuncture was performed 90 min after modeling in the electroacupucture group at acupoints of Neiguan(PC06),Shuigou(DU26),Sanyinjiao(SP06),Baihui(DU20),for 30 min,once a day.The sham group and the model group were conventionally fed in cages without any intervention.8 rats of each group were assessed with Longa's score,and the expressions of GAP-43 and Nogo-Awere detected with immunohistochemistry 7 d and 14 d after modeling respectively.ResultsThe sham group presented no neurological symptoms.There was not different in Longa's score between the model group and the electroacupuncture group 7 d after modeling(P>0.05),but was different 14 d after modeling(P<0.05).GAP-43 positive cells was not found in the sham group,but could be found around cerebral ischemia 7 d after modeling,which decreased 14 d after modeling in the model group.GAP-43 positive cells increased significantly in the electroacupuncture group compared with the model group at each time(P<0.01).Nogo-A positive cells was few found in the sham group,and was more in the model group(P<0.01).The expression of Nogo-A decreased significantly in the electroacupuncture group compared with the model group at each time(P<0.01).ConclusionElectroacupuncture can improve neurological function of focal cerebral ischemia/reperfusion rats,which may be associated with the increase of GAP-43 and descrease of Nogo-Ain peri-infarct regions.
ischemia/reperfusion;electroacupuncture;neurological function;growth associated protein-43;Nogo-A;rats
R743
A
1006-9771(2013)02-0119-05
2012-09-08
2012-10-24)
安徽中醫學院臨床科學研究基金項目(No.2009LC3-003)。
1.安徽中醫學院神經病學研究所附屬醫院,安徽合肥市230061;2.蚌埠醫學院第一附屬醫院康復醫學科,安徽蚌埠市233004;3.安徽中醫學院中西醫結合臨床學院,安徽合肥市230038。作者簡介:韓永升(1976-),男,安徽肥東縣人,博士研究生,副主任醫師,主要研究方向:神經系統疾病的康復治療。通訊作者:韓詠竹(1957-),男,安徽合肥市人,教授、主任醫師,碩士研究生導師,主要研究方向:神經遺傳病的診斷治療。曾獲安徽省科技進步一等獎,獲中華中醫藥學會科學技術三等獎,上海市科技進步三等獎。
10.3969/j.issn.1006-9771.2013.02.006

