補腎填精法對骨折后不同時相骨髓間充質干細胞增殖影響的實驗研究
王 斌 羅毅文 胡年宏
(廣州中醫藥大學附屬骨傷科醫院,廣東 廣州 510240)
骨修復過程類似于胚胎期的骨形成,存在兩種骨化形式,軟骨內成骨和膜內成骨,均需要骨折局部聚集數量足夠的骨髓間充質干細胞(marrow mesenchymal stem cells,MSCs)[1]。我們以往的實驗及臨床研究發現中藥骨康方具有補腎壯骨、填精養髓、健脾益氣的作用,骨康含藥血清能促進體外分離骨髓源性骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)增殖和成骨分化[2-3],對骨質疏松性骨折有良好的治療作用[4]。為進一步證實骨康方具有修復骨損傷的效應,本實驗觀察骨康方對大白兔骨折后不同時相BMSCs增殖能力的影響,為中醫藥促進骨折早期愈合及與時間相關性機制提供理論和實驗依據。
1 材料與方法
1.1 實驗動物及分組 4周齡新西蘭白兔20只,清潔級,雌雄不限,體重0.8~1.0kg,由廣州中醫藥大學動物實驗中心提供。20只白兔按隨機數字表法分成4組,即正常對照組、骨折模型組、中藥治療組、西藥治療組,每組5只。4組標記后分籠喂養,均予以普通飼料及潔凈自來水飼養,溫度維持在24℃左右。
1.2 橈骨骨折模型制作 正常對照組不作骨折處理。骨折模型組進行右側橈骨旋轉扭轉性骨折損傷處理,具體操作方式見文獻[5]。中藥治療組作上述骨折損傷處理后灌胃中藥骨康方。西藥治療組作上述骨折損傷處理后灌胃鈣爾奇D。對動物采用針筒灌藥,正常對照組和骨折模型組灌胃等量生理鹽水。每日給藥1次,連續給藥21d。
1.3 主要試劑 IMDM干粉、胎牛血清、0.25%胰酶、青霉素和鏈霉素(美國Gibcol公司),PBS緩沖液粉劑(武漢博士德公司),Percoll梯度分離液(美國Pharmacia公司),噻唑藍MTT(上海申能博采生物科技有限公司),二甲基亞砜(DMSO廣州威佳科技公司)。
1.4 藥物制備及給藥量
1.4.1 補腎填精法方藥(骨康方) 骨康方由補骨脂、制淫羊藿、肉蓯蓉、熟地黃、白芍、黃芪、菟絲子、丹參、當歸、大棗組成。將中藥制成粗粉,首煎將中藥粗粉置8倍溫水中浸泡0.5h,沸騰后文火煎煮4h,注意均勻攪拌,取汁后經3層紗布過濾;第2次和第3次煎煮均分別以6倍水文火煎煮2h,取汁,合并3次藥液,置水浴箱內濃縮至每毫升含生藥量1.43g(此藥物濃度是按人日用劑量,經人-兔體表面積比值折算成相當于人臨床劑量,濃縮8倍而成。由廣州中醫藥大學附屬骨傷科醫院制劑室提供,批號:960211)。藥液常溫冷卻后,置4℃冰箱內保存備用。根據臨床用藥劑量及新藥研究中動物用藥劑量要求,生藥按劑量9.6g/kg(根據以往實驗高劑量組增殖、誘導效果最佳[2-3])配制,相當于臨床劑量的20倍,藥物以蒸餾水定容至所需濃度。
1.4.2 西藥 鈣爾奇D(由Wyeth惠氏制藥有限公司提供,批號0501125,每片600mg),根據“人和動物體表面積折算比率表”進行計算,兔的劑量約為28mg/kg。將鈣爾奇D以蒸餾水定容至所需濃度。
1.5 BMSCs的分離 將4組白兔分別給予3g/L苯巴比妥腹腔注射麻醉,術區剃毛、消毒,鋪洞巾,用骨髓穿刺針在T0(創前)、T7(創后第 7 天)、T14(創后第 14 天)、T21(創后第 21 天)分別無菌抽取右側橈骨骨折部位的骨髓液,緩慢注入含4mL淋巴細胞分層液試管內,2000r/min離心 25min,吸取中間單個核細胞層,用pH值為7.2的 Hank’s液洗 2次。
1.6 BMSCs流式細胞儀檢測 取洗滌后的分離液離心后去上清液,加入1mL磷酸鹽緩沖液稀釋,計算濃度。取含1×106個細胞的液體,離心去上清加100μL磷酸鹽緩沖液重懸,再分別加入熒光抗體CD44-FITC及CD45-RPE 各 10μL,避光孵育 30min,加磷酸鹽緩沖液洗滌2次,去上清加500μL 1%多聚甲醛重懸固定,冰盒保存,送流式細胞實驗室檢測。含CD44-FITC陽性而CD45-PE陰性的細胞定為BMSCs,由此測得的該細胞數值即為BMSCs構成比(BMSCs占總細胞數的構成比),通過多個構成比求其平均值。
1.7 BMSCs的培養 用含體積分數為10%小牛血清的DMEM作為培養液(含青霉素100U/mL、鏈霉素100g/mL、兩性霉素 B 0.25g/mL),將細胞密度調至 2×109/L,接種于培養瓶中,置于37℃恒溫,含體積分數為5%CO2的飽和濕度培養箱中培養。第3天換液1次,棄除未貼壁細胞,以后隔天換液,待融合成單層細胞后,傳代培養。
1.8 形態學觀察 通過倒置相差顯微鏡連續觀察BMSCs的生長情況,觀察細胞在不同時間段的形態學變化。觀察樣本量為6孔。
1.9 四甲基偶氮唑鹽檢測(MTT法) 取生長良好的P3代細胞消化后制成細胞懸液,計數后將BMSCs以2×104細胞/孔的密度接種于6孔培養板中(孔內各置一無菌蓋玻片),每孔加入1g/L四甲基偶氮唑鹽溶液,0.5mL/孔。細胞繼續于37℃避光孵育4h,棄去培養液,每孔加入150μL二甲基亞砜,振蕩培養板直至紫色結晶完全溶解。于48h時進行MTT檢測,用酶標儀測定490nm波長的吸光度(A)值。
2 結果
2.1 骨康方對兔骨折端BMSCs構成比的影響 除T0外,與正常對照組比較,同一時相其他各組兔骨折端BMSCs構成比顯著升高(P<0.05,P<0.01)。中藥治療組不同時相(T7、T21)BMSCs 構成比顯著高于其他 3 組(P<0.01)。見表1。
2.2 各組兔骨折端BMSCs形態學觀察 原代及傳代培養:原代培養細胞48h首次換液,BMSCs呈短梭形貼壁生長,并逐漸呈現集落生長,12~14d達到融合生長,融合成片的細胞排列有一定的方向性,呈漩渦狀排列,細胞呈梭形或橢圓形等,見圖1-A。傳代細胞2~4h迅速貼壁,伸展,細胞呈均勻生長,細胞形態更加單一,5~6h鋪滿瓶底。倒置相差顯微鏡下,剛接種的骨髓中體積較大的單個核細胞呈球形,懸浮于培養液中。8~10h開始逐漸沉降貼壁,48h少數貼壁細胞呈成纖維細胞樣外形,以后細胞呈克隆均勻分布生長,形態均一,呈長梭形,見圖1-B。生長期細胞分裂相多見,細胞突起互相連接,增殖速度快,兩三天即可傳代,見圖1-C。
表1 各組兔不同時相骨折端BMSCs構成比()
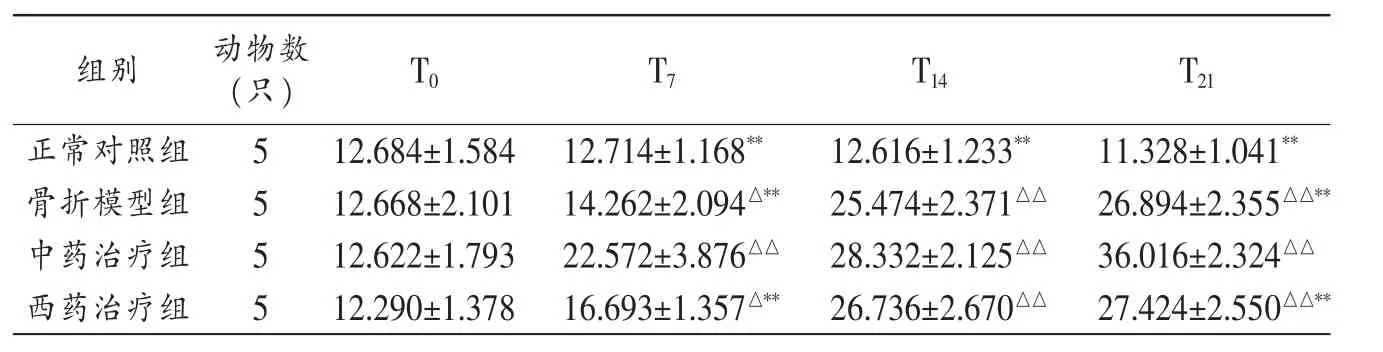
表1 各組兔不同時相骨折端BMSCs構成比()
注:與同時相正常對照組比較,△P<0.05,△△P<0.01;與同時相中藥治療組比較,**P<0.01。
組別 動物數(只)T21 T0正常對照組5 T7 T14 12.684±1.58412.714±1.168** 12.616±1.233**11.328±1.041**骨折模型組 12.668±2.101 14.262±2.094△** 25.474±2.371△△ 26.894±2.355△△**5中藥治療組 5 12.622±1.793 22.572±3.876△△ 28.332±2.125△△ 36.016±2.324△△西藥治療組 5 12.290±1.378 16.693±1.357△** 26.736±2.670△△ 27.424±2.550△△**
2.3 骨康方對兔骨折端BMSCs增殖能力的影響 中藥治療組不同時相BMSCs增殖能力均顯著高于其他3組(P<0.01)。見表2。
表2 各組兔不同時相骨折端BMSCs增殖OD值()
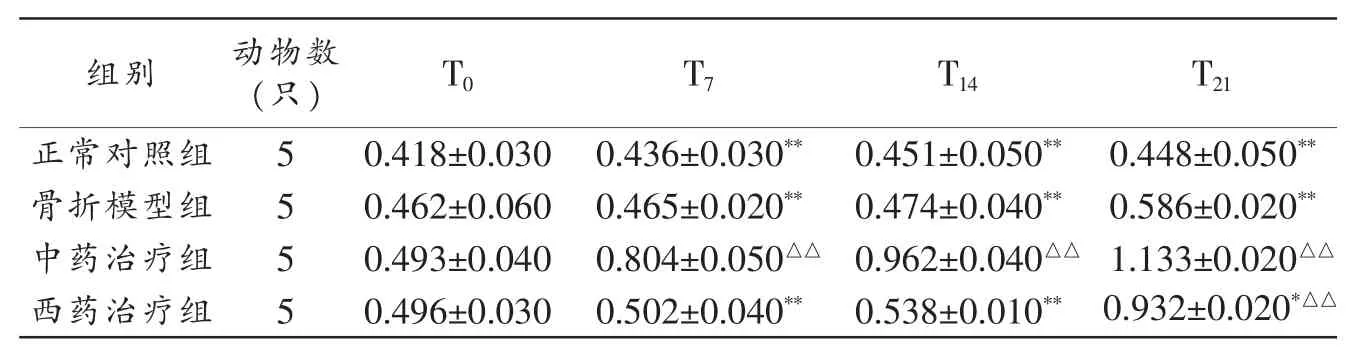
表2 各組兔不同時相骨折端BMSCs增殖OD值()
注:與正常對照組同時相比較,△△P<0.01;與同時相中藥治療組比較,*P<0.05,**P<0.01。
組別 動物數(只)T21 T0正常對照組5 T7 T14 0.418±0.0300.436±0.030** 0.451±0.050**0.448±0.050**骨折模型組 0.462±0.060 0.465±0.020** 0.474±0.040** 0.586±0.020**5中藥治療組 5 0.493±0.040 0.804±0.050△△ 0.962±0.040△△ 1.133±0.020△△西藥治療組 5 0.496±0.030 0.502±0.040** 0.538±0.010** 0.932±0.020*△△
3 討論
骨折的愈合實質上是骨損傷后的再生過程,也是骨組織的形成過程。現多認為,在骨折愈合中直接參與骨折修復的細胞主要是BMSCs,這種未分化細胞具有增殖和自我更新的能力,并且有向骨、脂肪、軟骨組織分化的潛能,因此BMSCs的增殖對骨折愈合具有促進作用[6]。BMSCs的增殖和向成骨細胞方向分化不僅有利于骨折的愈合,更有利于進行BMSCs的自體移植,無免疫原性且不牽涉到倫理問題,如果利用這一特性對其進行強化干預則有利于增進骨折的愈合速度,尤其有利于骨折后出現的骨缺損、骨不連及骨折制動后出現的骨質疏松等難治性骨科疾病的治療。
中醫理論認為,腎藏精,生髓主骨,腎中精氣的盛衰能夠決定骨骼的強弱,影響骨的代謝。補腎中藥對BMSCs的體外培養及分化已有相當的研究[7],但如何提高骨折后不同時相體內BMSCs的增殖和促進骨化尚未見報道。本課題前期實驗研究表明骨康含藥血清對BMSCs增殖和成骨分化作用大都基于體外的細胞培養[2-3],組織細胞的生存環境在很大程度上有異于體內,因此運用整體動物口服補腎填精中藥骨康后對BMSCs增殖的影響,更接近于臨床試驗。本實驗研究結果發現:白兔在右側橈骨旋轉扭轉性骨折損傷后1周內出現BMSCs構成比增加,并持續至第3周;而沒有骨折損傷刺激的白兔BMSCs處于比較低水平的構成比狀態,兩者比較有顯著性差異(P<0.05或P<0.01)。因此,骨損傷刺激可誘導活體內骨髓間充質干細胞的增殖,這與謝明等[8]研究結果一致。兔骨折端BMSCs構成比在不同處理方法下不同處理時相變化的趨勢不同,其中中藥治療組不同時相(T7、T21)BMSCs構成比顯著高于其他 3 組(P<0.01)。因此,運用中藥骨康干預骨折損傷白兔有利于增加BMSCs構成比,尤其是對骨折損傷后第3周仍有較強的促進BMSCs增殖作用。
中藥對骨折愈合具有明顯促進作用,特別對于骨延遲愈合和不愈合具有較高的治愈率[9-10]。目前研究大多集中在中藥作用于骨折局部的宏觀水平,而對其促進骨折愈合的細胞學及分子學機制研究較少。眾所周知,骨折愈合是一個復雜而有序的病理過程,涉及一系列細胞的募集、增殖及分化。因此BMSCs的增殖對骨折愈合具有促進作用。細胞增殖在時間上以48h最理想,本實驗運用MTT法檢測各組骨折后BMSCs培養48h時的增殖效應,發現骨折模型兔骨折端BMSCs增殖能力在不同處理方法下不同處理時相變化的趨勢不同,其中中藥治療組不同時相BMSCs增殖能力顯著高于其他 3組(P<0.05,P<0.01),并隨著治療時間的推移呈現逐漸增加的趨勢,這表明中藥骨康具有促進BMSCs增殖的能力,且發揮增殖作用有一定的時效關系。
綜上所述,中藥骨康方有利于骨折后白兔體內BMSCs構成比增加,對BMSCs增殖有明顯的促進作用。由此,我們可以推測,骨康方可以通過在增殖高峰時刻刺激體內BMSCs增殖,不斷增加BMSCs數量,從而增加軟骨細胞、成骨細胞轉化數量[11],促進骨折愈合康復的速度,縮短康復時間,其機理還有待進一步研究探討。
[1]Sundeep Khosla,Jennifer J,Westendorf,et al.Concise Review:Insights from Normal Bone Remodeling and Stem Cell-Based Therapies for Bone Repair.Stem Cells,2010,28(12):2124
[2]王斌,羅毅文,胡年宏.骨康方對大鼠MSCs體外向成骨細胞分化和 ALP 的影響.中國中醫骨傷科雜志,2007,15(12):5
[3]王斌,羅毅文,胡年宏.骨康方含藥血清誘導大鼠骨髓基質細胞向成骨細胞方向分化的實驗研究.中國中醫骨傷科雜志,2007,l5(11):32
[4]莊洪.骨康對骨質疏松性骨折愈合過程Ⅰ、Ⅱ型膠原及CTGF表達的影響.中國優秀博碩士學位論文全文數據庫(博士),2005
[5]Farso Nielsen F,Karring T,Gogolewski S.Biodegradable guide for bone regeneration.Polyurethane membranes tested in rabbit radius defects.Acta Orthop Scand,1992,63(1):66
[6]Xuesong Han,Liu Liu,Fuke Wang,et al.Reconstruction of tissue-engineered bone with bone marrow mesenchymal stem cells and partially deproteinised bone in Vitro.Cell Biology International,20 Aug 2012 as manuscript CBI,2011:1
[7]范海蛟.補腎中藥對大鼠骨髓基質干細胞增殖和分化的影響.廣州中醫藥大學,2008
[8]謝明,封衛兵,劉艷萍,等.骨折后骨髓間充質干細胞的增殖變化.中國臨床康復,2008,10(29):56
[9]王書湘.中醫辨證結合手術治療骨不連46例.河南中醫,2011,31(8):903
[10]康金平.中醫藥治療骨折研究進展.中醫藥臨床雜志,2012,24(5):476
[11] 徐無忌.骨康對不同誘導條件下MSCs分化影響及BMP-2對成骨分化的作用.廣州中醫藥大學,2008

