杜仲MEP途徑系列基因的基因結構預測
劉慧敏,烏云塔娜,杜紅巖
(1.中南林業科技大學a.經濟林育種與栽培國家林業局重點實驗室;b.林學院,湖南 長沙 410004;2.中國林業科學研究院 經濟林研究開發中心,河南 鄭州 450003;3.國家林業局 杜仲工程技術研究中心,河南 鄭州 450003)
杜仲又名絲連皮、扯絲皮、絲棉皮、玉絲皮、思仲等,屬落葉喬木。杜仲是我國特有樹種,經濟價值很高,被確定為國家二級珍貴保護樹種,也是世界上適應范圍最廣的重要膠原植物,中國是現存杜仲的唯一原產地[1-4]。千百年來,杜仲以去皮入藥而著稱,為中藥上品。近20年來,隨著杜仲膠特殊性能的不斷發現,杜仲資源在全國各地區迅速發展[5]。杜仲膠是普通天然橡膠(三葉橡膠)的同分異構體,其化學結構為反式-聚異戊二烯(C5H8)n,是一種特殊的天然高分子材料[6]。杜仲膠具有低溫可塑、形狀記憶、投雷達波、耐磨、耐腐蝕、減震、隔音等特性,并將與相關材料的共混、集成、改性等多功能集于一身,其產業前景十分廣闊[2,7-9]。
2-甲基-D-赤蘚醇-4-磷酸(2-C-methyl-D-erythritol-4-phosphate,MEP)途徑是植物萜類生物合成上游重要的調控路徑之一。萜類在植物的多種生命活動如光合與呼吸代謝、激素調節、生長發育調節、細胞信號轉導、植物通訊及與環境互作等過程中都發揮著重要作用[10-13]。
內含子(intron)為真核細胞基因DNA中的間插序列,這些序列被轉錄成RNA,但隨即被剪輯除去而不翻譯。大約80%~85%的高等植物含有內含子,不同基因的內含子數目各異。長期以來,人們普遍認為內含子沒有功能作用,隨著分子生物技術的發展,人們發現內含子在基因表達調控中有很重要的作用,內含子會影響基因表達模式,可以增強基因表達水平,還能驅動基因表達[14]。隨著對內含子功能認識的逐步深入,內含子將會成為精確地調控目的基因表達的有力工具,在基因工程領域發揮更大的作用[15]。
1 材料與方法
1.1 數據資料
本研究采用的數據全部來自杜仲膠合成時期轉錄組數據和杜仲基因組測序數據。
1.2 分析方法
用在線軟件GSDS(http://gsds.cbi.pku.edu.cn/index.php),分析MEP途徑系列基因的內含子和外顯子[16]。
2 結果與分析
2.1 杜仲MEP途徑EuDXS基因內含子和外顯子預測
將轉錄組數據1-脫氧-D-木酮糖-5-磷酸合成酶基因(EuDXS2)的全長cDNA和EuDXS2的基因組數據提交到在線軟件GSDS中,繪制出EuDXS2基因結構示意圖,如圖1所示。分析發現,EuDXS2基因5′端非編碼區的長度為1 853 bp,3′端非編碼區的長度為2 000 bp,包含9個內含子和10個外顯子,內含子的相位有7處為“0”,2處為“1”,無“2”相位(見圖1,表1)。
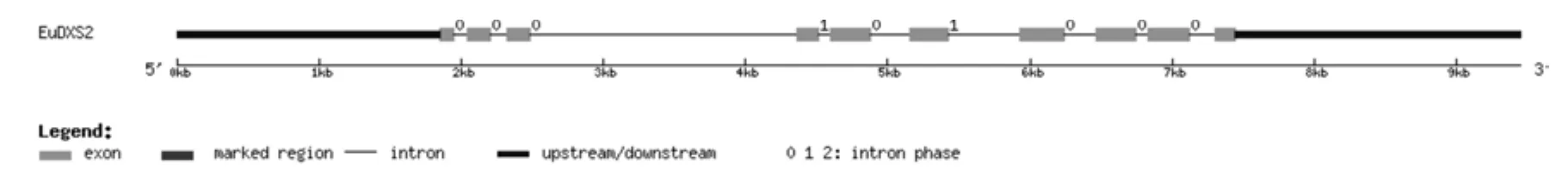
圖1 EuDXS2基因內含子和外顯子的分布Fig.1 Distribution of the introns and exons in EuDXS2
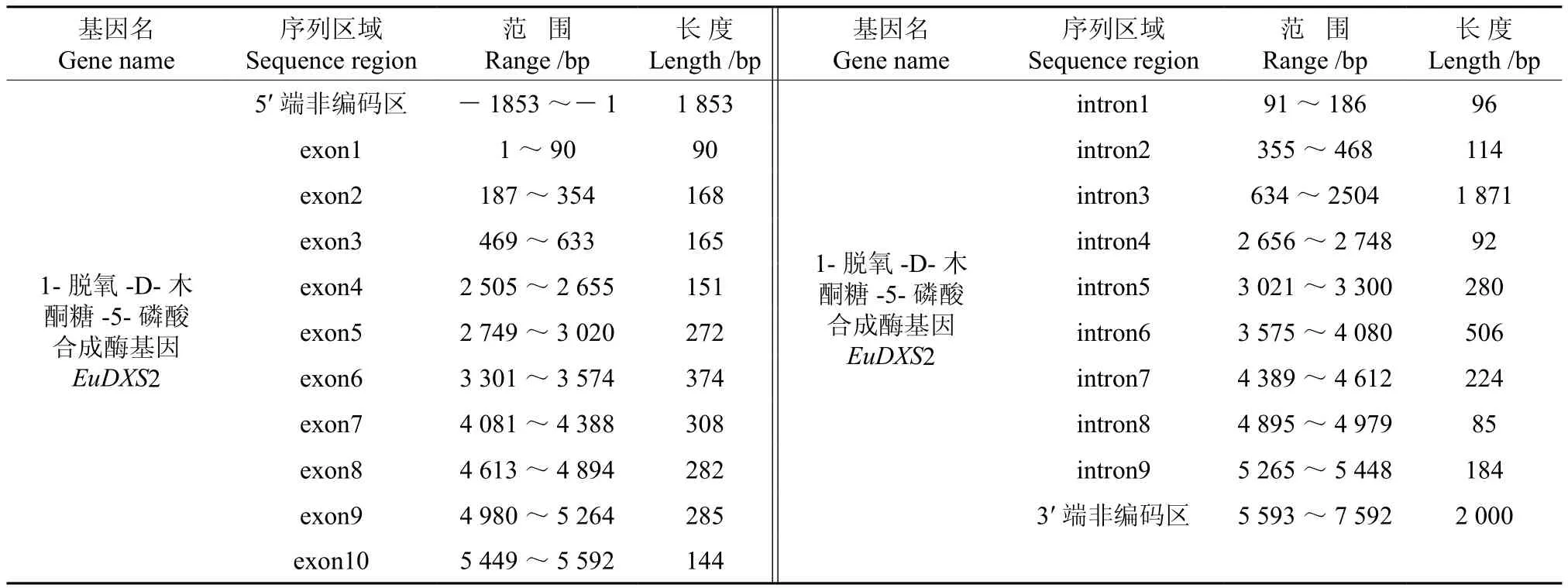
表1 EuDXS2基因內含子和外顯子的分布Table 1 Distribution of the introns and exons in EuDXS2
2.2 杜仲MEP途徑EuDXR基因內含子和外顯子預測
將轉錄組數據1-脫氧-D-木酮糖-5-磷酸還原異構酶基因(EuDXR)的全長cDNA和EuDXR的基因組數據提交到在線軟件GSDS中,繪制出EuDXR基因結構示意圖(見圖2)。分析發現,EuDXR基因5′端非編碼區的長度為1 120 bp,3′端非編碼區的長度為2 163 bp,包含11個內含子和12個外顯子,內含子的相位有7處為“0”,1處為“1”,2處為“2” (見圖2,表2)。

圖2 EuDXR基因內含子和外顯子的分布Fig.2 Distribution of the introns and exons in EuDXR
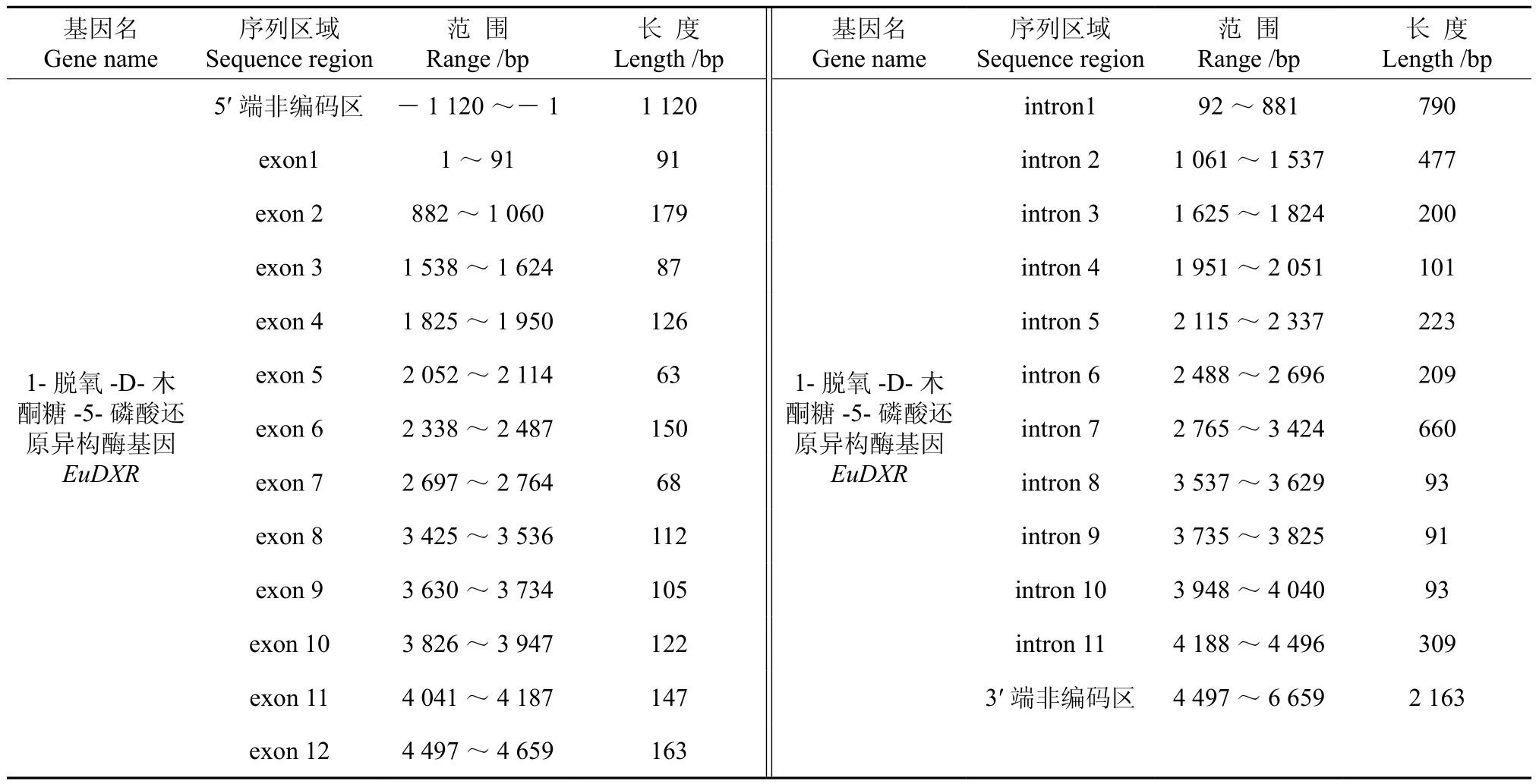
表2 EuDXR基因內含子和外顯子的分布Table 2 Distribution of the introns and exons in EuDXR
2.3 4-杜仲MEP途徑EuCMK基因內含子和外顯子預測
將杜仲轉錄組數據中4-(5′-焦磷酸胞苷)-2-C-甲基-D-赤蘚醇激酶基因(EuCMK)基因的全長cDNA和基因組序列中EuCMK的序列提交到在線軟件GSDS中,繪制出EuCMK基因結構示意圖(見圖3)。分析發現,EuCMK基因5′端非編碼區的長度為5 000 bp,3′端非編碼區的長度為424 bp,包含10個內含子和11個外顯子,內含子的相位有7處為“0”,2處為“1”,1處為“2”(見圖3,表3)。
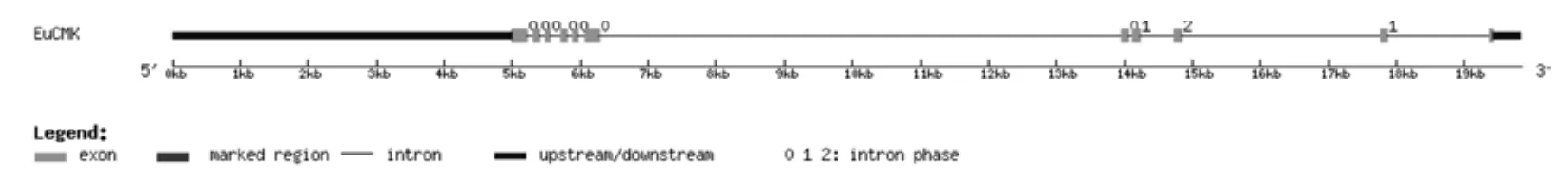
圖3 EuCMK基因內含子和外顯子的分布Fig.3 Distribution of the introns and exons in EuCMK
2.4 杜仲MEP途徑EuMDS基因內含子和外顯子預測及分析
將轉錄組數據2-甲基-D-赤蘚醇-2,4-環焦磷酸合酶基因(EuMDS)的全長cDNA和EuMDS的基因組數據提交到在線軟件GSDS中,繪制出EuMDS基因結構示意圖(見圖4)。分析發現,EuMDS基因5′端非編碼區的長度為5 000 bp,3′端非編碼區的長度為5 000 bp,包含2個內含子和3個外顯子,內含子的相位有1處為“0”,1處為“1”(見圖4,表4)。
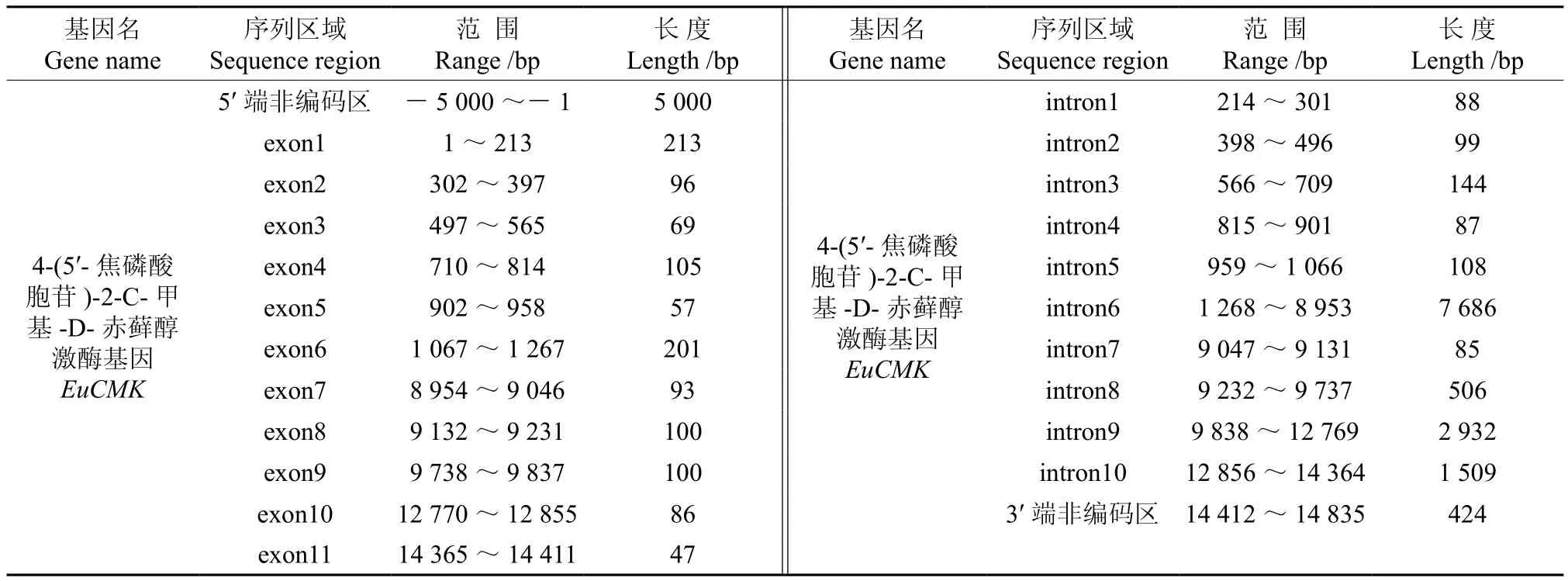
表3 EuCMK基因內含子和外顯子的分布Table 3 Distribution of the introns and exons in EuCMK
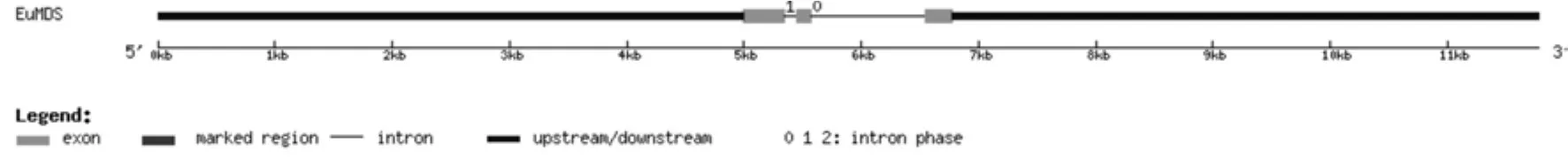
圖4 EuMDS基因內含子和外顯子的分布Fig.4 Distribution of the introns and exons in EuMDS
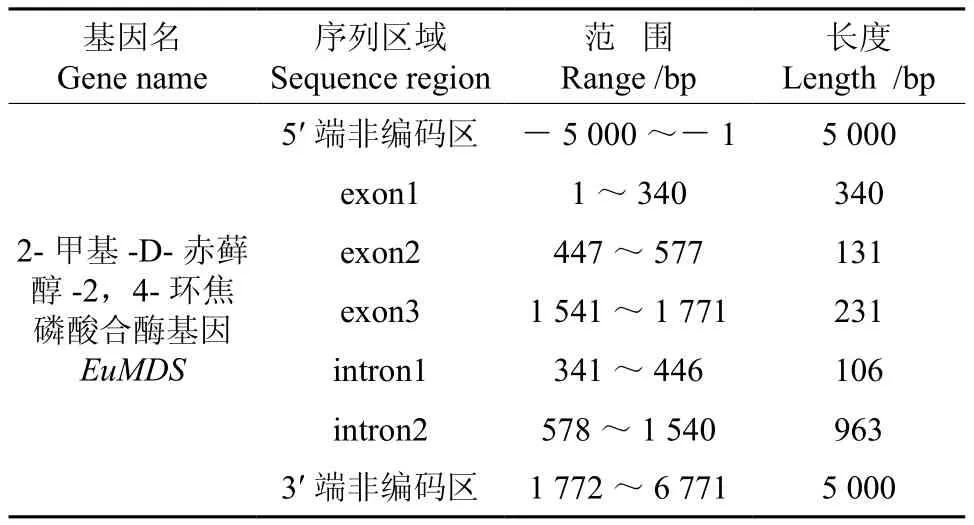
表4 EuMDS基因內含子和外顯子的分布Table 4 Distribution of the introns and exons in EuMDS
2.5 杜仲MEP途徑EuHDS基因內含子和外顯子預測及分析
將轉錄組數據1-羥基-2-甲基-2-E-丁烯基-4-焦磷酸合酶基因(EuHDS)的全長cDNA和EuHDS的基因組數據提交到在線軟件GSDS中,繪制出EuHDS基因結構示意圖(見圖5)。分析發現,EuHDS基因5′端非編碼區的長度為2 000 bp,3′端非編碼區的長度為2 000 bp,包含18個內含子和19個外顯子,內含子的相位有12處為“0”,3處為“1”,3處為“2”(見圖5,表5)。
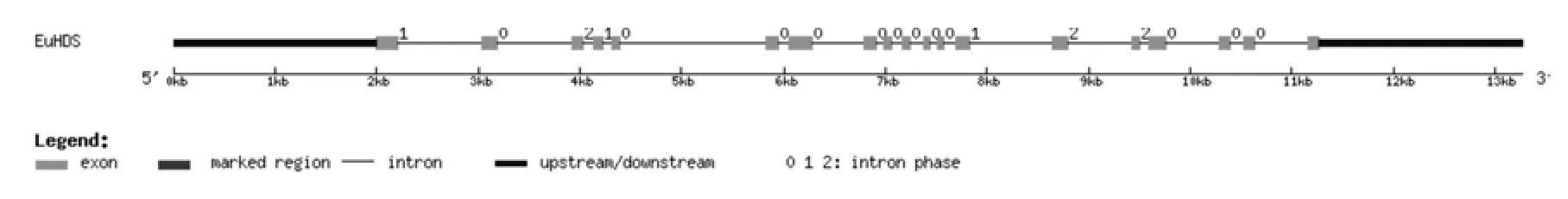
圖5 EuHDS基因內含子和外顯子的分布Fig.5 Distribution of the introns and exons in EuHDS
2.6 杜仲MEP途徑EuHDR基因內含子和外顯子預測及分析
將轉錄組數據1-羥基-2-甲基-2-E-丁烯基-4-焦磷酸還原酶基因(EuHDR)的全長cDNA和EuHDR的基因組數據提交到在線軟件GSDS中,繪制出EuHDR基因結構示意圖(見圖6)。分析發現,EuHDR基因5′端非編碼區的長度為1 347 bp,3′端非編碼區的長度為3 000 bp,包含8個內含子和9個外顯子,內含子的相位有5處為“0”,3處為“2”(見圖6,表6)。
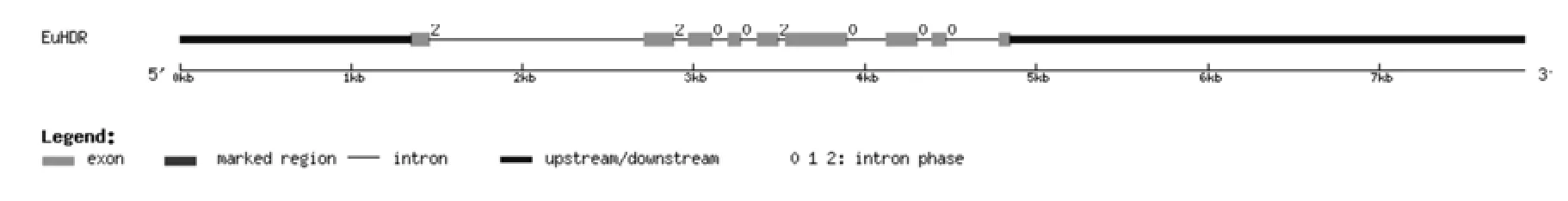
圖6 EuHDR基因內含子和外顯子的分布Fig.6 Distribution of the introns and exons in EuHDR
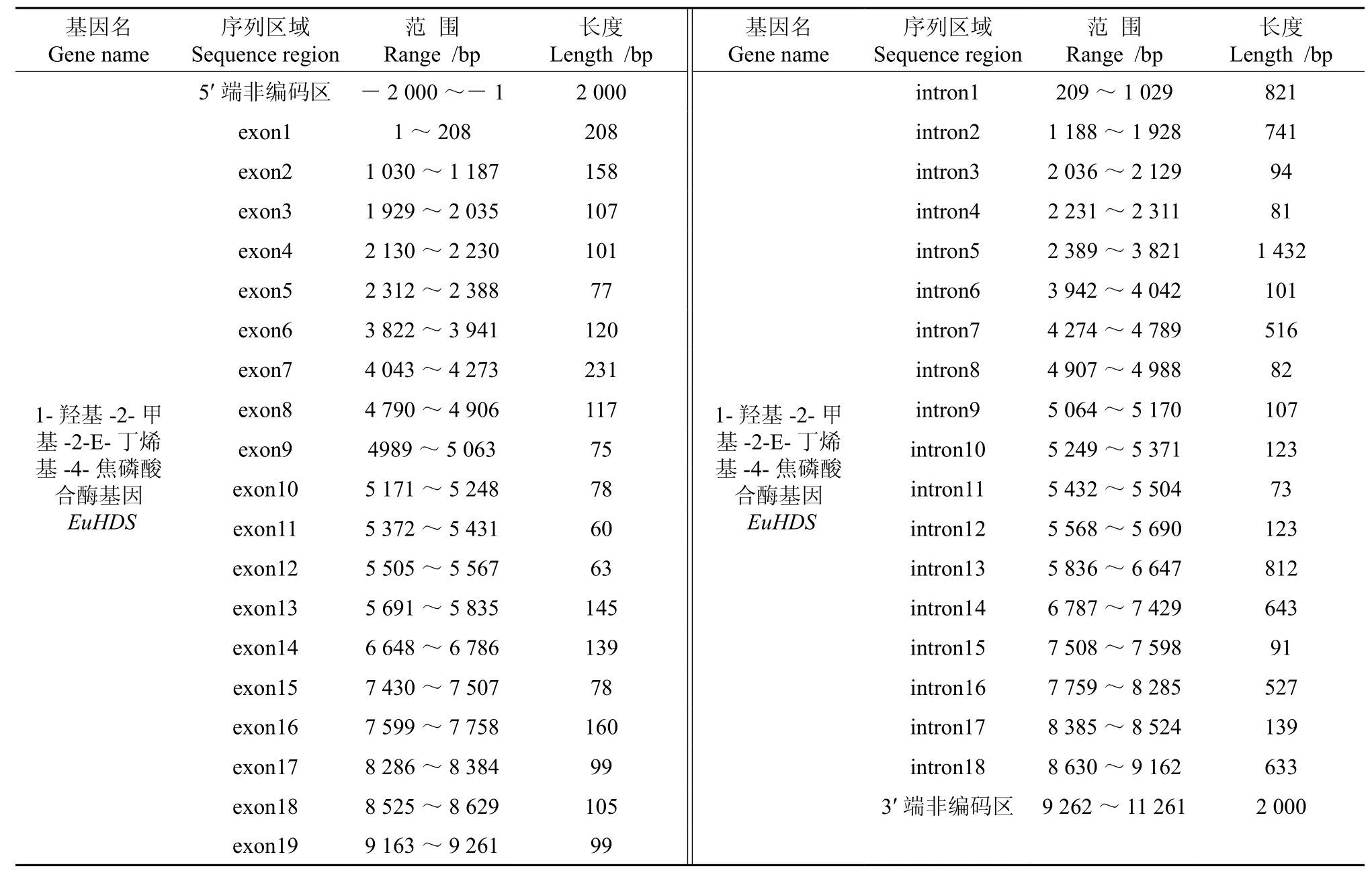
表5 EuHDS基因內含子和外顯子的分布Table 5 Distribution of the introns and exons in EuHDS

表6 EuHDR基因內含子和外顯子分布表Table 6 Distribution of the introns and exons in EuHDR
3 結論與討論
以杜仲轉錄組和基因組數據為基礎,預測了杜仲MEP途徑6條酶基因的基因結構。EuDXS是MEP途徑的第1個限速酶,EuDXS2基因5′端非編碼區的長度為1 853 bp,3′端非編碼區的長度為2 000 bp,包含9個內含子和10個外顯子,內含子的相位有7處為“0”,2處為“1”,無“2”相位;EuDXR是MEP途徑的第2個關鍵酶,EuDXR基因5′端非編碼區的長度為1 120 bp,3′端非編碼區的長度為2 163 bp,包含11個內含子和12個外顯子,內含子的相位有7處為“0”,1處 為“1”,2處 為“2”;EuCMK催化MEP途徑的羧基磷酸化反應,EuCMK基因5′端非編碼區的長度為5 000 bp,3′端非編碼區的長度為424 bp,包含10個內含子和11個外顯子,內含子的相位有7處為“0”,2處為“1”,1處為“2”;EuMDS催化MEP途徑的第5步酶促反應,EuMDS基因5′端非編碼區的長度為5 000 bp,3′端非編碼區的長度為5 000 bp,包含2個內含子和3個外顯子,內含子的相位有1處為“0”,1處為“1”;EuHDS為MEP途徑的第6個作用酶,EuHDS基因5′端非編碼區的長度為2 000 bp,3′端非編碼區的長度為2 000 bp,包含18個內含子和19個外顯子,內含子的相位有12處為“0”,3處為“1”,3處為“2”;EuHDR是MEP途徑的第3個關鍵酶,EuHDR基因5′端非編碼區的長度為1 347 bp,3′端非編碼區的長度為3 000 bp,包含8個內含子和9個外顯子,內含子的相位有5處為“0”,3處為“2”。此次結果為預測數據,基因的具體結構還需要在理論的指導下通過試驗驗證。
目前,國內有關植物MEP途徑酶基因的內含子生物信息學分析尚處于空白階段,大都停留在轉錄組水平。2012年劉攀峰[17]分離鑒定了杜仲MEP途徑系列基因的全長cDNA,并對其序列特征進行了研究, 在杜仲中發現2個DXS酶基因家族成員,EuDXS1和EuDXS2,2個DXR酶基因家族成員,EuDXR1和EuDXR2,分離出1個MCT酶基因,1個CMK酶基因,1個MDS酶基因,1個HDS酶基因,1個HDR酶基因和1個IPI基因。
2012年張祖榮[18]等人克隆獲得了黃花蒿MEP途徑的關鍵酶HDS,并進行生物信息學分析和功能互補分析研究,得到1條長2 324 bp的HDScDNA序列,生物信息學分析結果顯示,黃花蒿HDS基因與其它種子植物來源的HDS高度同源。
參考文獻:
[1] 杜紅巖,劉昌勇,李 欽,等.杜仲葉中3種主要活性成分含量的季節變化[J].中南林業科技大學學報,2011,31(8):6-7.
[2] 杜紅巖.我國的杜仲膠資源及其開發潛力與產業發展思路[J].經濟林研究,2010,28(3):1-2.
[3] 葉生晶,烏云塔娜,田大倫,等.杜仲MVA途徑相關酶基因的鑒定及熒光定量PCR引物篩選[J].中南林業科技大學學報,2013, 33(8):50-51.
[4] 李鐵柱,杜紅巖,劉慧敏,等.杜仲果實和葉片轉錄組數據組裝及基因功能注釋[J].中南林業科技大學學報,2012, 32(11):122-123.
[5] 王 征,金曉玲,劉雪梅,等.杜仲成熟胚器官發生途徑的研究[J].中南林業科技大學學報,2013,33(6):79-80.
[6] 杜紅巖,謝碧霞,邵松梅.杜仲膠的研究進展與發展前景[J].中南林學院學報,2003,23(4):95-96.
[7] 嚴瑞芳.杜仲膠研究進展及發展前景[J].化學進展,1995,(1):65-71.
[8] 杜紅巖,胡文臻,俞 銳.杜仲產業綠皮書:中國杜仲橡膠資源與產業發展報告[M].北京:社會科學文獻出版社, 2013:1-5.
[9] 薛 萍.杜仲研究現狀與發展前景[J].經濟林研究,1995,13(3): 56-57.
[10] Bohlmann J, Meyer-Gauen G, Croteau R.Plant Terpenoid synthases: Molecular Biology and Phylogenetic Analysis[J].Proc Nati Acad sci,1998,95:4126-4133.
[11] Bohlmann J, Keeling C.Terpenoid Biomaterials[J].Plant J,2008,54:656-669.
[12] Cheng AX, Lou YG, Mao YB,et al.Plant Terpenoids:Biosynthesis and Ecological Functions[J].J Integr Plant Biol,2007,49(2):179-186.
[13] Buchanan BB, Gruissem W, Russell LJ,et al.Biochemistry and Molecular Biology of Plants[M].Rockville: Am Soc of Plant Physiologists, 2000:1250-1318.
[14] 謝先芝,吳乃虎.高等植物基因的內含子[J].科學通報,2002,47(10):731-732.
[15] 陳 兵,文建凡.內含子在生物信息學研究和基因工程中的應用[J].生命的化學,2010,30(1):59-62.
[16] 叢 郁,楊順瑛,宋志忠,等.葡萄AMT基因家族生物信息學分析[J].中國農學通報,2011,27(25):193-199.
[17] 劉攀峰.杜仲MEP途徑系列基因全長cDNA分離鑒定及序列特征研究[D].北京:中國林業科學研究院,2012.
[18] 張祖榮,廖志華,彭梅芳.黃花蒿HDS基因的克隆與功能分析[J].中草藥,2012,43(1):148-149.

