殼聚糖對人子宮內膜癌細胞增殖及細胞周期的影響
張曉梅,潘 宇,魏 勉,顧方樂,呂 芳,孫 燕,董乃俊,王大新
(江蘇省蘇北人民醫院,江蘇 揚州 225001)
殼聚糖是由蝦、蟹殼提取的高分子化合物幾丁質經脫N-乙酰后衍生而成,具有良好的生物相容性和生物學活性,是一種新型的醫用生物材料[1-2]。本試驗旨在確定殼聚糖溶液在體外環境下對人子宮內膜細胞的影響,為殼聚糖作為節育器材料提供試驗依據。
1 材料與方法
1.1 材料
RPMI-1640型培養基(Sigma公司);胰蛋白酶(Difco公司);FBS(Hyclone 公司);MTT(Sigma 公司)。殼聚糖(劑型為干粉,濟南海得貝海洋生物工程有限公司,商品名為脫乙酰醫藥級殼聚糖,生產批號為魯衛食證字<2007>第370000-000052號)。人子宮內膜癌細胞Ishikawa細胞(上海復祥生物科技有限公司)Cell proliferation ELISA Kit(Roche),細胞周期與細胞凋亡檢測試劑盒(碧云天公司)。
1.2 方法
細胞培養:在37℃,5%CO2條件下,用含10%胎牛血清(FBS)的RPMI-1640培養Ishikawa細胞,每2 d更換新鮮培養基。
殼聚糖溶液配制:取殼聚糖干粉2.0 g,加入蒸餾水100 mL,再加入冰醋酸1 mL,磁力攪拌24 h,待殼聚糖完全溶解后高速離心(10 000 r/min)20 min,取上清液,得質量濃度為 20 μg/μL 的殼聚糖溶液。
MTT檢測細胞增殖:收集處于對數生長期的Ishikawa細胞,用培養基制成細胞懸液,接種于96孔板,1×104細胞/孔。24 h后加入質量濃度梯度的殼聚糖溶液,同時加入20%的FBS和5 μg/mL的阿霉素(DOX)溶液分別作為陽性對照和陰性對照,刺激48 h后加入 20 μL 的 MTT(5 g/L),繼續培養 4 h,吸棄 MTT 溶液,每孔加入150 μL的 DMSO,震蕩 10 min,使結晶物充分溶解,570 nm波長處,檢測光吸光度。
BrdU檢測DNA合成速率:收集處于對數生長期的Ishikawa細胞,用培養基制成細胞懸液,接種于96孔板,1×104個細胞/孔。24 h后加入質量濃度梯度的殼聚糖溶液,同時加入5 μg/mL的阿霉素作為陰性對照,刺激48 h后加入10 μmol/L的BrdU,孵育8 h后用Roche ELISA Kit檢測BrdU吸光度。
流式細胞儀檢測細胞周期:收集處于對數生長期的Ishikawa細胞,用培養基制成細胞懸液,接種于96孔板,1×104個細胞/孔。24 h后加入質量濃度梯度的殼聚糖溶液,同時加入5 μg/mL的DOX作為陰性對照,刺激48 h后收集細胞,70%乙醇4℃固定過夜,PI染色后上機檢測。
2 結果
2.1 殼聚糖對Ishikawa細胞增殖的影響
為了檢測不同質量濃度的殼聚糖對Ishikawa細胞生長的影響,分別用 0,0.01,0.1,1,10,50,100 μg /mL 的殼聚糖溶液刺激Ishikawa細胞 48 h,同時以 20%FBS和 5 μg/mL的 DOX處理 48 h作為陽性和陰性對照,用MTT檢測細胞增殖情況。從圖1可以看出,殼聚糖質量濃度低于 100 μg/mL時,對 Ishikawa細胞的增殖幾乎沒有明顯影響(P>0.05);而殼聚糖質量濃度為 100 μg/mL時與對照組比較,Ishikawa細胞增殖能力顯著增加(P<0.05),同時陽性對照組20%FBS細胞增殖能力也顯著增加(P<0.05),而DOX處理組細胞增殖能力極顯著降低(P<0.01)。
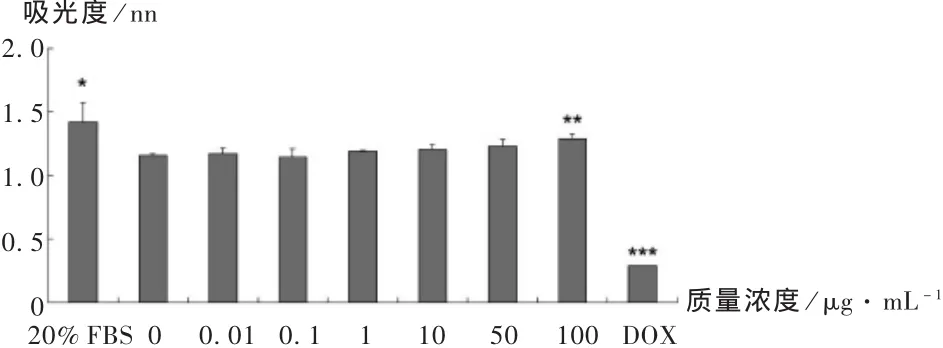
圖1 不同質量濃度殼聚糖對Ishikawa細胞增值的影響
2.2 殼聚糖對Ishikawa細胞DNA合成速率的影響
為了檢測不同質量濃度的殼聚糖對Ishikawa細胞DNA合成速率的影響,分別用 0,0.01,0.1,1,10,50,100 μg /mL 的殼聚糖溶液處理Ishikawa細胞48 h,同時用5 μg/mL的阿霉素處理48 h作為陰性對照,加入 1 μmol/L的 BrdU孵育 8 h,用 Roche ELISA Kit檢測。從圖2可以看出,低質量濃度的殼聚糖(不大于10 μg/mL)時,與對照組比較,試驗組Ishikawa細胞的DNA合成速率沒有顯著性變化(P >0.05);而殼聚糖質量濃度達到 100 μg/mL 時,對細胞 DNA的合成速率有顯著的促進作用(P<0.05)。同時,DOX處理組 DNA合成速率顯著降低(P<0.01)。
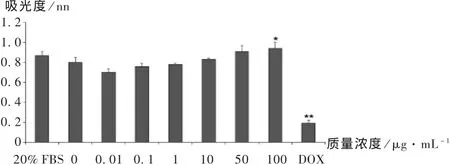
圖2 不同質量濃度殼聚糖對Ishikawa細胞DNA合成速率的影響
2.3 殼聚糖對Ishikawa細胞周期的影響
為了檢測不同質量濃度的殼聚糖對Ishikawa細胞周期的影響,分別用 0,0.1,1,10 μg/mL 的殼聚糖溶液刺激 Ishikawa 細胞48 h,同時用5 μg/mL的阿霉素刺激48 h作為陰性對照,收集的細胞用70%的乙醇于4℃固定過夜,隨后PI染色,用流式細胞儀檢測各組細胞的細胞周期分布。從表1和圖3可以看出,≤10 μg/mL質量濃度殼聚糖對Ishikawa細胞的細胞周期幾乎沒有影響(P > 0.05),即 0.1,1,10 μg/mL 質量濃度殼聚糖處理組的細胞G1期,S期以及G2期與對照組比較無顯著性變化。而DOX處理組細胞無S期,同時G1期,G2期顯著延長,與對照組比較有顯著性差異(P <0.05)。
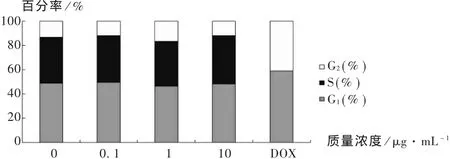
圖3 不同質量濃度殼聚糖對Ishikawa細胞周期的影響
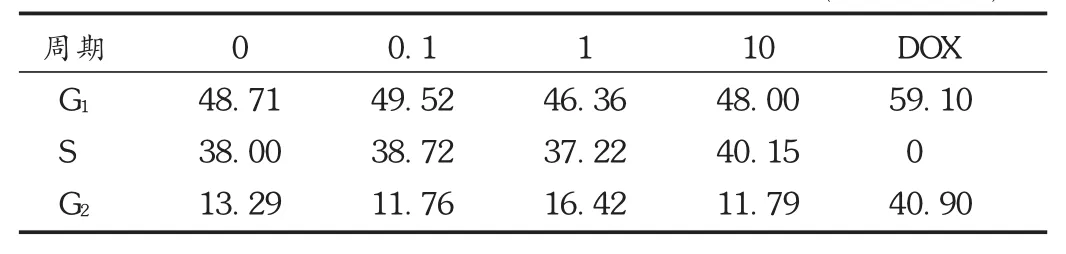
表1 不同質量濃度殼聚糖對Ishikawa細胞周期的影響(百分率/%)
3 討論
殼聚糖是利用蝦蟹外殼廢棄物質制成的天然高分子化合物,具有良好的生物相容性,可在人體內完全吸收,無毒副作用,具有廣闊的臨床應用前景[3-4]。體外試驗和動物試驗表明,殼聚糖具有選擇性抑制成纖維細胞、平滑肌細胞增殖和促進表皮細胞、內皮細胞的生長[5-7],但對人子宮內膜細胞的影響尚未見文獻報道。
在本研究中,首先通過MTT比色法檢測了殼聚糖對Ishikawa細胞毒性的影響,發現僅當殼聚糖溶液質量濃度達到100 μg/mL時才能輕微地促進Ishikawa細胞的生長,而當殼聚糖質量濃度低于100 μg/mL時,對細胞的生長無明顯的影響。同時,用BrdU摻入法來檢測殼聚糖溶液對Ishikawa細胞DNA合成的影響,試驗表明,殼聚糖溶液質量濃度高于50 μg/mL后,Ishikawa細胞DNA合成速率有輕微增加,但低于50 μg/mL時對DNA合成速率則無明顯影響。MTT和BrdU試驗結果中,殼聚糖影響Ishikawa細胞的最低質量濃度有所不同,其原因可能在于MTT比色法是從細胞水平來進行評價,而BrdU摻入法則是從分子水平來進行評價,故兩種方法的靈敏度不同。綜合考慮,選擇不影響Ishikawa細胞生長的最低殼聚糖溶液質量濃度為10 μg/mL。最后,又用不同質量濃度的殼聚糖溶液處理Ishikawa細胞后,PI(碘化丙啶)染色,細胞流式儀檢測細胞周期分布,其結果與前面結果一致,即當殼聚糖溶液質量濃度低于10 μg/mL時,對Ishikawa細胞周期沒有明顯影響。
綜上所述,低濃度的殼聚糖溶液(≤10 μg/mL)對人子宮內膜癌細胞Ishikawa的生長、增殖、細胞周期都沒有明顯影響,這一特性使得殼聚糖可以作為宮內節育器的支架。
[1]于 飛,奚延斐,張姝江,等.具有垂直孔道的殼聚糖乳酸鹽海綿的制備及體外釋藥模型的擬合分析[J].高等學校化學學報,2012,33(4):843-849.
[2]崔惠素,石 巍.殼聚糖生物性能及用于細菌性陰道病的探索與研究[J].中國醫療器械雜志,2012,36(2):96-98,113.
[3]陳艷玲.萘普生殼聚糖凝膠的處方優選[J].齊齊哈爾醫學院學報,2012,33(1):65-66.
[4]惠光艷,吳廣升,關繼東,等.殼聚糖溫敏凝膠與富含血小板血漿共混后的微觀結構[J].實用醫藥雜志,2012,29(1):58-60.
[5]何 秉,程明榮,陳厚祥,等.半乳糖基殼聚糖5氟尿嘧啶納米粒的制備及其抑制小鼠結腸癌的實驗研究[J].中國臨床醫學,2011,18(6):738-741.
[6]葛月賓,李孟順,梅之南.大豆苷元-殼聚糖微球對去卵巢小鼠骨質疏松的藥效研究[J].時珍國醫國藥,2011,22(12):2 963-2 965.
[7]邢桂榮,王敬湘.殼聚糖在醫藥領域的研究進展[J].中國藥業,2003,12(8):74-75.

