藥物洗脫支架置入術后支架內再狹窄的血管內超聲觀察
王天松,馮旭霞,姚震
藥物洗脫支架置入術后支架內再狹窄的血管內超聲觀察
王天松,馮旭霞,姚震
目的:通過藥物洗脫支架(DES)置入術后支架內再狹窄的血管內超聲觀察,探討斑塊成分及其形成原因。
冠狀動脈疾病;藥物洗脫支架;冠狀動脈再狹窄;血管內超聲
(Chinese Circulation Journal, 2013,28: 348.)
藥物洗脫支架 (DES)的應用使支架內再狹窄有所減少,但仍然有相當比例的存在。因此,再狹窄是一個持續存在尚未完全解決的問題,其發生機制和進展過程仍未完全闡明。本研究采用血管內超聲虛擬組織學檢查評價再狹窄病變,探討支架內再狹窄的發生機制。
1 資料與方法
研究對象:對 2006-10 至 2012-12 我院 64 例 DES置入術后隨訪定量冠狀動脈(冠脈)造影估測狹窄>50% 的患者進行血管內超聲虛擬組織學檢查。排除標準:血流動力學不穩定;狹窄過重或血管扭曲,血管內超聲導管不能通過狹窄病變;左主干或靜脈橋血管病變;急性心肌梗死。64例中4例因支架擴張不完全而非內膜增生導致的再狹窄被排除,最終納入60例患者,其中穩定型冠心病 25 例(SCAD 組),非 ST 段抬高的急性冠脈綜合征 35 例(NSTEACS 組)。2 組除術前肌鈣蛋白 I峰值差異有統計學意義外(P< 0.05),其余一般臨床特征均差異無統計學意義(P>0.05),見表1。本研究方案獲得我院醫學倫理委員會的批準并且符合世界醫學協會聯合國大會修訂的赫爾辛基宣言的精神。

表1 2 組一般臨床特征
手術方法與數據采集:冠狀動脈造影后,選擇狹窄程度最大的一幀圖像應用定量冠狀動脈造影技術測量狹窄程度。再狹窄定義為:血管直徑狹窄>50%。分類[1]:I 型:病變長度≤ 10 mm,位于支架交界處未被支架覆蓋、支架內、支架近遠端邊緣處、或上述各種情況的組合;II型:病變長度> 10 mm,不超出支架兩端;III型:病變長度> 10 mm,并超出支架兩端;IV 型:再狹窄造成完全閉塞,心肌梗死溶栓治療臨床試驗(TIMI)血流 0 級。血管內超聲檢查前,先經指引導管向冠脈內注射 0.2 mg 硝酸甘油,再將帶有 20-MHz 電子傳感器的 2.9F Eagle Eye 血管內超聲導管 (Volcano Corp, Rancho Cordova, CA)沿導絲送至狹窄遠端參考血管,使用自動回撤裝置以 0.5 mm/s的速度邊回撤邊掃描至支架近端參考血管。
血管內超聲虛擬組織學分析:應用 Volcano 血管內超聲儀檢查支架近遠端 5 mm 范圍內的血管,每間隔 1 mm 測量 1 次。使用虛擬組織學軟件分析支架內緣與管腔外緣之間各斑塊成分的體積、比例:纖維組織顯示為綠色,纖維脂肪組織為黃綠色,鈣化成分為白色,壞死組織為紅色。支架擴張不完全定義為:最小支架內面積 <5 mm2。薄層纖維帽硬化斑塊(TCFA)定義為[2,3]:在管腔橫截面斑塊負荷大于 40%的血管段,連續3幀血管內超聲虛擬組織學圖像上融合的壞死核大于斑塊面積的 10%,壞死核與管腔直接接觸,表面沒有纖維帽,鈣化少于 10%。
統計分析:采用 SPSS 11.0 版統計軟件。計量資料表示為中位數及四分位數間距;計數資料用頻數(或百分位數)表示。計量資料的比較采用秩和檢驗,計數資料的比較采用 χ2檢驗。P<0.05(雙側)為差異有統計學意義。
2 結果
2 組隨訪時病變基本特征比較:與 NSTEACS 組比,SCAD 組除隨訪時間較短、TCFA 發生率較低、斑塊體積較小、纖維脂肪組織比例較低、壞死組織比例較低、肌酸激酶MB同工酶水平較低,差異均有統計學意義外(均 P< 0.05),其它病變基本特征差異均無統計學意義(P>0.05)。表2
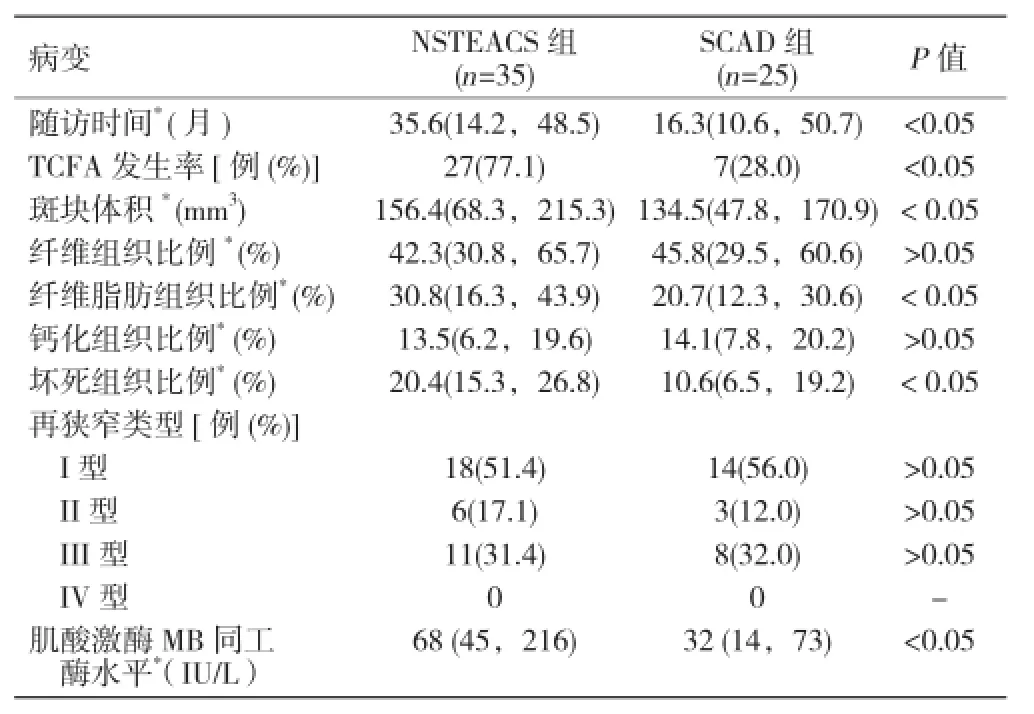
表2 2 組隨訪時病變基本特征比較
60例患者不同隨訪時間的病變基本特征比較:與隨訪時間 >20 個月比,隨訪時間 < 20 個月除TCFA 發生率較低、斑塊體積較小、纖維脂肪組織比例較低、壞死組織比例較低,差異均有統計學意義外(均 P< 0.05),其它病變基本特征差異均無統計學意義(P>0.05)。表3
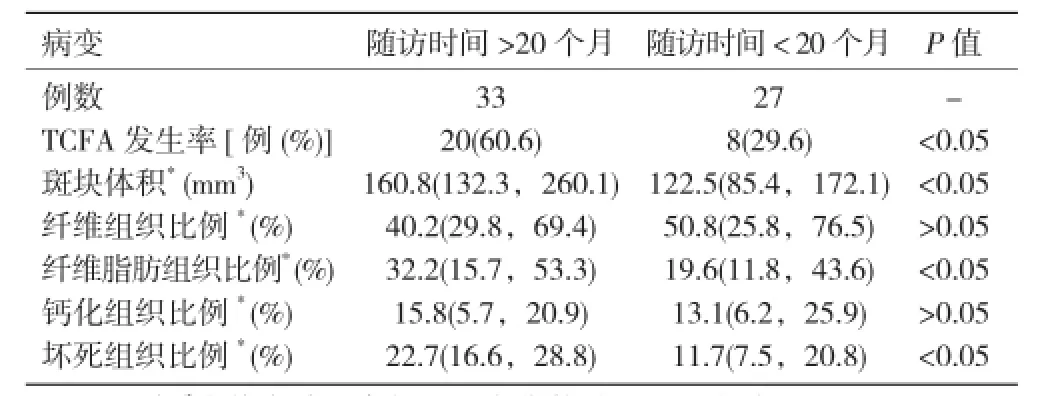
表3 60 例患者不同隨訪時間的病變基本特征比較
3 討論
DES時代,支架內再狹窄仍然是一個重要的問題,尤其是在有糖尿病等高危因素存在時更加顯著[4]。Kang 等[5]的研究認為,再狹窄的主要機制是血管內膜過度增生。但該研究應用的是灰階血管內超聲檢查,因此并不能準確地從影像上區分內膜增生和新生粥樣硬化斑塊。本研究應用了血管內超聲虛擬組織學技術,彌補了灰階血管內超聲的缺陷,結果發現再狹窄患者廣泛存在支架內新生粥樣硬化斑塊現象,而且隨訪時間越長,新生粥樣硬化斑塊體積越大。這些發現對揭示 DES置入術后支架內再狹窄的機制有重要意義。DES術后支架內可形成新生粥樣硬化斑塊,這一現象表明,動脈粥樣硬化的進程從未停止,從支架置入的那一刻開始,高血糖[6]、血脂異常、高血壓、內皮功能障礙等因素促進動脈粥樣硬化的作用與支架所攜帶藥物的抑制增生作用就交織在一起,金屬支架和聚合物涂層引起的炎癥反應也參與其中。當藥物不能有效抑制促動脈粥樣硬化因素的效應時,新生粥樣硬化斑塊將逐漸形成,而且隨時間不斷進展,成為導致支架內再狹窄的重要機制之一。根據上述推論,解決再狹窄問題首先要更多了解促進動脈粥樣硬化危險因素的種類及作用機制,尋找更加有效的治療手段,對已知的危險因素應進行更加嚴格地控制;其次,應開發新型支架和涂層材料,以減少炎癥反應;最后,應不斷尋找更加有效的藥物來提高 DES 的療效,因為 Le 等[7]的研究已經提示部分患者存在針對紫杉醇等藥物的抵抗現象。
DES術后晚期發生的急性冠脈綜合征引起了越來越多地關注。對于其發生機制多數研究將焦點放在支架內皮化不全誘發晚期血栓形成方 面[8,9]。 然 而 本 研 究 發 現,DES 術 后 晚 期 大 部分 NSTEACS 患者可見支架內新生 TCFA。TCFA容易發生纖維帽破裂誘發血栓形成從而導致NSTEACS[10]。 因 此, 這 一 發 現 表 明 TCFA 的 形 成和破裂是 DES 術后發生 NSTEACS 的重要機制之一。此外,隨訪時間越長,TCFA 越多這一現象提示新生粥樣硬化斑塊在形成初期很可能只是慢性穩定性斑塊,在某些因素作用下逐漸演變成了TCFA。上述發現對 DES 術后 NSTEACS 的防治具有指導意義。首先,術后晚期發生 NSTEACS 的患者,在病因方面除支架貼壁不良、支架內皮化不全、血管正性重構之外,還要考慮不穩定新生粥樣硬化斑塊的因素,因此,必須經影像學檢查確定病因后給予對應處理才能取得滿意療效;其次,為預防 TCFA 的形成,應更多地研究哪些因素促使穩定斑塊向 TCFA 轉化,并尋找相應的控制手段;最后,本研究還發現,28.0% 的 SCAD 患者再狹窄病變內存在 TCFA 但并未發生 NSTEACS,這一現象表明 DES 術后 NSTEACS 的形成除 TCFA 外還需要其他因素的參與,進一步尋找這些影響因素并給予有效控制是未來研究的方向。
本研究發現,DES 術后 NSTEACS 組比 SCAD組斑塊體積更大、壞死及纖維脂肪成分比例更高,隨訪時間越長,壞死、纖維脂肪成分比例越高,這與以往的研究結果相似[11,12];這些 患者經皮冠狀動脈介入治療術后肌酸激酶MB同工酶峰值增高,這與 原 位 血 管 的 研 究 結 果 相 似[13]。 肌 酸 激 酶 MB 同工酶峰值的增高表明可能存在圍術期心肌梗死,是預 后不 良的 預測因子[14]。 上述發 現提 示 DES 術后NSTEACS 患者進行經皮冠脈介入治療時應注意預防圍術期心肌梗死。目前認為這種心肌梗死的可能機制包括支架置入后部分小動脈開口被移行的斑塊成份堵塞;斑塊被擠壓破裂,其中的壞死組織、脂肪成份和血栓脫落形成微栓子,隨血流到達遠端微血管引起栓塞導致心肌細胞缺血壞死[15];破裂斑塊內包含的自由基等活性物質釋放入血也可能造成心肌損傷[16]。為了更好地防治圍術期心肌梗死,首先應更多地探索其發生機制并尋找有效的控制手段;其次,應探討針對微栓塞采取遠端保護裝置等必要的措施進行預防的可行性;最后,針對自由基等活性物質的損傷作用尋找有效的預防方法,是未來研究的方向。
總之,DES置入術后新生粥樣硬化斑塊廣泛存在,可能是導致支架內再狹窄的重要機制之一;而TCFA 的形成和破裂可能是 DES 術后發生 NSTEACS的重要機制之一。由于本研究是一個回顧性研究,因此不能精確反應 DES置入后內膜增生及斑塊形成的全過程。研究納入的樣本量較小,可能使結果存在偏差。因此,上述結論需要更多前瞻性、大規模臨床試驗進一步證實。
[1]Mehran R, Dangas G, Abizaid AS, et al. Angiographic patterns of instent restenosis: classification and implications for long-term outcome. Circulation, 1999, 100: 1872-1878.
[2]Rodriguez-Granillo GA, Garcia-Garcia HM, Mc Fadden EP, et al. In vivo intravascular ultrasound-derived thin-cap fibroatheroma detection using ultrasound radiofrequency data analysis. J Am Coll Cardiol, 2005, 46: 2038-2042.
[3]Hong MK, Mintz GS, Lee CW, et al. A three-vessel virtual histology intravascular ultrasound analysis of frequency and distribution of thincap fibroatheromas in patients with acute coronary syndrome or stable angina pectoris. Am J Cardiol, 2008, 101: 568.
[4]Zahn R, Hamm CW, Schneider S, et a1. Coronary stenting with the sirolimus-eluting stent in clinical practice: final results from the prospective multicenter German cypher stent registry. J Interv Cardiol, 2010, 23: 18-25.
[5]Kang SJ, Mintz GS, Park DW, et a1. Mechanisms of in-stent restenosis after drug-eluting stent implantation intravascular ultrasound analysis. Circ Cardiovasc Interv, 2011, 4: 9-14.
[6]金琴花 , 王禹 , 蓋魯粵 , 等 . 冠狀動脈介入治療后造影復查支架再狹窄結果分析 . 中國循環雜志 , 2008, 23: 411-414.
[7]Le XF, Bast RC. Scr family kinases and paclitaxel sensitivity. Cancer Biol Ther, 2011, 12: 260-269.
[8]Camenzind E, Wijns W, Mauri L, et a1. Stent thrombosis and major clinical events at 3 years after zotarolimus-eluting or sirolimus-eluting coronary stent implantation: a randomised, multicentre, open-label, controlled trial. Lancet, 2012, 380: 1396-1405.
[9]竇克非 , 尹棟 , 吳元 , 等 . 冠心病合并糖尿病患者置入雷帕霉素洗脫支架和紫杉醇洗脫支架長期有效性及安全性觀察 . 中國循環雜志 , 2012, 27: 174-177.
[10]Calvert PA, Obaid DR, O'Sullivan M, et a1. Association between IVUS findings and adverse outcomes in patients with coronary artery disease: the VIVA (VH-IVUS in Vulnerable Atherosclerosis) Study. JACC Cardiovasc Imaging. 2011, 4: 894-901.
[11]Kang SJ, Mintz GS, Akasaka T, et al. Optical coherence tomographic analysis of in-stent neoatherosclerosis after drug-eluting stent implantation. Circulation, 2011, 123: 2954-2963.
[12]金至賡 , 劉惠亮 , 張卓奇 , 等 . 血管內超聲虛擬組織學成像評價可降解涂層雷帕霉素洗脫支架對冠狀動脈壁的影響 . 中國循環雜志 , 2012, 27: 13-16.
[13]Rodriguez-Granillo GA, McFadden EP, Valgimigli M, et al. Coronary plaque composition of nonculprit lesions, assessed by in vivo intracoronary ultrasound radio frequency data analysis, is related to clinical presentation. Am Heart J, 2006, 151: 1020-1024.
[14]Lindsey JB, Kennedy KF, Stolker JM, et a1. Prognostic implications of creatine kinase-MB elevation after percutaneous coronary intervention: results from the Evaluation of Drug-Eluting Stents and Ischemic Events (EVENT) registry. Circ Cardiovasc Interv, 2011, 4: 474-480.
[15] Patti G, Pasceri V, Nusca A, et a1. Prevention of periprocedural myocardial damage in patients undergoing percutaneous coronary intervention. Ital Heart J Suppl, 2005, 6: 553-560.
[16]Ang L, Thani KB, Ilapakurti M, et a1. Elevated plasma fibrinogen rather than residual platelet reactivity after clopidogrel pre-treatment is associated with an increased ischemic risk during elective percutaneous coronary intervention. J Am Coll Cardiol, 2013, 61: 23-34.
Intravascular Ultrasound Observation for In-Stent Re-Stenosis in Patients After Drug Eluting Stent Implantation
WANG Tian-song, FENG Xu-xia, YAO Zhen.
Department of Cardiology, People’s Hospital of Sanya, Sanya (572000), Hainan, China
WANG Tian-song, Email: wts0425@163.com
Objective: To explore the coronary plaque composition by intravascular ultrasound (IVUS) observation for in-stent re-stenosis (ISR) in patients after drug eluting stent (DES) implantation.Methods: A total of 60 patients with quantitative coronary angiography confirmed ISR were divided into 2 groups as non-ST elevated acute coronary syndrome (NSTEACS) group, n=35 and stable coronary artery disease (SCAD) group, n=25. The ISR lesions were evaluated by IVUS virtual histology in both groups.Results: For basic characteristics of the lesion: compared with NSTEACS group, the patients in SCAD group had the shorter follow-up time, lower incidence of IVUS-defined thin-cap fibroatheroma (TCFA), smaller plaque volume, lower ratio of fibro-lipid tissue, lower ratio of necrotic core, lower level of CK-MB, all P<0.05; and the other characteristics were similar, P>0.05. For basic characteristics at different followed-up time: compared with DES implantation>20 months, the patients with DES implantation<20 months presented the lower incidence of TCFA, smaller plaque volume, lower ratio of fibro-lipid tissue, lower ratio of necrotic core, all P<0.05; and the other characteristics were similar, all P>0.05.Conclusion: The neoatherosclerotic plaque may be one of the important reasons for ISR in patients after DES implantation. TCFA formation and rupture could cause NSTEACS after DES implantation.
Coronary artery disease; Drug eluting stent; Coronary re-stenosis; Intravascular ultrasound
2013-04-24)
(編輯:王寶茹)
572000 海南省,三亞市人民醫院 心內科
王天松 副主任醫師 碩士 主要從事冠心病介入診療和易損斑塊的識別與治療研究 Email: wts0425@163.com 通訊作者:王天松
R54
A
1000-3614(2013)05-0348-04
10.3969/j.issn.1000-3614.2013.05.009
方法:入選 60 例定量冠狀動脈造影確認為支架內再狹窄的患者,根據臨床表現分為非 ST 段抬高的急性冠脈綜合征 35 例 (NSTEACS 組)和穩定性冠心病 25 例(SCAD 組)。用血管內超聲虛擬組織學檢查評價再狹窄處病變。
結果:2 組隨訪時病變基本特征比較:與 NSTEACS 組比,SCAD 組除隨訪時間較短、薄層纖維帽硬化斑塊(TCFA)發生率較低、斑塊體積較小、纖維脂肪組織比例較低、壞死組織比例較低、肌酸激酶MB同工酶水平較低,差異均有統計學意義外(均 P< 0.05),其它病變基本特征差異均無統計學意義(P>0.05)。60 例患者不同隨訪時間的病變基本特征比較:與隨訪時間 >20 個月比,隨訪時間 < 20 個月除 TCFA 發生率較低、斑塊體積較小、纖維脂肪組織比例較低、壞死組織比例較低,差異均有統計學意義外(均 P< 0.05),其它病變基本特征差異均無統計學意義(P>0.05)。
結論:新生粥樣硬化斑塊可能是 DES置入術后支架內再狹窄的重要機制之一,TCFA 的形成和破裂可能是 DES術后發生 NSTEACS 的重要機制之一。

