凍藏方式對(duì)豬肉肌原纖維蛋白氧化及凝膠特性的影響
潘君慧,劉澤龍
(1.浙江省亞熱帶作物研究所,浙江溫州325005;2.中糧營(yíng)養(yǎng)健康研究院,北京100020)
凍藏肉是目前肉類產(chǎn)品進(jìn)出口貿(mào)易和地區(qū)間流通的主要產(chǎn)品形態(tài),也是我國(guó)肉制品未來(lái)發(fā)展的方向之一。在凍藏過(guò)程中,肉制品的質(zhì)構(gòu)、風(fēng)味、顏色會(huì)發(fā)生不可逆轉(zhuǎn)的劣變。近年的研究證據(jù)顯示,除了脂質(zhì)的氧化,蛋白冷凍變性外,蛋白氧化也是導(dǎo)致凍藏肉品品質(zhì)劣化的重要原因[1-2]。在肉及肉制品中,肌原纖維蛋白作為主要蛋白質(zhì),對(duì)肉蛋白功能尤其是凝膠性起主要作用。肌原纖維蛋白對(duì)活性氧的攻擊非常敏感,受氧化后其結(jié)構(gòu)會(huì)發(fā)生顯著改變?nèi)缧纬傻鞍拙奂w等,而這些現(xiàn)象均會(huì)使蛋白質(zhì)的凝膠性發(fā)生較大變化[3]。因此,尋找合適的措施控制凍藏過(guò)程的氧化,并且保持凍藏肉肉品品質(zhì)和蛋白功能具有重要研究意義。本文從實(shí)際體系研究出發(fā),主要討論了三種包裝處理的凍藏肉中肌原纖維蛋白的凝膠特性,以闡明儲(chǔ)藏方式對(duì)肌肉蛋白凝膠功能性質(zhì)的影響。
1 材料與方法
1.1 材料與儀器
實(shí)驗(yàn)用肉 實(shí)驗(yàn)選取新鮮豬后腿肉(購(gòu)于當(dāng)?shù)貥?lè)購(gòu)超市,宰后1d),經(jīng)過(guò)剔除筋膜后通過(guò)三遍切片機(jī)切片切丁(10mm×10mm×10mm),混勻后取部分肉(或提取肌原纖維蛋白)作為空白進(jìn)行相關(guān)指標(biāo)的測(cè)定,其余部分分裝后按三種方式包裝:1號(hào)處理為普通密封包裝、2號(hào)處理為混合添加抗壞血酸、α-生育酚和茶多酚(各0.2%,w/w)后進(jìn)行普通密封包裝、3號(hào)處理為真空密封包裝,樣品被放入-18℃冰箱儲(chǔ)藏放置24周,并在第2、4、8及24周各取樣約20 g進(jìn)行分析。
超純水 美國(guó)Millipore公司;2,4-二硝基苯肼(DNPH) 美國(guó)Sigma公司;其它試劑(分析純) 國(guó)藥集團(tuán)化學(xué)試劑有限公司。
UV-2800H型紫外可見(jiàn)分光光度計(jì) 尤尼柯(上海)儀器有限公司;BVPJ-500TS真空包裝機(jī) 嘉興艾博不銹鋼機(jī)械工程有限公司;DS-1高速組織搗碎機(jī) 上海精科實(shí)業(yè)有限公司;Avanti J-26 XP高速冷凍離心機(jī) 美國(guó)Beckman公司;AR1000流變儀英國(guó)TA Instrument公司;T18 basic高速均質(zhì)機(jī) 英國(guó)IKA公司。
1.2 實(shí)驗(yàn)方法
1.2.1 肌原纖維蛋白的提取 凍藏肉在4℃經(jīng)過(guò)6h解凍,用5倍提取緩沖液(0.1mol/L NaCl,2mmol/L MgCl2,1mmol/L EDTA,10mmol/L K2HPO4,pH7.0)勻漿后離心(2000g,10min),重復(fù)四次并在第四次離心前用四層紗布過(guò)濾并將pH調(diào)至6.0,最后得到的蛋白膏保存于冰盒中備用。蛋白濃度用雙縮脲法測(cè)定。
1.2.2 羰基的測(cè)定 參考Levine等人測(cè)定羰基含量的方法,讀取樣品在370nm下的吸光值,蛋白質(zhì)羰基衍生物的含量(nmol/mg蛋白)使用摩爾吸光系數(shù)為22000M-1cm-1計(jì)算[4]。
1.2.3 K-ATP酶活性的測(cè)定 參考Katoh等人[5]的方法,測(cè)定 K-ATPase酶活。酶活力表示為:μmol Pi/mg蛋白/10min。
1.2.4 蛋白凝膠流變學(xué)特性的測(cè)定 使用流變儀測(cè)定肌原纖維蛋白在程序升溫和降溫過(guò)程中凝膠形成所產(chǎn)生的力學(xué)變化。設(shè)定的主要參數(shù)是:采用4cm直徑的平板夾具,對(duì)混合蛋白進(jìn)行溫度掃描,以2℃/min的速率從20℃升至75℃,每個(gè)溫度點(diǎn)的平衡時(shí)間為30s,最大應(yīng)變力為0.02,單頻頻率為0.1Hz,狹縫為1mm。在平板夾具上蓋好保護(hù)蓋并滴加硅油密封后進(jìn)行測(cè)定。
1.2.5 蛋白凝膠的制備 將5g濃度為30mg/mL肌原纖維蛋白溶液置于瓶底玻璃管中(50mm×20mm)離心(800g,1min,4℃)除去氣泡,然后置于恒溫水浴鍋中,從20℃開(kāi)始以1.2℃/min的速率升溫,至75℃時(shí)取出迅速置于冰浴中冷卻。
1.2.6 蛋白凝膠持水性 凝膠(約5g,記為W1)在4℃靜置過(guò)夜后,移至50mL的離心管中并記重(W2),離心(10000g,15min,4℃)。倒掉離心出的水,將離心管倒置于鋪有吸水紙巾的桌面上,15min后稱重(W3)。蛋白凝膠持水性計(jì)算如下:

1.2.7 數(shù)據(jù)統(tǒng)計(jì) 本實(shí)驗(yàn)所有數(shù)據(jù)均為2次重復(fù)3次平行。數(shù)據(jù)處理使用Statistix 9.0軟件進(jìn)行方差分析和顯著性分析(LSD法),不同顯著性數(shù)據(jù)用不同字母標(biāo)記。
2 結(jié)果與討論
2.1 凍藏肉儲(chǔ)藏過(guò)程中蛋白羰基與酶活變化
由圖1中可見(jiàn),普通密封包裝樣品的蛋白羰基含量均高于其他兩種處理方式;在儲(chǔ)藏8周內(nèi),復(fù)合抗氧化劑的添加使得蛋白羰基維持在比較低的水平(p>0.05),隨著儲(chǔ)藏時(shí)間的延長(zhǎng),由于抗氧化劑的消耗,蛋白羰基有所增加。另外,也還可能由于儲(chǔ)藏過(guò)程中抗壞血酸轉(zhuǎn)變?yōu)槊摎淇箟难崤c肌肉中的微量過(guò)氧化氫和鐵離子形成金屬催化氧化體系,加劇了蛋白在儲(chǔ)藏后期的氧化[3,6]。而氧氣的去除(3號(hào))可以有效抑制儲(chǔ)藏期間蛋白羰基的生成(p>0.05)。

圖1 凍藏及不同包裝處理對(duì)肌原纖維蛋白羰基含量的影響Fig.1 Effect of frozen storage on protein carbonyl content of myofibrillar protein in muscle by different packaging treatments
從圖2中可以看出,由于肌球蛋白頭部酶活性對(duì)氧化很敏感,1號(hào)和3號(hào)樣品的肌球蛋白的ATP酶活和文獻(xiàn)報(bào)道相一致:總體都呈現(xiàn)出下降的趨勢(shì),表明肌球蛋白頭部構(gòu)象的變化[7-8]。除氧化影響外,酶活的損失可能更多的與在冷凍和解凍過(guò)程中內(nèi)源蛋白酶類對(duì)肌球蛋白頭部水解有關(guān)[9]。在2號(hào)處理中,為抑制氧化而添加的復(fù)合抗氧化劑并未起到穩(wěn)定肌球蛋白構(gòu)象的作用,反而在儲(chǔ)藏前期,直接或者間接影響了肌球蛋白頭部活性區(qū)域的氨基酸殘基,抑制了肌球蛋白的ATP酶活。

圖2 不同包裝處理凍藏后對(duì)肌球蛋白K-ATP酶活性的影響Fig.2 Effect of different packaging treatments on myosin K-ATPase activity during 24-week frozen storage
2.2 凍藏后的肌原纖維蛋白凝膠流變特性
三種處理肉肌原纖維蛋白的流變學(xué)特征(彈性模量,G')見(jiàn)圖3。空白樣品的流變曲線顯示,在45~50℃有一次凝膠轉(zhuǎn)變,隨后在50~57℃有一個(gè)肩峰為第二次凝膠轉(zhuǎn)變。第一次凝膠轉(zhuǎn)變過(guò)程中,主要由于肌球蛋白重酶解肌球蛋白變性[10],蛋白間的相互作用增強(qiáng),蛋白開(kāi)始聚集,凝膠網(wǎng)絡(luò)開(kāi)始形成。G'在47~50℃的下降,主要原因在于肌球蛋白的輕酶解肌球蛋白部分發(fā)生變性,并導(dǎo)致了肌球蛋白絲流動(dòng)性的上升。隨著溫度繼續(xù)增加,肌球蛋白凝膠加速形成,肌動(dòng)蛋白變性增強(qiáng)凝膠強(qiáng)度使得彈性模量持續(xù)上升。
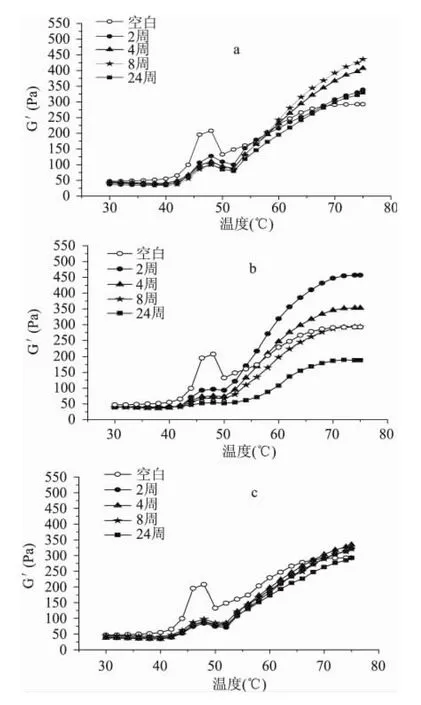
圖3 三種處理樣品凍藏后肌原纖維蛋白凝膠的彈性模量變化Fig.3 Changes in storage modulus of myofibrillar protein gel made from three treatment samples during frozen storage
從圖3可以看出,經(jīng)過(guò)凍藏以后,三種樣品第一個(gè)凝膠轉(zhuǎn)變溫度的蛋白變性峰均有不同程度減弱,證實(shí)了在冷凍過(guò)程中肌球蛋白頭部均發(fā)生了部分變性。根據(jù)終貯能模量(終G')所示,樣品的凝膠能力均呈現(xiàn)先增強(qiáng)后減弱的趨勢(shì),以1號(hào)和2號(hào)樣品更為明顯。此外,通過(guò)圖3a與3c的比較,可以發(fā)現(xiàn)凍藏時(shí)間對(duì)3號(hào)樣品肌原纖維蛋白凝膠的流變特性影響不大,這也與圖1中蛋白羰基變幅不大相對(duì)應(yīng);而圖3a中不同時(shí)間的儲(chǔ)藏對(duì)蛋白凝膠的形成有明顯影響,由于1號(hào)樣品中未除去氧氣,可以斷定氧化是重要的影響因素。另外,肌球蛋白頭部的氧化并未影響凝膠最終強(qiáng)度,結(jié)合文獻(xiàn)報(bào)道推斷凍藏過(guò)程中的肌球蛋白尾部的氧化影響了凝膠的終點(diǎn)彈性模量[10]。
2.3 凍藏后肌原纖維蛋白凝膠持水性
由圖4可見(jiàn),在2~4周后,1號(hào)、2號(hào)樣品凝膠持水力相比空白樣品有顯著降低。已知蛋白凝膠通過(guò)毛細(xì)作用和蛋白水合作用束縛水分。雖然以上樣品由于蛋白氧化增強(qiáng)了肌原纖維蛋白的凝膠能力,但較高程度的氧化可能會(huì)破壞精細(xì)網(wǎng)絡(luò)結(jié)構(gòu)的形成,反而降低了凝膠網(wǎng)絡(luò)束縛水分的能力[10]。在三種樣品中,2號(hào)樣品的凝膠持水性降低尤為顯著,這可能由于2.1中提到的脫氫抗壞血酸參與下的金屬催化氧化體系,以及形成了四價(jià)鐵血紅蛋白自由基而加速了蛋白肌原纖維蛋白氧化[3]。真空包裝樣品(3號(hào))在儲(chǔ)藏期內(nèi)的凝膠持水力變化幅度較小,且到24周還略有升高。這可能由于此時(shí)蛋白殘基的氧化修飾改變了蛋白表面電荷以及氫鍵,反而使肌原纖維蛋白的水合能力略有增加[11]。
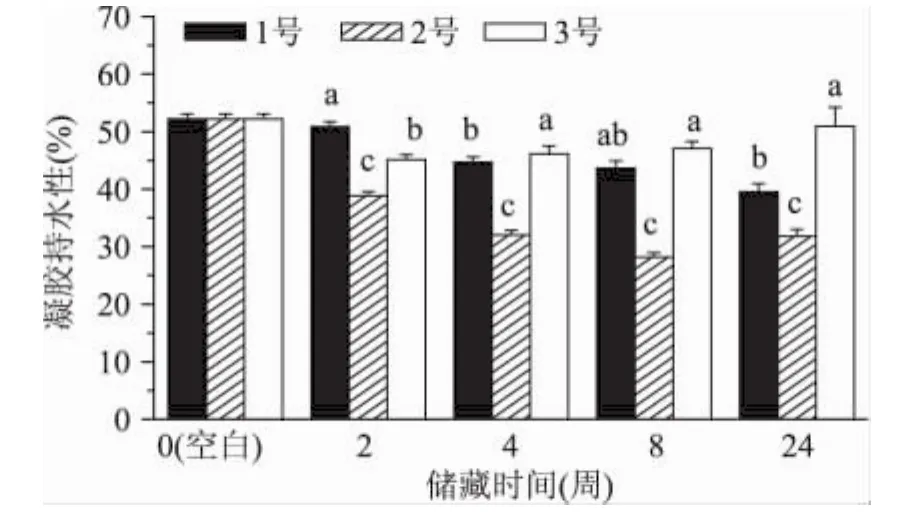
圖4 凍藏后不同包裝處理肉的肌原纖維蛋白凝膠持水性Fig.4 Water holding capacity of myofibrillar protein gel from different treatment samples during frozen storage
3 結(jié)論
采用普通密封包裝以及添加復(fù)合抗氧化劑的的樣品隨著凍藏過(guò)程中氧化程度由輕到重,肌原纖維蛋白的凝膠能力均呈現(xiàn)出先增強(qiáng)后減弱的趨勢(shì),但增強(qiáng)的凝膠能力并未改善凝膠的持水能力。其中,所用復(fù)合抗氧化劑在半年儲(chǔ)藏期內(nèi)抑制冷凍肉蛋白氧化以及保持肌原纖維蛋白功能方面尚未達(dá)到理想效果。真空包裝盡管在防止蛋白氧化,保持肌原纖維凝膠能力及持水性方面有較好效果,但已知該包裝技術(shù)會(huì)增加肉品的汁液損失[12]。因此,還需要進(jìn)一步研究抗氧化劑的復(fù)配,并尋找合適的措施綜合控制冷凍肉蛋白氧化及保持蛋白功能。
[1]Leygonie C,Britz T J,Hoffman L C.Impact of freezing and thawing on the quality of meat:Review[J].Meat Science,2012,91:93-98.
[2]Lund M N,Heinonen M,Baron C P,et al.Protein oxidation in muscle foods:A review[J].Molecular Nutrition & Food Research,2011,55:83-95.
[3]Xiong Y L,Park D,Ooizumi T.Variation in the Cross-Linking Pattern of Porcine Myofibrillar Protein Exposed to Three Oxidative Environments[J].Journal of Agricultural and Food Chemistry,2008,57:153-159.
[4]Levine R L,Williams J A,Stadtman E R,et al.Carbonyl assays for determination of oxidatively modified proteins[J].Methods in Enzymology,1994,233:346-357.
[5]Katoh N,Uchiyama H,Tsukamoto S,et al.A biochemical study on fish myofibrillar ATPase[J].Nippon Suisan Gakkaishi,1977 43:857-867.
[6]Utrera M,Estévez M.Oxidation of myofibrillar proteins and impaired functionality:Underlying mechanisms of the carbonylation pathway[J].Journal of Agricultural and Food Chemistry,2012,60:8002-8011.
[7]Ooizumi T,Xiong Y L.Biochemical susceptibility of myosin in chicken myofibrils subjected to hydroxyl radical oxidizing systems[J].Journal of Agricultural and Food Chemistry,2004,52:4303 -4307.
[8]Wagner J R,A?ó■ M C.Effect of frozen storage on protein denaturation in bovine muscle[J].International Journal of Food Science & Technology,1986,21:547-558.
[9]Benjakul S,Visessanguan W,Tueksuban J.Changes in physico-chemical properties and gel-forming ability of lizardfish(Saurida tumbil)during post- mortem storage in ice[J].Food Chemistry,2003,80:535-544.
[10]Xiong Y L,Blanchard S P,Ooizumi T,et al.Hydroxyl radical and ferryl-generating systems promote gel network formation of myofibrillar protein[J].Journal of Food Science,2010,75:C215 -C221.
[11]Cheng Q,Sun D W.Factors affecting the water holding capacity of red meat products:A review of recent research advances[J].Critical Reviews in Food Science and Nutrition,2008,48:137-159.
[12]Payne S R,Durham C J,Scott S M,et al.The effects of non-vacuum packaging systems on drip loss from chilled beef[J].Meat Science,1998,49:277-287.

