雙酚A對雌性大鼠間腦組織Kisspeptin/GnIH基因表達的影響
劉麗霞,殷 宏,田世民,鐘 理
(1河北大學研究生學院,河北保定071002;2中國檢驗檢疫科學研究院綜合檢測中心毒理實驗室,質檢總局毒理重點實驗室)
環境雌激素是指環境中存在的具有雌激素特征的一類內分泌擾亂物質。雙酚 A(bisphenol A,BPA)是環境雌激素的一種,為弱雌激素拮抗劑,可結合于雌激素受體上,最終導致機體性別分化的改變、青春期提前、發情周期改變、垂體分泌能力的改變、生殖能力下降等危害[1]。其目前廣泛用于罐頭食品和飲料的包裝、奶瓶及水瓶等塑料日用品及牙封閉劑中[2]。神經生殖內分泌系統主要由下丘腦—垂體—性腺軸(HPG)進行調控。近年來大量實驗證明,類固醇激素通過直接作用于新發現的一組神經肽:Kisspeptin及促性腺激素抑制激素(GnIH),對生殖軸進行調控。2012年3~8月,我們以去卵巢雌性大鼠為動物模型,利用Real-Time PCR方法檢測了BPA對大鼠間腦組織中Kisspeptin、GnIH及其各自受體mRNA表達量的影響。現將結果報告如下。
1 材料與方法
1.1 實驗材料 SPF級成年雌性SD大鼠16只,體質量(200±20)g,購于北京維通利華實驗動物有限公司[實驗動物許可證編號:SCXK(京)2012-0001]。飼養條件為晝夜12 h交替,室內溫度控制于20~25℃,濕度40%~70%,食水自由攝取[實驗動物使用許可證號碼:SYXK(京)2011-0016]。BPA(日本和光公司);雌二醇(Sigma公司);總RNA提取試劑Trizol(Invitrogen公司);反轉錄及熒光定量試驗使用Promega公司的Go Taq 2-Step RT-qPCR System試劑盒。熒光定量反應所用儀器為Applied Biosystems 7500。
1.2 去卵巢雌性大鼠模型制備、分組及干預 模型制備參照文獻[3],于乙醚麻醉下行卵巢摘除手術,手術結束后動物恢復1周,將其隨機分為四組各4只,分別為陰性對照組、BPA低劑量組、BPA高劑量組、雌二醇處理組。BPA高劑量組采用其最大耐受劑量[1 g/kg body weight(BW)·d]的 1/10(100mg/kg BW·d),低劑量組為高劑量組的1/10。用乙醇溶解BPA后,橄欖油稀釋,按照0.5 mL/kg BW·d進行腹腔注射。陰性對照組予橄欖油0.5 mL/kg BW·d,雌二醇處理組予雌二醇1mg/kg BW·d,每日給藥1次,連續給藥3 d,給藥結束1周之后乙醚麻醉下解剖動物,取雙角子宮及間腦[4],剔除多余脂肪組織,稱量各臟器的重量,記錄并計算臟器系數(臟器重量/體重×100%)。將所取臟器迅速投于液氮中速凍,-80℃保存。臟器重量及臟器系數的結果顯示,與去卵巢陰性對照組相比,雌二醇處理組動物子宮的重量及臟器系數顯著增加,說明本實驗中去卵巢雌性大鼠模型構建成功[3]。
1.3 間腦中 Kisspeptin、GPR54、GnIH 與 GPR147基因mRNA測定方法 按照Trizol法使用說明提取組織總RNA,根據OD260/OD280的值測定RNA的質量,計算總 RNA的濃度。用焦碳酸二乙酯(DEPC)處理水將RNA稀釋至終質量濃度100 ng/μL。以上述RNA為模板,Oligo(dT)15為引物進行反轉錄,反轉錄體系為20 μL。試驗流程按照Promega公司的兩步法RT-qPCR試劑盒中的反轉錄部分進行。相對實時熒光定量PCR實驗:內參基因為大鼠β-actin,登錄號 NW_048034,引物序列(5'→3')為 F-AGATGACCCAGATCATGTTTGAGA,R-ACCAGAGGCATACAGGGACAA;目的基因分別為大鼠Kisspeptin及其受體 GPR54、大鼠GnIH及其受體GPR147四種基因,其登陸號分別為NW_047395、NW_047773、NW_047691、NW_047601,引物序列(5'→3')分別為:F-ATGATCTCGCTGGCTTCTTGG,RGGTTCACCACAGGTGCCATTTT;F-GCTGGGAGACTTCATGTGCAA,R-AGCGGGAA CACAGTCACATACC;F-GAGTCCTGGTCAAGAGCAAC,R-ACTGGCTGGAGGTTTCCTAT;F-CGCTCCTACCCGCTCTACT,RAGCGGCACCAGGTAGATGT。擴增采用 SYBR Green法,引物設計參考 Quennell等[5]的報告。試驗流程按照Promega公司的兩步法RT-qPCR試劑盒中的qPCR部分進行。擴增程序為:95℃ 2min,95℃ 15 s,60℃ 1min;40個循環;溶解曲線程序:95 ℃ 15 s,60 ℃ 1min,95 ℃ 30 s,60 ℃ 15 s。相對熒光定量PCR的分析方法為2-△△Ct法。
1.4 統計學方法 采用SPSS 17.0統計軟件,計量數據以±s表示,P≤0.05為差異有統計學意義。
2 結果
四組動物間腦組織中 Kiss1、GPR54、GnIH與GPR147基因mRNA表達見表1。
表1 四組動物間腦組織中Kiss1、GPR54、GnIH與GPR147基因mRNA表達(±s)
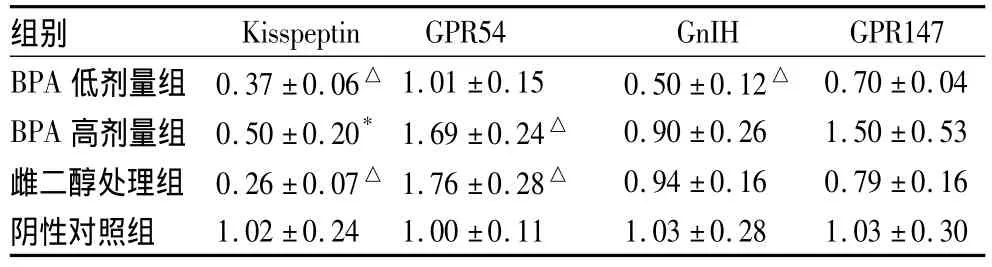
表1 四組動物間腦組織中Kiss1、GPR54、GnIH與GPR147基因mRNA表達(±s)
注:與陰性對照組相比,*P<0.05,△P<0.01
組別Kisspeptin GPR54 GnIH GPR147 BPA低劑量組 0.37±0.06△ 1.01±0.15 0.50±0.12△0.70±0.04 BPA高劑量組 0.50±0.20* 1.69±0.24△ 0.90±0.26 1.50±0.53雌二醇處理組 0.26±0.07△ 1.76±0.28△ 0.94±0.16 0.79±0.16陰性對照組1.02±0.24 1.00±0.11 1.03±0.28 1.03±0.30
3 討論
Kisspeptin是Kiss1基因的后翻譯產物之一,大鼠體內的Kisspeptin序列為YNWNSFGLRF,其受體為G蛋白偶聯受體GPR54,促性腺激素釋放激素(GnRH)神經元表達 GPR54 的 mRNA[6,7]。GnIH 是2000年日本學者從鵪鶉的間腦中分離出的由下丘腦分泌的一種神經肽,氨基酸序列為SIKPSAYLPLRF[8],其受體(GnIH-r)為 OT7T022/GPR147,在大鼠腦內33%GnRH神經元表達GPR147[9]。實驗發現Kisspeptin神經元表達有雌激素受體 ERα[3],雙標記免疫熒光實驗證明,約40%GnIH免疫陽性神經元表達 ERα[10],Kisspeptin能夠激活 GnRH 及黃體生成素(LH)的分泌[4,7],而 GnIH 具有抑制促性腺激素及 LH 分泌的功能[8,11]。
本試驗建立了去卵巢雌性大鼠動物模型,以排除動物體內雌激素對試驗的干擾。關于雌激素對Kisspeptin/GnIH的影響已有一些報道,Quennell等給去卵巢雌性SD大鼠皮下包埋約含10 μg 17β-estradiol的橡膠管7 d后測定不同腦區內Kisspeptin、GPR54、GnIH和 GPR147的mRNA水平,結果顯示與Kisspeptin基因相比,GnIH基因未見與雌激素有關的明顯改變[5]。本試驗中雌二醇處理組結果與文獻報道一致,給去卵巢雌性大鼠雌二醇1mg/kg BW·d腹腔注射,連續給藥3 d,大鼠間腦組織內Kisspeptin mRNA水平明顯降低,GPR54基因表達明顯升高,而GnIH和GPR147基因表達無顯著變化。
關于環境雌激素對Kisspeptin/GnIH的影響鮮有報道。本研究給予不同劑量的環境雌激素雙酚A,檢測了其對間腦內Kisspeptin、GnIH及其各自受體mRNA表達量的變化。對于BPA對Kisspeptin mRNA表達的影響結果顯示,BPA低、高劑量組均顯著降低了間腦內 Kisspeptin基因的表達量;而GPR54的表達量在BPA高劑量組動物間腦組織中顯著升高,低劑量組動物間腦組織中無明顯變化。Kisspeptin免疫陽性神經元在嚙齒類動物腦中具有兩種主要類型,一種存在于弓形核(ARC),另一種存在于前腹室旁核(AVPV)中[12]。對去除卵巢的雌性小鼠及AcGFP轉基因小鼠給予E2,明顯增加了AVPV內Kisspeptin基因的表達水平,顯著降低了ARC內Kisspeptin基因的表達[13]。由本試驗結果可推測在去卵巢雌性大鼠間腦組織內BPA及雌二醇處理對ARC核團中Kiss1表達的抑制作用超過其對AVPV核團中Kisspeptin表達的促進作用。在BPA處理組中,大鼠間腦組織內GnIH mRNA表達量在BPA低劑量組顯著降低(P<0.01),而在BPA高劑量組無顯著變化。
從BPA對Kisspeptin mRNA及GnIH mRNA表達量的影響來看,高劑量BPA比低劑量BPA對二者的影響顯著,即BPA的作用具有低劑量效應的特點。在內分泌擾亂物質研究中經常出現的倒U型非單調劑量效應關系(NMDRs)中,低劑量效應常常是人們關注的問題。Vandenberg等[1]提出BPA對機體的干擾作用具有低劑量效應,極低劑量的BPA能夠作用于mER、GPR30以及定位于胞質或線粒體上的ERs,刺激一系列“非經典”細胞通路“激活”細胞應答。還有報道指出,在環境相關水平低濃度的BPA對大鼠可以誘導仔鼠跨代遺傳的表型異常[14]。
綜上所述,BPA能干擾生殖軸中的重要神經肽Kisspeptin及GnIH表達,且其干擾作用具有低劑量效應。而低劑量BPA是否作用于GnIH及Kisspeptin神經元的特殊類型雌激素受體,亦或作用于GnIH及Kisspeptin基因的啟動子,影響關鍵序列的甲基化或乙酰化,從而造成不同于高劑量BPA和雌激素的作用,有待進一步研究確定。
[1]Vandenberg LN,Maffini MV,Sonnenschein C,et al.Bisphenol-A and the great divide:A review of controbersies in the field of endocrine disruption[J].Endocrine Reviews,2008,30(1):75-95.
[2]Naciff JM,Khambatta ZS,Reichling TD,et al.The genomic response of Ishikawa cells to bisphenol A exposure is dose-and timedependent[J].Toxicology,2010,270(2010):137-149.
[3]Adachi S,Yamada SJ,Takatsu Y,et al.Involvement of anteroventral periventricular Metastin/Kisspeptin neurons in estrogen positive feedback action on luteinizing hormone release in female rats[J].J.Reprod Dev,2007,53(2):369-380.
[4]Navarro VM,Castellano JM,Fernández-Fernández R,et al.Developmental and hormonally regulated messenger ribonucleic acid expression of Kiss-1 and its putative receptor,GPR54,in rat hypothalamus and potent luteinizing hormone-releasing activity of Kiss-1 peptide[J].Endocrinology,2004,145(10):4565-4574.
[5]Quennell JH,Rizwan MZ,Relf HL,et al.Developmental and steroidogenic effects on the gene expression of RFamide related peptides and their receptor in the rat brain and pituiary gland[J].J Neuroendocrinol,2010,22(4):309-316.
[6]Stafford LJ,Xia C,Ma W,et al.Identification and characterization of mouse metastasis-suppressor Kiss1 and its G-protein-coupled receptor[J].Cancer Res,2002,62(19):5399-5404.
[7]Messager S,Chatzidaki EE,Ma D,et al.Kisspeptin directly stimulates gonadotropin-releasing hormone release via G protein-coupled receptor 54[J].Proc Natl Acad Sci USA,2005,102(5):1761-1766.
[8]Tsutsui K,Saigoh E,Ukena K,et al.A novel avian hypothalamic peptide inhibiting gonadotropin release[J].Biochem Biophys Rea Commun,2000,275(2):661-667.
[9]Rizwan MZ,Poling MC,Corr M,et al.RFamide-related peptide-3 receptor gene expression in GnRH and Kisspeptin neurons and GnRH-dependent mechanism of action[J].Endocrinology,2012,153(8):3770-3779.
[10]Kriegsfeld LJ,Mei DF,Bentley GE,et al.Identification and characterization of a gonadotropin-inhibitory system in the brains of mammals[J].Proc Natl Acad Sci USA,2006,103(7):2410-2415.
[11]Pineda R,Garcia-Galiano D,Sanchez-Garrido MA,et al.Characterization of the inhibitory roles of RFRP3,the mammalian ortholog of GnIH,in the control of gonadotropin secretion in the rat:in vivo and in vitro studies[J].Am J Physiol Endocrinol Metab,2010,299(1):E39-E46.
[12]Clarkson J,Herbison AE.Postnatal development of kisspeptin neurons in mouse hypothalamus;sexual dimorphism and projections to gonadotropin-releasing hormone neurons[J].Endocrinology,2006,147(12):5817-5825.
[13]Tomikawa J,Uenoyama Y,Ozawa M,et al.Epigenetic regulation of Kiss1 gene expression mediating estrogen-positive feedback action in the mouse brain[J].Proc Natl Acad Sci USA,2012,109(20):1294-1301.
[14]殷宏,金涌,邢仕歌,等.外源化學物的表觀遺傳毒性及其安全性評價[J].毒理學雜志,2010,24(6):487-491.

