鰱魚CPIs 的三種電泳鑒定方法的比較研究
李樹紅,任陽陽,+,李艷芳,彭海鑫,曹 坤,李 冉,蘇 趙
(1.四川農業大學食品學院,四川雅安625014;2.四川農業大學動物科技學院,四川雅安625014)
我國水域資源遼闊,魚類種類資源豐富,其中鰱魚是我國主要淡水養殖品種之一,年產量371.39 萬噸,位居第二[1]。魚類下腳料中含有豐富半胱氨酸蛋白酶抑制因子(cysteine protease inhibitors),簡稱CPIs[2]。隨著對CPIs 的不斷深入研究,發現其在細胞凋亡、腫瘤的浸潤與轉移、臨床診斷、抗蟲、抗病毒、抗菌以及肉質等方面都起著非常重要的作用[3]。因此,有必要對鰱魚下腳料中CPIs 進行分離提取,以便充分開發和利用我國淡水鰱魚資源。目前作者所在研究團隊,首次對鰱魚下腳料中小分子CPIs 進行了分離純化鑒定[4]。但在研究過程中發現,鰱魚某些下腳料中CPIs 在初分離階段,不易檢測到抑制活性,為純化工作帶來困難,需要借助其他手段進行鑒定。然而目前常用于鑒定CPIs 的方法,大部分主要基于免疫反應的原理,即單向免疫擴散法(RID)[5]、放射免疫測定法(RIA)[6]、熒光免疫測定法(FIA)[7]等,這些方法都需要制備抗體,過程繁瑣,成本昂貴,不適層析純化過程中鰱魚CPIs 的快速鑒定,為此,確立一種方便準確的電泳方法鑒定鰱魚粗提組分中CPIs,不僅利于分離純化工作的順利進行,而且對于分析判斷其他魚類各下腳料中的CPIs 活性成分的分布情況,同樣具有借鑒意義。本文主要對三種CPIs 的電泳鑒定方法進行了比較分析,以便確定最適于鑒定鰱魚下腳料粗提樣中CPIs 的靈敏度高且分辨效果最佳的電泳鑒定方法,以彌補以明膠為底物的非還原SDS-PAGE 反相酶譜在實際應用中存在的不足。
1 材料與方法
1.1 材料與儀器
鰱魚下腳料 于四川崇州通威養殖中心采樣;懷卵期(IV 期)鰱魚,宰殺后,立即采卵、肝胰組織,樣品液氮速凍后于-80℃超低溫冰箱凍藏,使用前4℃解凍。
木瓜蛋白酶(papain)(P4762,10U/mg)、丙烯酰胺、甲叉雙丙烯酰胺、過硫酸銨、SDS、牛血清白蛋白、細胞色素C、DMSO、AMC、Z-Phe-Arg-MCA、偶氮酪蛋白(Azocasein) 美國Sigma 公司;TEMED 美國Bio-Rad;DTT 美國BBI;中分子量(Marker 14.4 ~94ku) 北京天根;中分子量Marker(14.4~97.4ku)美國Promega;蛋白濃度試劑盒 南京建成。
Ultra-stirred cell 8050 超濾杯 美國Millipore;LRH-250 生化培養箱 上海一恒;Mapada V-1200可見分光光度計 上海美譜達;Mini Protein3 垂直電泳槽、JY-ECP3000 電泳儀、Dio-Gel-2000 凝膠成像系統 美國Bio-Rad。
1.2 實驗方法
1.2.1 鰱魚下腳料CPIs 粗提樣品的制備 鰱魚卵CPIs 粗提樣:鰱魚卵經粗提液勻漿、酸處理后,用30ku 超濾膜超濾,取下清,再經3ku 超濾濃縮,制得鰱魚卵小分子CPIs 濃縮粗提液。
鰱魚肝胰粗提樣:鰱魚肝胰經勻漿、堿化處理后,立即用冰醋酸回調,此后30%~80%硫酸銨分段鹽析。透析后經3ku 超濾濃縮制得鰱魚肝胰CPIs 濃縮粗提液。
1.2.2 蛋白濃度的測定 參照Bradford[8]法,按照蛋白濃度試劑盒說明測定所用樣品的蛋白濃度。
1.2.3 CPIs 抑制活性的測定 熒光合成肽底物法:通過熒光合成肽底物法[9]檢測CPIs 粗提樣對papain的抑制活性。一個酶活單位定義為:在40℃、pH6.8的反應條件下,能夠在1min 內水解底物并釋放出1nmol AMC 產物的酶活性量(1nmol AMC/min)。一個抑制活性單位定義為:抑制一個單位的酶活性。
偶氮酪蛋白(Azocasein)法:鰱魚CPIs 粗提液抑制活性的另一種測定方法Azocasein 法參考本實驗室前期方法[9]。通過調節CPIs 的用量,使其抑制木瓜蛋白酶的Azocasein 水解活性的抑制比率在30% ~70%之間。CPIs 的一個抑制活性單位定義為:在37℃的反應條件下,440nm 處降低0.01 個吸光度即為一個單位。
1.2.4 CPIs 的三種電泳鑒定方法 本實驗主要采用三種電泳方法對鰱魚下腳料粗提樣中CPIs 進行鑒定。方法A:基本參照Li[10]的反相酶譜電泳法;方法B:Native-PAGE 反相酶譜電泳法;方法C:與papain反應后進行SDS-PAGE 電泳法。具體操作過程和不同之處如下。
1.2.4.1 電泳緩沖液的配制方法 方法A 和方法C的5 × 電泳緩沖液(室溫保存):120mmol/L Tris,95mmol/L Gly,0.5% SDS pH8.3。方法B 電泳緩沖液:25mmol/L 的 Tris,192mmol/L 的 甘 氨 酸,pH8.8[11]。方法A 和方法C 的分離膠緩沖液為溶解120mmol/L Tris,0.1% SDS,60mmol/L 硼酸,pH8.9,濃縮膠緩沖液為1.0mol/L Tris-HCl,10%(w/v)SDS,pH6.8;方法B 的分離膠緩沖液為1.5mol/L Tris pH為8.8,濃縮膠緩沖液0.5mol/L Tris pH 為6.8。
1.2.4.2 電泳樣品的制備 方法A 和方法B 中要保持樣品的活性,因此在樣品制備時使用不含還原劑(β-巰基乙醇)的樣品緩沖液,其中方法A 的2 ×樣品緩沖液為2mL 的0.5mol/L Tris - HC 緩沖液(pH6.8),2mL 甘油,2mL 的20%的SDS,0.5mL 1%溴酚藍,3.5mL 蒸餾水。方法B 5 × 樣品緩沖液為3.1mL 1mol/L Tris-HCl(pH6.8),5mL 甘油,0.5mL 1%溴酚藍,1.4mL 蒸餾水。方法C 與方法A 除樣品緩沖液中含0.1%的β-巰基乙醇外,其他相同。
方法A 和方法B 中樣品處理時,樣品與樣品緩沖液分別于1∶1 和4∶1 混合后,進行電泳。方法C 樣品處理時首先要確定反應體系中papain 用量,將2.5μg 的BSA 分別與0.625、1.25、2.5μg 的papain(濃度為1.25mg/mL)混合均勻后,于37℃水浴反應1h和5h。反應完后根據管里剩余反應液體積,按等比例加方法C 樣品緩沖液,然后加熱煮沸5min,進行電泳。
1.2.4.3 電泳條件 方法A 和方法C 使用17%的分離膠,而方法B 使用8%的分離膠,電泳均采用100V恒壓,電泳時間約2h。
1.2.4.4 電泳結束后凝膠的反相酶譜處理方法 方法A:凝膠用30mL 含2.5% Triton X-100 的復性緩沖液于搖床洗3 次,每次15min,將凝膠中的SDS 洗掉。然后用超純水清洗凝膠2~3 次;復性后的凝膠用15mL 含0.4mg/mL 的papain 的50mmol 的磷酸鹽緩沖液(pH7.0)在4℃反應1h;取出凝膠再用15mL,含1% 明膠的50mmol 的磷酸鹽緩沖液(pH7.0)在37℃反應8h。方法B:用30mL 含1mmol/L 的DTT的雙蒸水于搖床洗3 次,每次15min。然后用15mL含0.4mg/mL 的papain 的50mmol 的磷酸鹽緩沖液(pH7.0)在4℃反應1h;用15mL 含1% 明膠的50mmol 的磷酸鹽緩沖液(pH7.0)在37℃浸泡8h。方法C:未進行反相酶譜處理。
1.2.4.5 膠的固定染色和脫色 三種方法均用考馬斯亮藍R-250 染色液(考馬斯亮藍0.1%,乙醇40%,冰醋酸10%)染色1h。而后用脫色液(95%乙醇∶冰醋酸∶蒸餾水=4.5∶0.5∶5)脫色至電泳背景色消失,電泳帶清晰可見。
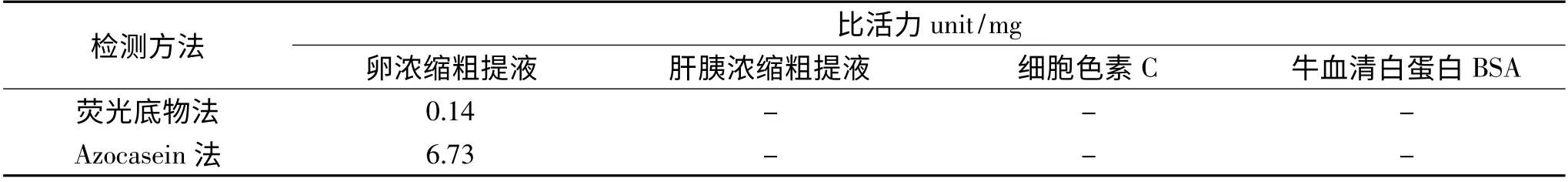
表1 鰱魚卵、肝胰濃縮粗提液CPIs 抑制活性測定Table 1 The inhibitive activities of CPIs in the concentrated crude extract from Silver Carp eggs and hepatopancreas
1.2.4.6 分子量分析 用Quantity One 電泳圖像分析軟件(Bio-Rad)分析CPIs 的分子量。
2 結果與討論
2.1 鰱魚卵、肝胰濃縮粗提液中CPIs 抑制活性測定
由表1 可知,與鰱魚卵濃縮粗提液相比,鰱魚肝胰濃縮粗提液中CPIs 抑制活性,采用熒光底物法及Azocasein 法兩種方法均檢測不出,可能是肝胰組織中胰蛋白酶和半胱氨酸組織蛋白酶等含量較豐富,干擾抑制活性測定。此外,本實驗中作為對照蛋白的細胞色素C、牛血清白蛋白BSA 也無抑制活性。
2.2 Geltain-substrate-SDS-PAGE 反相酶譜法鑒定CPIs
盡管利用熒光底物法和azocasein 法都能夠測得鰱魚濃縮粗提液中CPIs 的抑制活性,但在利用方法A 的反相酶譜電泳鑒定(圖1)中,與對照(1 泳道)相比,鰱魚卵濃縮粗提液(3 泳道),幾乎全部被papain水解,無抑制條帶出現。這可能是由于鰱魚CPIs 活性/比活性較低(均比草魚低約50 倍,資料未發表),而A 法中,聚丙烯酰胺凝膠需在含有1%的明膠中浸泡,膠背景偏深,因此即使粗提樣品中存在少量低活性的沒有被papain 水解的鰱魚CPIs,也很難在電泳膠上觀察到。同時也很可能是A 法中所用的非離子型去垢劑SDS 導致鰱魚CPIs 結構不穩定,致使其失活。研究表明鯉魚小分子Cystatin(CPI 中的一種)表面均勻分布正電荷[12],帶負電荷的SDS 很可能導致其構象改變進而喪失抑制活性。

圖1 鰱魚卵濃縮粗提樣中CPIs 的明膠-底物-SDS-PAGE 反相酶譜鑒定Fig.1 The Geltain-substrate-SDS-PAGE reverse zymography of silver carp egg coarse extract
此外,盡管對照蛋白細胞色素C 沒有papain 抑制活性,但由于電泳上樣濃度高(2 泳道),且papain用量或反應時間不足,經反相酶譜處理后(4 泳道),該蛋白仍沒有完全水解,還有部分條帶清晰可見,這會導致抑制劑鑒定時出現假陽性結果。因此,推測如果待檢樣品中存在高濃度雜蛋白時,很可能也會出現假陽性。綜上分析,一方面說明,利用A 法的反相酶譜法鑒定抑制劑,尤其待測抑制劑活性較低或在電泳上易于失活時,為避免誤判,設立對照蛋白十分必要。另一方面也說明,A 法在鑒定結構不穩定、活性低的抑制劑時具有局限性,A 法不適合鑒定鰱魚下腳料中的CPIs。
2.3 Native-PAGE 反相酶譜電泳法鑒定CPIs
利用Native-PAGE 反相酶譜法(B 法)鑒定鰱魚卵濃縮粗提液中CPIs(圖2),發現,鰱魚卵濃縮粗提液上樣濃度(泳道2)遠低于CPIs 的對照蛋白BSA(泳道1),但在經反相酶譜處理后鰱魚卵濃縮粗提液(泳道4)中條帶與其對照(泳道2)相比,幾乎沒有被papain 水解,目的條帶(箭頭所示)清晰可見;同時,BSA 被反相酶譜處理過程中的papain 水解殆盡(泳道3),也沒有出現假陽性。用不含SDS 的Native-PAGE 反相酶譜法(B 法)鑒定鰱魚卵小分子CPIs 濃縮粗提物時,CPIs 較好地保持了原有抑制活性,這進一步證明了帶負電荷的SDS 小分子CPIs 結構和活性的可能影響作用,也說明很可能鰱魚卵小分子Cystatin 表面也存在正電荷。同時發現,B 法靈敏度高,清晰準確地鑒定了鰱魚下腳料中小分子CPIs。但B 法主要是根據蛋白質所帶電荷分離蛋白質,雖然可以鑒定CPIs 存在,但不能像A 法那樣準確反映分子量大小。不過可以通過電洗脫等方式回收有活性的CPIs 蛋白后,再進行分子量鑒定,步驟相對繁瑣。總之,對于電泳上結構或活性不穩定的CPIs,B法是一種比較理想的鑒定方法,因此非常適合鰱魚卵粗提取樣中小分子CPIs 的鑒定。
2.4 與papain 反應后進行SDS-PAGE 電泳鑒定
2.4.1 papain 水解BSA 的反應條件確定 實驗設計了采用CPIs 的對照蛋白,即2.5μg 的BSA 與不同量的papain(E-64 滴定法確定其1.25mg/mL 時有效濃度為6.05μmol/L,資料未發表)于37℃進行水解反應,分別于1、5h 取樣,檢測BSA 的水解情況,以便確定papain 可以完全水解掉BSA 的反應條件,進而將該確定的條件應用于鰱魚CPIs 粗提取樣品。

圖2 鰱魚卵濃縮粗提液中CPIs 的Native-PAGE 反相酶譜鑒定Fig.2 The Native-PAGE Reverse zymographic of the samples from silver carp egg coarse extract
由圖3 可見,當反應1h 和5h 時,0.625、1.25、2.5μg 的papain,均可以將2.5μg 的BSA 徹底水解,但是0.625μg 的papain 水解1h(泳道8),仍可見微量的BSA 降解后形成的彌散條帶。同時當papain 用量為1.25、2.5μg 時,泳道上出現明顯的papain 蛋白條帶(如箭頭所示),可能會干擾后續實驗中對抑制劑條帶的判斷。因此,確定徹底水解2.5μg BSA 的適宜條件為,papain 用量0.625μg,37℃反應至少5h以上。

圖3 papain 水解牛血清白蛋白效果的SDS-PAGEFig.3 The SDS-PAGE of hydrolysis effect of bovine serum albumin by papain
2.4.2 CPIs 濃縮粗提液與papain 反應后的SDSPAGE 鑒定 由圖4 分析可知,當鰱魚卵濃縮粗提樣(2.5μg)與0.625μg 的papain 于37℃反應15h 后,其中的非目的蛋白幾乎全部水解,唯具有活性的約16ku 和7ku 目的蛋白條帶(如箭頭所示)保留。樣品先與papain 直接反應,而后進行SDS-PAGE 鑒定(C法),這樣避免了樣品中小分子CPIs 在含有SDS 的電泳上失活的缺點,既保持并體現了粗提液中CPIs的抑制活性,又通過電泳分離,清晰可見抑制條帶。因此,C 法是一種很理想的鑒定方法,不僅靈敏度高,鑒定效果好,同時亦可準確反映分子量的大小,可協同B 法充分鑒定鰱魚CPIs。
2.5 鰱魚肝胰粗分離樣品中CPIs 的鑒定

圖4 粗提樣與papain 反應后再進行SDS-PAGE 電泳鑒定Fig.4 The SDS-PAGE of CPIs in the silver carp egg coarse extract after hydrolysis by papain
由圖5 可見,盡管用熒光底物法和azocasein 法均檢測不到肝胰粗分離樣品中的CPIs 抑制活性,但是C 法則可以有效判斷CPIs 的存在,分子量分布情況(約97、23、16、7ku),如箭頭所示,其中約97ku 的高分子量CPI 同樣得到了鑒定。因此,本實驗利用C法,均較理想地鑒定了不便測活的鰱魚肝胰濃縮粗提液中CPIs 的存在和分子量分布。

圖5 papain 不水解CPIs 電泳Fig.5 The electrophoresis of papain not hydrolysis CPIs
3 結論
我國淡水鰱魚資源豐富,對其下腳料中含量豐富、具有多種生理活性的CPIs 進行分離提取和鑒定,對于充分開發利用此資源具有重要意義。因此,針對鰱魚下腳料粗提組分CPIs,確立方便、準確的電泳鑒定方法,在分離純化工作中尤為重要。
本研究通過對三種CPIs 的電泳鑒定方法進行比較研究,發現對于抑制劑活性較低或在電泳上容易失活的鰱魚卵小分子CPIs,研究工作中通常采用的以明膠為底物的非還原SDS-PAGE 反相酶譜(A 法)不僅不適宜,而且樣品中存在高濃度雜蛋白時,很可能也會出現假陽性,在實際應用中存在局限性和不足;Native-PAGE 反相酶譜法(B 法)雖然靈敏度高,清晰準確,但不能直接反映分子量大小;樣品先與papain 直接反應,而后進行SDS-PAGE 鑒定(C 法),靈敏度高,既保持并體現了粗提液中CPIs 的抑制活性,又通過電泳分離,使得抑制條帶清晰可見。因此,C 法或者協同B 法,是鑒定鰱魚下腳料粗提液中CPIs 的理想、有效方法。此外,本研究也說明,在對蛋白性抑制劑進行電泳鑒定時,需要根據抑制劑的活性、電泳穩定性等實際情況,分析判斷,選擇合理的電泳鑒定方法。
[1]農業部漁業局.中國漁業統計年鑒[M].北京:中國農業出版社,2012.
[2]Tzeng S,Wu H C,Sung W C,et al. Purification and characterization of cysteine proteinase inhibitors from crucian carp Carassius auratus eggs[J].Fish Science,2009,75:1453-1460.
[3]Dubin G.Proteinaceous cysteine protease inhibitors[J].Cellular and Molecular Life Sciences,2005,62:653-669.
[4]宋川.鰱魚卵CPIs 的純化鑒定及其抑制魚糜凝膠軟化的研究[D].雅安:四川農業大學,2010.
[5]Lofberg H,Grubb A.Quantitation of gamma-trace in human biological fluids:Indications for production in the central nervous system[J]. Scandinavian Journal of Clinical and Laboratory Investigation,1979,39(7):619-626.
[6]Cattaneo A,Sansot JL,Prevot D,et al.Cysteine proteinsaes and their inhibitors[M].Berlin:Walter de Grugter,In:Turkv,ed,1986:507-516.
[7]Randers E,Erlandsen EJ.Serum cystatin C as an endogenous marker of the renal function-a review[J].Clinical Chemistry And Laboratory Medicine,1999,37(4):389-395.
[8]Bradford M M. A rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein dye binding[J].Analytical Biochemistry,1976,72:248-254.
[9]宋川,李艷芳,任陽陽,等.鰱魚卵高分子質量CPI-I 的純化與鑒定[J].食品科學,2012,33(13):100-103.
[10]Li D K,Lin H,Kim S M.Purification and characterization of a cysteine protease inhibitor from Chum Salmon(Oncorhynchus keta)Plasma[J].Journal of Agricultural and Food Chemistry,2008,56,106-111.
[11]汪家政,范明.蛋白質技術手冊[M].北京:科學出版社.2000,111-123.
[12]Su Y C,Lin J C,Liu H L.Homology model and molecular dynamics simulation of carp ovum cystatin[J]. Biotechnology Progress,2005,21(4):1315-1320.

