發芽對蠶豆植酸和可溶性鐵含量的影響
王麗君,羅羽洧,*,解衛華,郁志蕓
(1.金陵科技學院園藝學院,江蘇 南京 210038;2.環保部南京環境科學研究所,江蘇 南京 210042)
蠶豆(Vica faba L.)又名胡豆、佛豆、羅漢豆等,是我國重要的豆類蔬菜之一。蠶豆營養豐富,可加工成蠶豆系列食品,深受人們喜愛。其蛋白質含量比禾谷類作物小麥、稻米、玉米高2~3倍。蠶豆中含有豐富鐵、鈣、鋅等為人體所必需的礦質元素[1]和蔗糖、半乳糖苷、麥芽糖和乳糖等糖類物質。蠶豆還含有大量的植酸[2-4],對鐵離子有螯合作用,使其中鐵的生物利用率較低[5-6]。植酸是人類抗營養物質,是以植物性食品為主食鐵元素缺乏的重要原因。熱處理[7-8]、輻射處理[9-10]、發芽處理[11]、發酵處理[12]都有減少植酸含量的作用。
近年來,發芽蠶豆作為一種營養食品受到人們的關注[13-14]。發芽蠶豆由胚根、胚芽、胚軸和子葉等4個部分組成,主食部分是子葉。但目前對發芽蠶豆植酸和鐵在這4個部位的空間分布及發芽過程中含量的變化情況沒有報道。本實驗研究蠶豆發芽過程中,植酸以及鐵在胚根、子葉、胚芽和胚軸中的空間分布及含量的變化,同時探討蠶豆發芽過程中鐵離子存在形態及其分布。
1 材料與方法
1.1 材料、試劑與儀器
蠶豆品種為啟豆2號,2010年購于南京市種業有限公司。
植酸鈉(99.5%)、鐵粉(99.9%)、次氯酸鈉、氫氧化鈉、三氯化鐵、鹽酸羥胺,均為分析純。
JA2003型電子天平 上海精密科學儀器有限公司;磁力攪拌器 上海司樂儀器廠;WH-3微型旋渦混合儀 上海滬西分析儀器廠;HH-6型數顯恒溫水浴鍋 常州國華電器有限公司;UV-2802型紫外-可見分光光度計 尤尼柯(上海)儀器有限公司。
1.2 發芽實驗和樣品處理
選擇大小均勻一致的蠶豆籽粒100g,用0.5%次氯酸鈉消毒25min,再用去離子水沖洗2次。然后放入表面皿中(直徑40cm)以25℃水浸泡24h,然后在25℃條件下發芽8d,每天上午和下午各換水1次。每24h取樣1次,把蠶豆的胚根、子葉、胚芽和胚軸剝開,放在聚乙烯袋內,然后置于-18℃冰箱中待測。每處理重復3次。
1.3 指標測定
1.3.1 植酸含量
分別取5.00g子葉、3.00g胚根、2.00g胚軸和1.00g胚芽,經研磨后置于50mL具塞三角瓶中,加0.35mol/L鹽酸40mL,搖勻后于(30±1)℃條件下振蕩2h。植酸提取液在沸水浴中水浴3min,然后4000r/min離心10min,取上清液,用蒸餾水稀釋至50mL。將經過預處理的717型強堿性陰離子交換樹脂濕法填裝于交換柱中,用0.7mol/L NaCl水溶液洗脫,然后用蒸餾水洗脫至洗脫液無氯離子(加入1mol/L硝酸銀-硝酸溶液,與蒸餾水對照)。取8mL提取液加入1mL、3% NaOH溶液,補加蒸餾水至30mL,混勻后以1.0mL/min的速率流入離子交換柱。然后用15mL蒸餾水和15mL 0.05mol/L NaCl溶液洗滌,控制流速在50~80mL/min,最后用0.7mol/L NaCl洗脫植酸溶液,洗脫液收集于25mL的容量瓶,用蒸餾水定容。取待測植酸液(植酸含量在0.1~0.5mg之間)6mL,加入三氯化鐵-磺基水楊酸4mL,搖勻,520nm處測其吸光度,從回歸方程計算出試液中植酸含量[15]。Y=487.75X-40.735(R2=0.98),式中:Y為樣品中植酸含量/(mg/100g),X為樣品的吸光度。
1.3.2 不同價態鐵含量測定
1.3.2.1 總鐵含量測定
準確稱取5.000g 蠶豆子葉,濕法消化后,加入1.5mL 1.0mol/L鹽酸羥胺,采用鄰菲羅啉分光光度法測定總鐵含量[16]。
1.3.2.2 可溶性總鐵含量
準確稱取5.000g蠶豆子葉,研磨后以去離子水定容至50mL,充分振蕩溶解,浸提2h。4500r/min離心15min,取上清液,加入1.5mL 1.0mol/L鹽酸羥胺,定容至100mL。用鄰菲羅啉光度法測定其中的鐵含量即為可溶性總鐵含量。總鐵與可溶性鐵含量之差即為不溶性鐵含量[16]。
1.3.2.3 可溶性二價鐵、三價鐵含量
另取上清液1份,調pH值至4.0左右,同時加入2.5mL 2%的氟化銨(氟離子可掩蔽三價鐵-鄰菲羅啉絡合物光還原作用),定容至100mL。按鄰菲羅啉光度法測定其中的鐵含量即為可溶性二價鐵含量。可溶性總鐵含量與可溶性二價鐵含量之差即為可溶性三價鐵含量[17]。
1.3.3 植酸酶活性測定
分別稱取5.000g發芽蠶豆樣品,研磨后放入4個100mL燒杯中(4個重復),加入50mL冷卻的醋酸緩沖液,用磁力攪拌器攪拌60min,然后過濾,定容至100mL,得到植酸酶粗酶液,置于冰箱中低溫保存備用。
取4支已標號的10mL刻度試管,其中1管作空白對照,其他3管為反應管。在4支刻度試管中分別加入3.000mL植酸鈉溶液,置于37℃水浴鍋預熱5min,然后以相同時間間隔(間隔為0.5h)依次在反應管中加入已預熱的植酸酶溶液1.000mL,在37℃水浴鍋中溫育1h,按與加入酶液相同順序和時間間隔加入4.000mL釩鉬酸銨顯色/終止液,空白管加入1.000mL植酸酶溶液,混合搖勻,用分光光度計在415nm處比色(以空白管作對照)讀取吸光度,代入標準曲線計算植酸酶活性[18]。Y=619.04X(R2=0.98),式中:Y為樣品植酸酶活性/(U/g),X為樣品吸光度。每分鐘水解釋放1μmol無機磷為1個活性單位(U)。
1.4 統計分析
測定數據均用SPSS13.0軟件進行統計和單因素方差分析,顯著性為P<0.05。
2 結果與分析
2.1 發芽過程中植酸在蠶豆不同部位中的含量變化
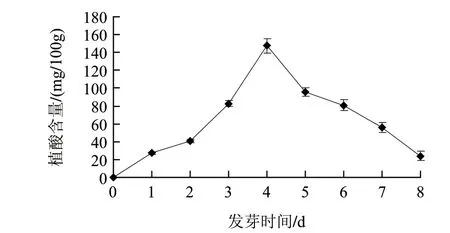
圖 1 胚根中植酸含量的變化Fig.1 Change in phytic acid content in embryonic radicle
由圖1可知,胚根中植酸含量呈先升高后降低的趨勢。發芽至第4天,胚根中植酸含量達到147mg/100g(以干物質計,下同),然后開始下降,發芽至第8天,植酸含量下降為24mg/100g。
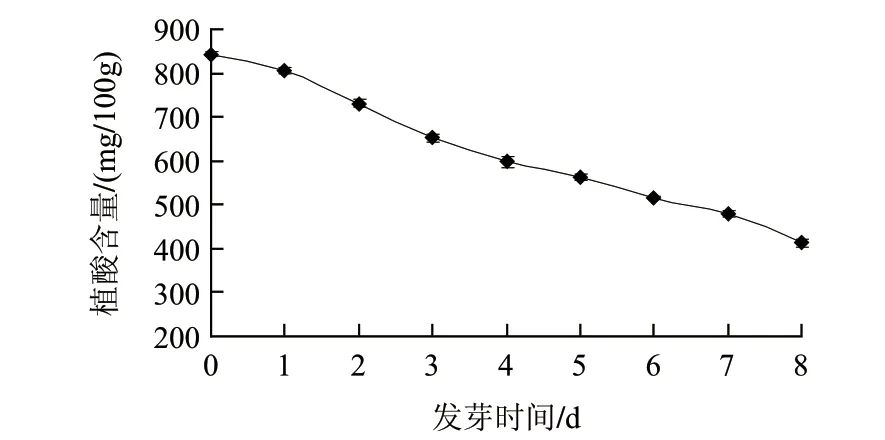
圖 2 子葉中植酸含量的變化Fig.2 Change in phytic acid content in cotyledon
蠶豆中80%以上的植酸存在于子葉中。在發芽過程中,植酸酶活性被激活[8],植酸被大量分解。由圖2可知,在發芽過程中,蠶豆子葉中植酸含量不斷下降。從開始發芽的843mg/100g降低到發芽第8天的413mg/100g。植酸被分解后,釋放出大量的磷元素,在種子發芽過程中對植物細胞壁形成起到骨架作用。
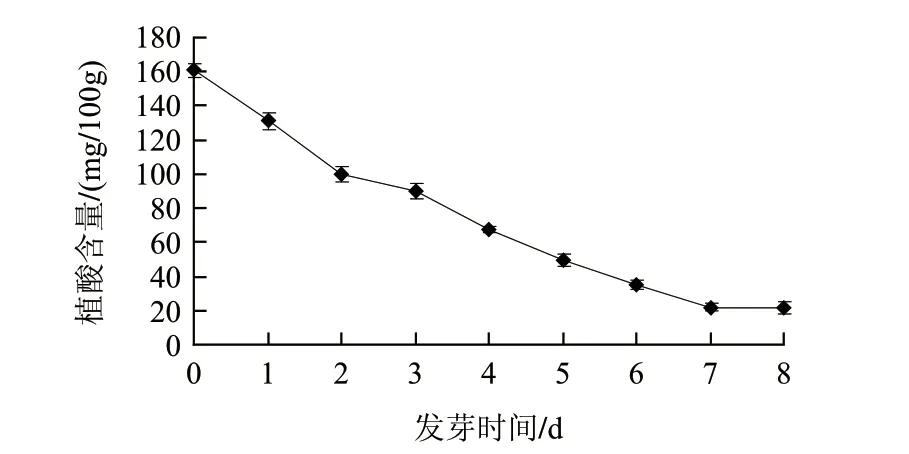
圖 3 胚芽中植酸含量的變化Fig.3 Change in phytic acid content in plumula
由圖3可知,胚芽中植酸含量的變化趨勢與蠶豆子葉中的變化趨勢基本一致,均隨發芽時間延長其含量不斷下降。但是胚芽中植酸含量顯然低于子葉中的含量,最高時的含量為161mg/100g。
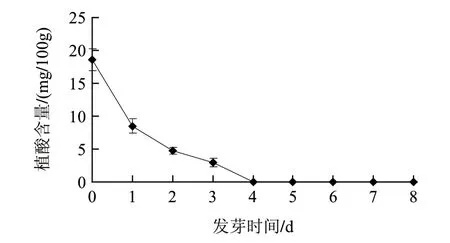
圖 4 胚軸中植酸含量的變化Fig.4 Change in phytic acid content in embryonic axe
由圖4可知,蠶豆在發芽的前3d內胚軸中植酸含量一直在下降,發芽至第4天,其胚軸中已檢測不到植酸。蠶豆中80%以上的植酸存在于子葉中,胚芽中植酸的含量低于子葉中的含量,但是高于胚軸中植酸含量。在發芽過程中這3個部位中的植酸分解速率以子葉為最快,其次是胚芽,而以胚軸中的植酸分解的速率最慢。
2.2 鐵在發芽蠶豆不同部位中的分布
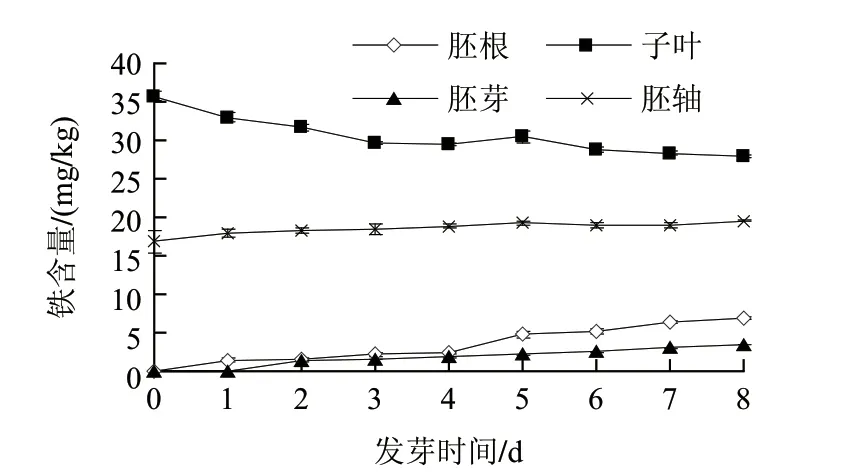
圖 5 鐵在發芽蠶豆不同部位含量的變化Fig.5 Change in iron content in different parts of germinated faba beans
由圖5可知,子葉中,鐵含量從發芽前的35.7mg/kg降低到發芽至第8天時的27.9mg/kg,差異顯著(P<0.05)。胚軸中鐵含量高于胚根和胚芽中的含量。發芽至第8天胚軸中鐵含量達到19.5mg/kg,比發芽前增加2.7mg/kg,但是差異不顯著;胚根和胚芽中鐵含量分別從1.6、1.5mg/kg增加到7.1、3.6mg/kg,差異顯著(P<0.05)。與子葉相比,胚根、胚芽和胚軸中鐵含量差異均達到極顯著水平(P<0.01)。
2.3 發芽過程中鐵在子葉中的分布及含量變化
2.3.1 發芽處理對蠶豆中鐵化學形態的影響
發芽時間對蠶豆中總鐵、可溶性總鐵、可溶性二價鐵及可溶性三價鐵含量的影響見表1。為了更好地說明發芽處理對蠶豆中不同化學形態的影響,對表1的數據進行了處理,得到表2。
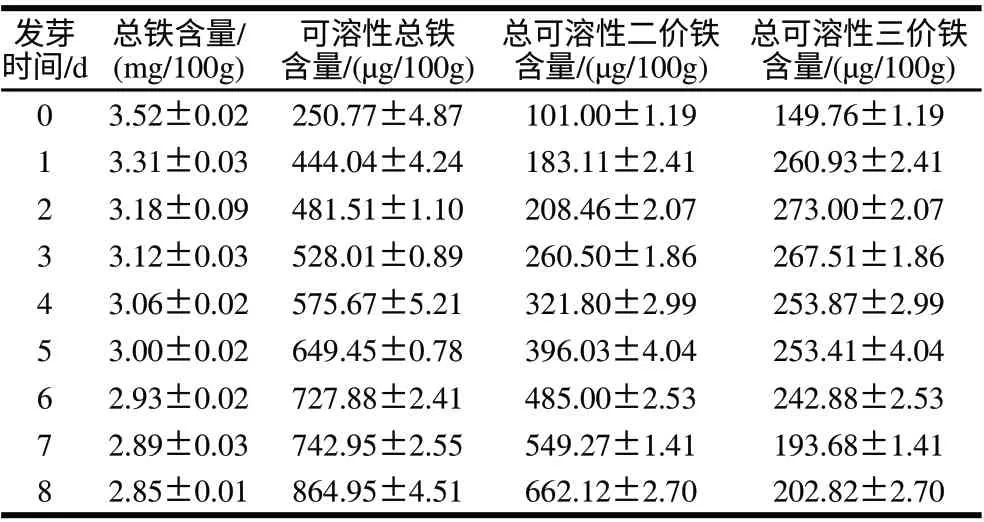
表1 發芽處理對蠶豆子葉不同化學形態鐵含量的影響Table 1 Effect of germination on various chemical forms of iron in cotyledon of faba beans
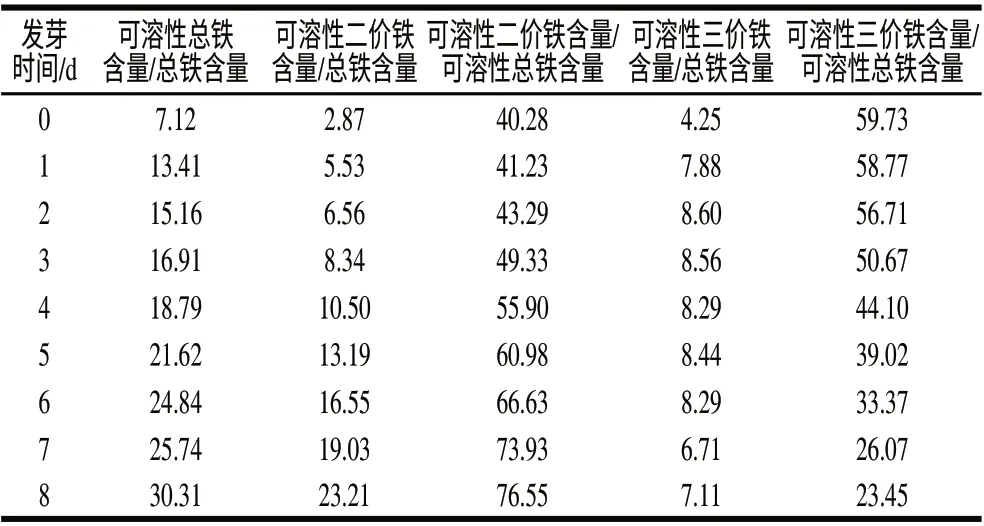
表2 發芽處理對蠶豆子葉不同化學形態鐵比值的影響Table 2 Effect of germination on various chemical forms of iron in cotyledon of faba beans %
從表2可以看出,在蠶豆發芽過程中,可溶性總鐵含量在不斷增加,可溶性二價鐵占可溶性總鐵的比值也在不斷增加。而可溶性三價鐵含量呈先增加后降低的趨勢,可溶性三價鐵占可溶性總鐵的比值不斷降低。從表1可以看出,蠶豆發芽至第8天,可溶性總鐵含量達到864.95μg/100g,是發芽前的3倍多,表明發芽處理顯著提高了可溶性總鐵含量,且可溶性總鐵含量占總鐵含量的比例從7.12提高到30.31,增加4倍以上;可溶性二價鐵含量增加6倍。提示在發芽過程中可能存在某種機制將不溶性鐵轉化為可溶性鐵。
2.3.2 蠶豆發芽過程植酸酶活性的變化對植酸及可溶性總鐵含量的影響
植酸含量高是導致很多植物性食物中鐵溶解性低的主要原因之一[19]。有研究證明,在一些豆類的發芽過程中,植酸酶的活性增加,導致植酸分解速度加快,使得螯合的金屬離子,比如鐵離子和鋅離子釋放出來,這樣不溶性鐵離子和鋅離子變成可溶性鐵離子和鋅離子[20]。其中植酸酶活性的大小對所釋放出來的鐵離子和鋅離子含量有較大影響[21]。本研究測定了蠶豆發芽過程中植酸酶活性和植酸含量變化情況,并且與蠶豆發芽過程中可溶性總鐵含量的變化進行了對比(表3)。在蠶豆發芽過程中,植酸酶活性顯著提高,蠶豆中植酸含量顯著下降,并且植酸下降的趨勢和可溶性總鐵含量增加的趨勢吻合。有研究[22-24]表明,植酸含量的降低使其螯合的金屬離子被釋放出來,本研究結果與報道的一致。
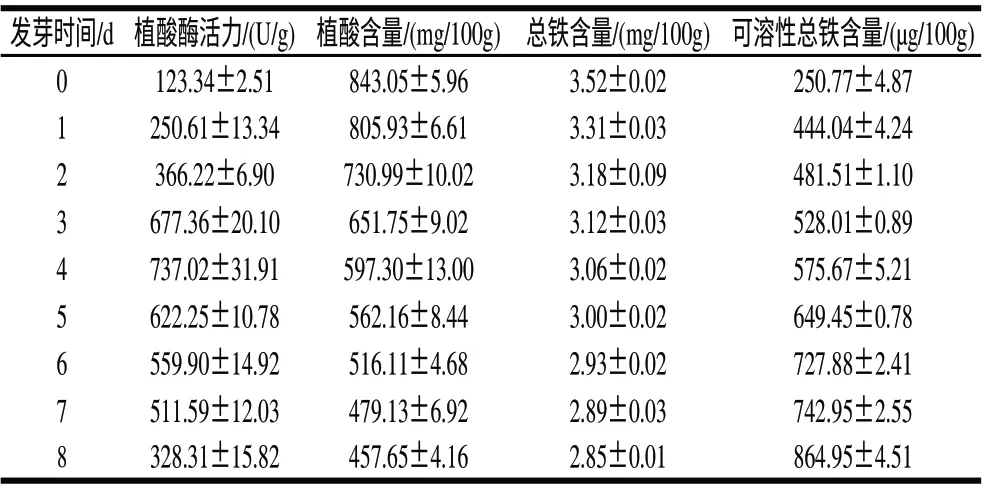
表3 植酸酶活性對發芽蠶豆中植酸及可溶性鐵含量的影響Table 3 Effect of phytase on the amounts of phytic acid and soluble iron in faba beans
3 討 論
發芽蠶豆的子葉中植酸含量最高,而在胚軸中為最低。發芽8d后,子葉中植酸含量比發芽前減少50%左右,表明發芽有利于蠶豆植酸分解,同時浸泡也是導致水溶性植酸含量減少的原因,這在很多研究中都有報道,并有相同結論[12,25-27]。發芽有利于蠶豆營養品質的改善。子葉是發芽蠶豆的主要食用部分,其質量占到95%以上,因此最大限度地減少子葉中植酸含量尤其重要。本實驗是在常溫和常壓條件下進行的,如果控制發芽條件,特別是控制發芽溫度和浸泡液pH值,對改變植酸酶活性將起到重要作用[18]。因此,提高植酸酶的活性是最大程度降解植酸的關鍵。
以往的研究主要集中在發芽過程中活性物質和酶的產生和變化情況,如在發芽過程中γ-氨基丁酸的產生、植酸酶的合成等[28-30],而對于礦質元素在發芽過程中變化方面的研究較少。本研究表明蠶豆發芽過程中,子葉中鐵含量均在不斷減少,在分生組織比較旺盛的胚根和胚芽中含量則不斷增,原因是胚根和胚芽從子葉中獲得一定數量的鐵供其生長發育所需。有研究[31]表明,根的形成和發育與鐵含量的增加有一定的關系,鐵元素的缺乏會導致根形態發育不良。胚芽主要由活躍的分生細胞構成,在蠶豆形態分化中起到關鍵作用,胚芽中鐵的增加和分生細胞的形成與其細胞壁的構成密切相關。胚芽中鐵含量增加來自于子葉,至于鐵是通過何種途徑運輸的,還有待于進一步研究。胚根和胚芽位于蠶豆形態學的兩端,在發芽過程中含量都顯著增加,原因是子葉中鐵分別通過形態學的上端與下端運輸途徑,并且運輸效率跟元素的種類和性質有關。
總之,在發芽蠶豆的不同部位中鐵的空間分布和含量變化有聯系也有區別,其中鐵在子葉中含量最高,其次是胚軸,胚根和胚芽中則最低,但是隨發芽時間的不斷增加,其含量在不斷增加(P<0.05),在子葉中的情況則相反。
蠶豆發芽過程中可能存在某些機制促使鐵的化學價態發生改變,其中有利于人體吸收的可溶性鐵和二價鐵的比例都顯著增加。因此,通過發芽處理可提高蠶豆中鐵的生物利用度。發芽蠶豆中可溶性總鐵及可溶性二價鐵的比例雖然增加,但是不溶性鐵仍是蠶豆的主要化學形態。因此,需要深入研究發芽蠶豆中鐵化學形態改變的機理,可為提高發芽蠶豆鐵的生物有效性提供理論依據。
4 結 論
發芽是減少蠶豆子葉植酸含量的一種有效方法。在蠶豆發芽過程中,鐵含量以子葉為最高,其次是胚軸,而胚根和胚芽中最低。蠶豆發芽過程中可溶性鐵和二價鐵的比例顯著增加。因此,通過發芽處理可以提高蠶豆中鐵的生物有效性。
[1] 谷成林, 段紅平. 中國蠶豆生產的回顧與發展趨勢[J]. 云南農業大學學報, 2005, 20(5): 671-674.
[2] 焦凌梅, 袁唯. 蠶豆中抗營養因子的研究[J]. 糧油加工與食品機械, 2004, 2(1): 51-53.
[3] 金瑛, 馬冠生. 食物中植酸的分布、含量及其影響因素[J]. 國外醫學: 衛生學分冊, 2005, 32(1): 133-136.
[4] VIDAL-VALVERDE C, FRIAS J, SIERRA I, et al. New functional legume foods by germination: effect on the nutritive value of beans, lentils and peas[J]. European Food Research and Technology, 2002, 215(2): 472-477.
[5] HUSSEIN L, GHANEM K Z. Calcium bioavailability from selected Egyptian foods with emphasis on the impact of germination and fermentation[J]. International Journal of Food Sciences and Nutrition, 1999, 50(2): 351-356.
[6] GIBSON R S. Content and bioaccessibility of trace elements in vegetarian diets[J]. American Journal of Clinical Nutrition, 1994, 59(Suppl 8): 1223-1232.
[7] BADAU M H, NKAMA I, JIDEANI I A. Phytic acid content and hydrochloric acid extractability of minerals in pearl millet as affected by germination time and cultivar[J]. Food Chemistry, 2005, 92(2): 425-435.
[8] ABDALLA A A, El TINAY A H, MOHAMED B E, et al. Effect of traditional process on phytate and mineral content of pearl millet[J]. Food Chemistry, 1998, 63(1): 79-84.
[9] AGARWAL P, CHITNIS U. Effect of treatments on phytate phosphorous, iron bioavailability, tannins and in vitro protein digestibility of grain sorghum[J]. Journal of Food Science and Technology, 1995, 32(2): 453-458.
[10] AHMAD S, PATHAK D. Nutritional changes in soybean during germination[J]. Journal of Food Science and Technology, 2000, 37(3): 665-666.
[11] AMAL B K, AURANG Z, NIZAKAT B, et al. Influence of germination techniques on phytic acid and polyphenols content of chickpea (Cicer arietinum L.) sprouts[J]. Food Chemistry, 2007, 104(8): 1074-1079.
[12] LUO Yuwei, GU Zhenxin, HAN Yongbin, et al. The impact of processing on phytic acid, in vitro soluble iron and Phy/Fe molar ratio of faba bean(Vicia faba L.)[J]. Journal of the Science of Food and Agriculture, 2009, 89(5): 861-866.
[13] 葉茵. 中國蠶豆學[M]. 北京: 中國農業出版社, 2003: 25-50.
[14] 于小冬. 中國營養產業的現狀與發展趨勢[J]. 食品工業科技, 2006, 4(1): 11-12.
[15] HAUG G, LANTZSCH W. Methods for determination of phytate of cereal products[J]. Journal of the Science of Food and Agriculture, 1983, 34(6): 1423-1424.
[16] TINAY K L. Quantitative determination of the elemental, ferrous, ferric, soluble and complexed iron in foods[J]. Journal of Food Science, 1979, 44(2): 549-553.
[17] 徐茂軍. 食品中鐵價態測定方法[J]. 食品科學, 1994, 15(1): 53-56.
[18] 馬璽. 發芽、溫度及pH 對麥類籽實中植酸酶活性的影響[J]. 動物營養學報, 2003, 15(1): 54-57.
[19] 金瑛. 植酸與礦物質的生物利用[J]. 國外醫學: 衛生學分冊, 2005, 32(2): 141-144.
[20] SANGRONIS C J M. Influence of germination on the nutritional quality of Phaseolus vulgaris and Cajanus cajan[J]. LWT - Food Science and Technology, 2007, 40(1): 116-120.
[21] FRIAS J, DOBLADO R, ANTEZANA J R, et al. Inositol phosphate degradation by the action of phytase enzyme in legume seeds[J]. Food Chemistry, 2003, 81(1): 233-239.
[22] 鄭藝梅, 何瑞國, 鄭琳, 等. 糙米發芽過程中營養成分及植酸含量變化的研究[J]. 中國糧油學報, 2006, 21(1): 1-5.
[23] RAGJ P. The impact of germination and dehulling on nutrients, antinutrients, in vitro iron and calcium bioavailability and in vitro starch and protein digestibility of some legume seeds[J]. LWT-Food Science and Technology, 2007, 40(8): 1292-1299.
[24] TRAORW T, ICARD-VERNIERE C M, TRAORE A S, et al. Changes in nutrient composition, phytate and cyanide contents and α-amylase activity during cereal malting in small production units in Ouagadougou (Burkina faso)[J]. Food Chemistry, 2004, 88(1): 105-114.
[25] CHEN L H, WELLS C E, FORDHAM J R. Germinated seeds for human nutrition[J]. Journal of Food Science, 1975, 40(6): 1290-1294.
[26] BALOGUN R O, BIRD S H, ROWE J B. Germination temperature and time affect in vitro fermentability of sorghum grain[J]. Animal Food Science and Technology, 2006, 127(1): 125-132.
[27] KHATTAK A B, ZEB A, BIBI N. Impact of germination time and type of illumination on carotenoid content, protein solubility and in vitro protein digestibility of chickpea (Cicer arietinum L.) sprouts[J]. Food Chemistry, 2008, 92(2): 451-460.
[28] REDDY N R, SATHE S K, SALUNKHE D K. Phytates in legumes and cereals[J]. Advances in Food Researce, 1982, 28: 1-92.
[29] REDDY N R, BALAKRISHNAN C V, SALUNKHE D K. Phytate phosphorus and mineral changes during germination and cooking of black gram (Phaseolus mungo) seeds[J]. Journal of Food Science, 1978, 43(3): 540-543.
[30] LIU Zhenghui, WANG Heyun, WANG Xe, et al. Phytase activity, phytate, iron, and zinc contents in wheat pearling fractions and their variation across production locations[J]. Journal of Cereal Science 2007, 45(2): 319-326.
[31] 李合生. 植物生理學[M]. 北京: 高等教育出版社, 2005: 167-172

